關于光化學反應平衡常數的教學討論
王新平 王旭珍 王新葵 程茜 杜藝 王曉晨
(大連理工大學化工與環境生命學部化學學院 遼寧大連 116024)
化學平衡是化學熱力學的核心內容。由于該部分內容的重要性,它被貫穿于高中化學、本科生無機化學和物理化學的教學中。然而,由于現有教科書缺乏關于光化學反應平衡特殊性的總結,并缺失相應的教學內,導致學生在面對光化學反應的化學平衡問題時,往往會得出錯誤的結果。光化學反應是一類特殊的化學反應,它泛指吸收光能才能實際發生的化學反應[1]。該類反應的平衡與一般化學反應(稱為熱化學反應)的平衡相比有其獨特的規律。筆者認為,將光化學反應平衡的特殊性納入物理化學的教學內容是必要的。通過學習討論其特殊性,不僅可使化學反應平衡知識模塊完整化,更有利于學生在物理化學學習中形成以吉布斯判據為核心的化學熱力學知識框架結構,將其融會貫通。
1 光化學反應平衡常數的推導
在定溫、定壓下,ΔrGm(T,p)>0的化學反應不能自發進行。但是,當環境對反應系統以合適的方式做非體積功,并達到ΔrGm(T,p) 熱和功是系統和環境之間交換的兩種能量形式。傳熱是系統和環境之間在微觀粒子水平上無序程度改變的能量轉移,而作功則是系統和環境間有序的能量轉移。熱機不可能從單一熱源吸熱將其完全轉化為功而不引起其他變化。即,熱機不能持續不斷地從單一熱源吸熱將其完全轉化為功。反之,功則可以持續不斷地轉化為熱(例如電爐)。這就是說,熱和功這兩種能量形式存在“品位”之分。功這種具有“有序”特征的能量形式是高品位的,而熱這種具有“無序”特征的能量形式則是低品位的[2]。能量可以從高品位形式持續不斷地轉化為低品位形式,反之則不能。 光能是一種具有“有序”特征的能量形式。光能可以連續地轉變為電能。例如,人造地球衛星和宇宙飛船可持續地從太陽接受光能并轉化為電能。反之,電能也可以持續地通過電燈轉變為光能。也有很多實踐證明,化學能和電能之間可以完全地相互轉化。公式-ΔrGm(T,p)=-W′給出了定溫、定壓下系統自發的化學反應以可逆的方式進行時,將化學能轉變為電能(-W′傳給環境)的能量轉換關系。公式ΔrGm(T,p)=W′則給出了環境向系統輸入電能(W′)時,使非自發的化學反應以可逆的方式進行的能量關系。按照光化學第二定律[2],光能可完全轉化為化學能。這些實踐結果和認識表明,電能、光能是高品位的能量形式,而系統無論接受電能,還是接受光能,都是接受非體積功。 (1) 對于指定的光化學反應,現假設可被反應吸收的光量子為hν,則在定溫定壓下,由ΔrGm(T,p)≤W′有: ΔrGm(T,p)≤nhν(<0,不可逆;=0,可逆) 式中n為光子hν的物質的量。上式可變為: ΔrGm(T,p)-nhν≤0(<0,不可逆;=0,可逆) (2) 即: (3) 將式(3)代入式(2),有: 于是,在光照下反應達到平衡時,有: (4) 這就是在定溫、定壓下,光化學反應的平衡常數與被反應吸收的光量子數之間的關系式。顯然,由該關系式可知,光化學反應的平衡常數只在一定光強下為一常數。當光強度改變時,它將隨之而變[1]。 因為光化學反應要吸收定量的光量子才能進行,而光子具有物質的屬性,因此將被反應消耗的光子視為“反應物”,在理論上也是成立的。極為有趣的是,從這一觀點出發,便有: 這就是前面推導得到的式(4)。 通常,把光合作用描述為一種將光能轉變為化學能的反應。 在光合反應后,光子這一物質并沒有被放出得到復原,而是被反應吸收掉了(即轉變成化學能被儲存于產物中)。因此,不能把光化學反應理解為“光催化反應”。也就是說,不應將光子視為催化劑,而只能將其歸結為反應吸收的高品位的能量[4],即非體積功。根據愛因斯坦狹義相對論(E=mc2),能量也是廣義的物質。因此,也可將能量理解為廣義上的“反應物”。 在定溫、定壓下,對于一個非自發反應,當環境向系統輸入非體積功W′時,沿式(4)的推導過程,也可得到: (5) 式(5)表述環境向系統輸入任何形式非體積功W′的情況下的平衡規律。環境對系統所作非體積功越多,反應的平衡常數就越大。 參 考 文 獻 [1] 劉俊吉,周亞平,李松林.物理化學.第5版.北京:高等教育出版社,2009 [2] 胡英,呂瑞東,劉國杰,等.物理化學.北京:高等教育出版社,2007 [3] 傅獻彩,沈文霞,姚天揚,等.物理化學.第5版.北京:高等教育出版社,2008 [4] 韓德剛,高執棣,高盤良.物理化學.北京:高等教育出版社,20011.1 光能的屬性
1.2 光化學反應的平衡常數



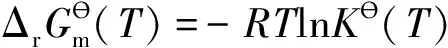

2 依靠非體積功進行的非自發反應
3 結論


