牛蒡子抗腫瘤活性成分及作用機制研究進展△
張興德,張彩琴,劉啟迪,李鵬,秦昆明,蔡寶昌,3*
(1.南京中醫藥大學國家教育部中藥炮制規范化及標準化工程研究中心,江蘇 南京 210029;2.國家中醫藥管理局中藥炮制標準重點研究室,江蘇 南京 201146;3.南京海昌中藥集團有限公司,江蘇 南京 210061)
牛蒡子抗腫瘤活性成分及作用機制研究進展△
張興德1,2,張彩琴1,2,劉啟迪1,2,李鵬1,3,秦昆明1,3,蔡寶昌1,2,3*
(1.南京中醫藥大學國家教育部中藥炮制規范化及標準化工程研究中心,江蘇 南京 210029;2.國家中醫藥管理局中藥炮制標準重點研究室,江蘇 南京 201146;3.南京海昌中藥集團有限公司,江蘇 南京 210061)
牛蒡子是臨床常用中藥,具有抗腫瘤、抗病毒、抗炎、降血糖等多種藥理作用。現代研究表明,木脂素類成分是牛蒡子中的主要抗腫瘤活性成分,其主要抗腫瘤作用機制包括:抑制腫瘤細胞增殖、誘導腫瘤細胞凋亡、直接細胞毒作用、抗腫瘤細胞轉移、免疫增強作用、誘導分化作用以及抗突變作用等。對牛蒡子抗腫瘤主要活性成分及作用機制進行了綜述,為牛蒡子在抗腫瘤方面的臨床應用提供依據。
中藥炮制;牛蒡子;抗腫瘤;作用機理
牛蒡子為菊科2年生草本植物牛蒡屬牛蒡Arctium lappaL.的干燥成熟果實,又名大力子、鼠粘子、惡實等。牛蒡子性寒,味辛、苦,歸肺、胃經,具有疏散風熱,宣肺透疹,解毒利咽的功能。用于風熱感冒,咳嗽痰多,麻疹,風疹,咽喉腫痛,痄腮,丹毒,癰腫瘡毒[1]。現代藥理學研究證明,牛蒡子具有抗腫瘤、抗糖尿病、抗炎、抗病毒、抗菌等作用[2]。20世紀30年代,日本學者田川越等[2]從牛蒡子中分離得到牛蒡子苷(arctiin)和牛蒡子苷元(arctigenin,ARG),其后,國內外對牛蒡子的研究就日益增多,特別是在牛蒡子木脂素類成分抗腫瘤作用方面,取得了系列研究成果,本文主要綜述如下。
1 牛蒡子抗腫瘤活性成分
牛蒡子中木脂素類成分是其中的主要成分[3],主要包括牛蒡酚 A、B、C、D、E、F、H(Lappaol A、B、C、D、E、F、H)、牛蒡子苷、ARG、羅漢松酯素(matairesinol)以及數十種2,3-二芐基丁內酯木脂素等(見圖1),其中ARG單獨或與其他木脂素類化合物聯合后具有抗腫瘤作用[4-7]。
鄭國燦[8]在體外培養的肝癌細胞中加入20 mg·L-1牛蒡子乙醇提取液后,發現癌細胞數減少,具有抑制和殺死體外培養癌細胞的作用。劉抗倫[2]從牛蒡子中分離出木脂素類成分lappaol B、異牛蒡酚A(isolappaol A)、lappaol A,通過對K562細胞進行體外抗腫瘤篩選研究,結果發現上述成分的IC50分別是38.5,53.5,51.1μg·mL-1,顯示出很高的細胞毒性,同時牛蒡子苷還能顯著保護CCl4引起的肝癌[9]。
Hirose M等[10]研究牛蒡子苷對2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(PhIP)引起的大鼠乳腺癌、結腸癌和胰腺癌以及2-氨基-3,8-二甲基咪唑并喹喔啉(MeIQx)引起的雌性F344大鼠肝癌的作用,結果顯示牛蒡子苷能顯著降低PhIP引起的乳腺癌、結腸癌發病率,但對MeIQx引起的肝癌作用不明顯。TakasakiM等[11]研究了牛蒡子苷和牛蒡苷元的抗癌作用,結果發現牛蒡子苷和苷元局部和口服給藥對小鼠皮膚癌均有明顯的活性,但是在進行大鼠肺癌的二相癌變試驗中,發現只有牛蒡子苷元有活性,而牛蒡子苷沒有活性。這一觀點與我國的米靖宇等[12]的研究結論相近,推測ARG是牛蒡子中的直接有效成分,而牛蒡子苷只是前體物質。
牛蒡苷元對小鼠皮膚癌、大鼠肺癌、肝癌有顯著的抑制活性,對白血病模型大鼠的抑制活性尤強[13]。Matsumoto T等[14]研究發現牛蒡子 70%乙醇提取物對B細胞雜交瘤細胞有抗增殖作用,經過生物測定導向的追蹤,7,8-脫氫牛蒡子苷元、牛蒡子苷以及羅漢松脂素對MH60細胞具有抑制增殖作用。Hirano T等[15]發現ARG對白血病細胞株HL-60有強的抑制活性(IC50<100 ng·mL-1),幾乎和目前使用的抗白血病藥物活性相當。
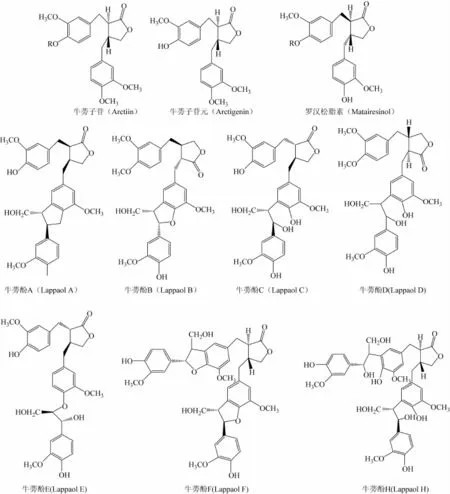
圖1 牛蒡子中主要木脂素類成分結構
2 牛蒡子抗腫瘤作用機制
2.1 細胞周期阻滯作用
細胞周期在腫瘤細胞的生長調控中具有重要的作用,故對腫瘤細胞周期的調節是腫瘤防治的重要策略之一。馬洪德[16]研究發現ARG對人食管癌細胞生長有抑制作用,隨著時間/濃度的增加,抑制作用逐漸增強(P<0.05);ARG可抑制人食管癌細胞由G0/G1向S期轉換,G0/G1期細胞百分率較對照組顯著增加,S期細胞百分率顯著降低,隨ARG濃度增加人食管癌細胞內增殖細胞核抗原(Proliferating cell nuclear antigen,PCNA)表達水平逐漸降低。Matsuzaki Y等[17]研究發現牛蒡子苷通過減少人前列腺癌PC-3細胞周期蛋白D1的表達起到細胞周期阻滯作用,來達到抑制細胞增殖的作用。Jeong JB等[18]研究了牛蒡子苷元對人胃癌細胞SNU-1和AGS的抑制作用,結果發現牛蒡子苷元對人胃癌細胞具有細胞周期阻滯作用,通過調節細胞周期蛋白Rb、cyclinD1、cyclinE、CDK4、CDK2、p21Waf1/Cip1和p15INK4b的表達,阻止細胞從G1期向S期轉化。鄭國燦[19]也研究發現牛蒡子苷能抑制HepG2細胞生長,將HepG2細胞阻滯于G0/G1期,從而起到抗腫瘤作用。
2.2 誘導腫瘤細胞凋亡作用
細胞凋亡指由于細胞內部程序激活而發生的自殺性死亡,細胞凋亡受阻是腫瘤發生的重要機制之一。細胞凋亡的發生與多種凋亡抑制基因和凋亡促進基因相關,如caspase家族,Bcl-2基因,Fas基因,p53基因及C-myc基因等。
2.2.1 對細胞凋亡基因的影響 Bcl-2基因(即B細胞淋巴瘤/白血病-2基因)是一種原癌基因,它具有抑制細胞凋亡的作用[20]。Bcl-2蛋白家族按功能可分為兩類:一類具有抑制凋亡作用,如Bcl-2、Bclxl、Mcl-1等;而另一類具有促進凋亡作用,如Bax、Bcl-xs、Bak等[21],其中,Bcl-2是已知最強的抗凋亡因子,與腫瘤的發生密切相關[22]。Hausott B等[23]研究了牛蒡子苷對結直腸腺瘤和癌細胞的作用,發現牛蒡子苷的細胞凋亡作用與降低線粒體膜電位和下調Bcl-xl有關。鄭國燦等[24]研究了牛蒡子苷元對肝癌SMMC-7721細胞增殖、凋亡的影響,結果發現ARG是通過下調Bcl-2基因在肝癌細胞的表達,激活內源性線粒體凋亡信號通路,從而誘導肝癌細胞凋亡,而牛蒡子苷通過下調Bcl-2蛋白表達,上調Bax蛋白表達,從而誘導HepG2細胞凋亡[19]。王璐等[25]研究發現ARG可引起HL-60及K562細胞DNA發生片段化、上調細胞內caspase-3的酶活力水平,下調Bcl-2表達量,激活線粒體途徑而誘導腫瘤細胞凋亡。Kim JY等[26-27]研究證實牛蒡子苷元能阻斷葡萄糖缺乏引起的非折疊蛋白反應相關基因phosphorylated-PERK、ATF4、CHOP和 GRP78的表達,激活caspase-9和caspase-3,進而通過線粒體途徑引起細胞凋亡。Yoo JY等[6]研究了牛蒡子苷、牛蒡子苷元和羅漢松脂酚對大腸癌細胞和結腸癌細胞的影響,發現牛蒡子苷元通過調節Wnt/β-catenin信號通路,調節CCND1、survivin和CTNNB1基因的表達,引起腫瘤細胞凋亡。
2.2.2 對熱休克蛋白的影響 熱休克蛋白是機體受各種應激原刺激后誘導產生的一組應激蛋白,具有維持蛋白穩定、促進細胞生存等功能,在細胞生長、發育、分化、基因轉錄方面發揮重要作用。熱休克蛋白與腫瘤細胞增殖密切相關,可以通過調控細胞的線粒體和死亡受體信號轉導通路以及應激與生長信號轉導通路,抑制腫瘤細胞凋亡[28]。Ishihara K等[29]研究了牛蒡子苷元在癌細胞中對熱休克蛋白表達的抑制作用,結果發現牛蒡子苷元能抑制熱休克轉錄因子的激活、mRNA的翻譯及熱休克蛋白的生成和積累,從而誘導腫瘤細胞凋亡。
2.2.3 對STAT3的影響 信號轉導子與轉錄活化子3(signal transducer and activator of transcription,STAT3)是細胞傳導與轉錄激活因子家族的重要成員,是一類由細胞因子、生長因子等多肽類配體激活的轉錄因子。STAT3在各種腫瘤細胞中持續被激活,能促使細胞的惡性轉化并阻斷凋亡,因此STAT3信號通路是腫瘤基因治療的一個新的作用靶位。Yao XY等[30]發現ARG刺激蛋白酪氨酸磷脂酶SHP-2的表達,并下調STAT3調控基因產物,包括cIAP2、Bcl-2、Mcl-1表達,并降低STAT3活性增強癌細胞對化療藥物順鉑的敏感性,研究表明ARG能夠誘導腫瘤凋亡,增強順鉑對某些腫瘤細胞的促凋亡作用。
2.2.4 對MUC-1蛋白的影響 粘蛋白1(MUC-1)在許多組織的上皮細胞表面都有豐富表達,對正常的上皮起潤滑和保護作用;同時,MUC-1的異常表達也是多種癌癥的一個顯著特性,所以,MUC-1也被認為是一種腫瘤相關分子。MUC-1能抑制凋亡信號和促進細胞的生長和轉化,具有促使腫瘤細胞發生浸潤和轉移作用。因此,MUC-1在腫瘤的形成和轉移中具有重要作用,也成為抗腫瘤治療的重要靶點。Huang DM等[31]觀察了牛蒡子苷對人前列腺癌PC-3的作用,認為牛蒡子苷通過向下調節MUC-1 mRNA和蛋白表達,實現促進細胞凋亡。
2.3 直接細胞毒作用
細胞毒性是由細胞或者化學物質引起的單純的細胞殺傷事件,不依賴于凋亡或壞死的細胞死亡機理。作用機制包括抑制腫瘤細胞核酸或蛋白質的合成、干擾大分子物質代謝、干擾微管系統、抑制拓撲異構酶等。Moritanis S等[32]研究發現,牛蒡子提取物含某些細胞毒性成分,且具有顯著的抗腫瘤作用。Awale S等[33]篩選了500多種日本草藥提取物,觀察對處于低營養環境中癌細胞的抑制作用,發現牛蒡子二氯甲烷提取物抑制力最強,50μg·mL-1時細胞毒活性達到100%,而在富營養環境中,其細胞毒作用則基本消失。Kang K等[34]對牛蒡子中牛蒡子苷和牛蒡子苷元的直接細胞毒性做了更深入的研究,發現在AGS胃癌細胞和Hepa 1c1c7肝癌細胞中,牛蒡子苷元比牛蒡子苷的細胞毒性強。
2.4 抑制腫瘤細胞轉移
腫瘤的侵襲轉移是腫瘤細胞與宿主細胞間一系列復雜、多步驟相互作用的結果[35],它與細胞黏附因子、細胞外基質降解、細胞移動能力以及細胞跨膜信號傳導機制的改變有關。王兵等[36]采用 MTT法、Transwell法檢測ARG對SMMC-7721細胞黏附、侵襲和轉移的影響,采用裸鼠肺轉移瘤模型體內實驗法,檢測ARG對SMMC-7721細胞肺轉移的影響。結果發現,ARG作用后SMMC-7721細胞黏附率、侵襲率和轉移率顯著下降,其平均黏附抑制率、轉移抑制率和侵襲抑制率分別為43.08%、55.19%和58.21%,并隨著ARG濃度的增加、作用時間的延長,ARG對SMMC-7721細胞及細胞黏附的抑制作用顯著增強。
2.5 抗突變作用
基因突變或染色體畸變是導致癌變的主要途徑,主要是體細胞突變產生的,涉及到兩大類與細胞增殖相關的基因變化,一類是原癌基因的突變,另一類是腫瘤抑制基因的突變。抗突變、抑制畸變對于惡性腫瘤的早期防治具有積極的意義[37]。佐藤昭彥[38]將從牛蒡子中提取得到的牛蒡子苷、lappaol A、lappaol C、lappaol F、牛蒡子苷元作用在人子宮癌細胞JTC-26及人體正常胎兒成纖維細胞HE-1上,證明他們都具有抗癌、抗突變作用。
2.6 免疫增強及誘導分化作用
腫瘤壞死因子是由巨噬細胞產生的僅對腫瘤細胞有殺傷作用而對正常細胞無細胞毒作用的活性因子。它可以直接作用于腫瘤組織,使其出血壞死,并可作為一種免疫調節劑誘發體內各種免疫細胞及細胞因子而發揮抗癌效應。牛蒡子苷元通過調節免疫應答來對活性巨噬細胞和淋巴細胞增殖起到促進作用,同時對TNF-α的產生起到促進作用[39]。牛蒡子苷元對小鼠的骨髓性白血病細胞(M1)有分化誘導作用,是牛蒡子中促M1細胞分化作用最強的化合物。以牛蒡子苷元為母核進行結構修飾來研究促分化作用的構效關系發現,它的脂肪族酯對M1的誘導分化作用強于芳香族酯。正癸酸酯的活性最強,在2μmol·L-1時可誘導超過50%的M1細胞分化為吞噬細胞[40]。
3 存在的問題及展望
3.1 牛蒡子多組分抗腫瘤作用機制研究
牛蒡子中含有多種抗腫瘤組分,如牛蒡子苷、牛蒡酚、羅漢松脂素等,這些成分都具有一定的抗腫瘤作用。目前,牛蒡子抗腫瘤作用機制研究主要集中在牛蒡子苷和牛蒡子苷元方面,在下一步研究中,需要對牛蒡子中多種抗腫瘤組分進行進一步的作用機制研究,闡明牛蒡子多組分的抗腫瘤作用機制,為臨床合理應用和創新藥物研發奠定基礎。
3.2 牛蒡子多組分協同抗腫瘤作用研究
目前,已有研究發現牛蒡子中多種組分的抗腫瘤作用具有協同增效作用。因此,需要對牛蒡子多組分抗腫瘤協同增效作用進行進一步的研究,闡明其作用機制,為牛蒡子更好的應用與臨床奠定基礎。
3.3 牛蒡子抗腫瘤有效成分構效關系研究
牛蒡子中木脂素類成分具有明確的抗腫瘤作用,但是對其抗腫瘤作用的構效關系還缺乏深入的研究。因此,下一步研究中,通過化學合成結合高通量篩選技術,研究牛蒡子木脂素類成分抗腫瘤的構效關系,具有重要研究價值,有望獲得新型療效更好的抗腫瘤候選藥物。
3.4 牛蒡子抗腫瘤活性成分體內過程研究
牛蒡子中含有多種抗腫瘤活性成分,但是對于這些化合物的體內過程,藥代動力學性質還有待進一步研究。因此,需要對牛蒡子中多種抗腫瘤活性成分進行藥代動力學研究,闡明其體內性質,為創新藥物和候選藥物的研究開發奠定基礎。
[1]國家藥典委員會.中國藥典[S].一部.北京:中國醫藥科技出版社,2010:66-67.
[2]劉抗倫.牛蒡子的化學成分研究與抗腫瘤作用初步研究[D].廣州:廣州中醫藥大學,2008.
[3]李燕,孫敬勇,武海艷,等.牛蒡子化學成分及藥理作用研究進展[J].齊魯藥事,2009,28(12):738-741.
[4]Fischer J,Reynolds AJ,Shar PLA,et al.Radical carboxyarylation approach to lignans.total synthesis of(-)-arctigenin,(-)-matairesinol,and related natural products[J].Org Lett,2004,6(9):1345-1353.
[5]Chen GR,Cai LP,Dou DQ,et al.Synthesis of(-)-arctigenin derivatives and their anticancer activity[J].Nat Prod Res,2012,26(2):177-181.
[6]Yoo JH,Lee HJ,Kang K,et al.Lignans inhibit cell growth via regulation of Wnt/beta-catenin signaling[J].Food Chem Toxicol,2010,48(8-9):2247-2252.
[7]Cho MK,Jang YP,Kim YC,et al.Arctigenin,a phenylpropanoid dibenzylbutyrolactone lignan,inhibits MA Pkinases and AP-1 activation via potent MKK inhibition:the role in TNF-alpha inhibition[J].Int Immunopharmacol,2004,4(10-11):1419-1429.
[8]鄭國燦.牛蒡子提取液的抗癌性研究[J].東南大學學報(醫學版),2003,22(5):319-322.
[9]Kim SH, Jang YP, Sung SH.Hepatoprotective dibenzylbutyrolactone lignans of Torreya nucifera against CCl4-induced toxicity in primary cultured rat hepatocytes[J].Biol Pharm Bull,2003,26(8):1202-1205.
[10]Hirose M,Yamaguchi T,Lin C.Effects of arctiin on PhIP-induced mammary,colon and pancreatic carcinogenesis in female Sprague-Dawley rats and MeIQx-induced hepatocarcinogenesis in male F344 rats[J].Cancer Lett,2000,155(1):79-88.
[11]Takasaki M,Konoshima T,Komatsu K,et al.Anti-tumorpromoting activity of lignans from the aerial part of Saussureamedusa[J].Cancer Lett,2000,158(1):53-59.
[12]米靖宇,宋純清.牛蒡子中木脂素類化合物的抗腫瘤及免疫活性[J].時珍國醫國藥,2002,13(3):168-169.
[13]陳世雄,陳靠.牛蒡根化學成分及活性研究進展[J].食品與藥品,2010,12(7):281-284.
[14]Matsumoto T,Hosono-Nishiyama K,Yamada H.Antiproliferative and apoptotic effects of butyrolactone lignans from Arctium lappa on leukemic cells[J].Planta Med,2006,72(3):276-284.
[15]Hirano T,Gotoh M,Oka K.Natural flavonoids and lignans are potent cytostatic agents against human leukemic HL-60 cells[J].Life Sci,1994,55(13):1061-1069.
[16]馬洪德.牛蒡子苷元對人食管癌細胞增殖細胞核抗原表達及細胞周期影響的研究[J].中國實用醫藥,2011,6(32):586-590.
[17]Matsuzaki Y,Koyama M,Hitomi T,et al.Arctiin induces cell growth inhibition through the down-regulation of cyclin D1 expression[J].Oncol Rep,2008,19(3):721-727.
[18]Jeong JB,Hong SC,Jeong HJ.Arctigenin induces cell cycle arrest by blocking the phosphorylation of Rb via the modulation of cell cycle regulatory proteins in human gastric cancer cells[J].Int Immunopharmacol,2011,11(10):1573-1577.
[19]鄭國燦.牛蒡子苷誘導人肝癌HepG2細胞凋亡的實驗研究[J].中國病理生理雜志,2008,24(3):586-587.
[20]錢婧,王科明.藤黃酸抗腫瘤作用靶點的研究進展[J].中國腫瘤,2011,20(6):441-447.
[21]Cory S,Huang DC,Adams JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[22]Heldar S,Basu A,Croce CM.Bcl-2 is the guardian of microtubule integrity[J].Cancer Res,1997,57(2):229-233.
[23]Hausott B,Greger H,Marian B.Naturally occurring lignans efficiently induce apoptosis in colorectal tumor cells[J].J Cancer Res Clin Oncol,2003,129(10):569-576.
[24]鄭國燦,王兵,錢程佳.牛蒡子苷元對肝癌SMMC-7721細胞增殖、凋亡的影響及機制探討[J].山東醫藥,2011,51(14):13-15.
[25]王璐,趙烽,劉珂.牛蒡子苷元誘導人白血病細胞凋亡的作用及機制[J].藥學學報,2008,43(5):542-549.
[26]Kim JY,Hwang JH,Cha MR,et al.Arctigenin blocks the unfolded protein response and shows therapeutic antitumor activity[J].JCell Physiol,2010,224(1):33-40.
[27]Sun S,Wang X,Wang C,et al.Arctigenin suppresses unfolded protein response and sensitizes glucose deprivation-mediated cytotoxicity of cancer cells[J].Planta Med,2011,77(2):141-146.
[28]李霞,鄧華瑜.熱休克蛋白與腫瘤細胞凋亡[J].國外醫學—臨床生物化學與檢驗學分冊,2005,26(11):828-829.
[29]Ishihara K,Yamagishi N,Saito Y,et al.Arctigenin from Fructus Arctii is a novel suppressor of heat shock response in mammalian cells[J].Cell Stress Chaperones,2006,11(2):154-161.
[30]Yao XY,Zhu FF,Zhao ZH,et al.Arctigenin enhances chemosensitivity of cancer cells to cisplatin through inhibition of the STAT3 signaling pathway[J].J Cell Biochem,2011,112(10):2837-2849.
[31]Huang DM,Guh JH,Chueh SC,et al.Modulation of antiadhesionmolecule MUC-1 is associated with arctiin induced growth inhibition in PC-3 cells[J].Prostate,2004,59(3):260-267.
[32]Moritani S,Nomura M,Takeda Y,et al.Cytotoxic components of bardanae fructus(goboshi)[J].Biol Pharm Bull,1996,19(11):1515-1517.
[33]Awale S,Lu J,Kalauni SK,et al.Identification of arctigenin as an antitumor agent having the ability to eliminate the tolerance of cancer cells to nutrient starvation[J].Cancer Res,2006,66(3):1751-1758.
[34]Kang K,Lee HJ,Kim CY.The chemopreventive effects of Saussurea salicifolia through induction of apoptosis and phase II detoxification enzyme[J].Biol Pharm Bull,2007,30(12):2352-2361.
[35]方偉崗.腫瘤細胞侵襲轉移的分子生物學基礎[J].中華醫學雜志,1994,74(7):447-450.
[36]王兵,鄭國燦.牛蒡子苷元對肝癌侵襲轉移的影響[J].世界華人消化雜志,2011,19(7):723-727.
[37]杜建.中藥抗腫瘤機制研究進展[J].福建中醫學院學報,2009,19(4):1-4.
[38]佐藤昭彥.關于生藥類抗腫瘤性的研究—牛蒡子的抗腫瘤性[J].國外醫學—中醫中藥分冊,1987,9(2):111.
[39]Cho JY,Kim AR,Yoo ES,etal.Immunomodulatory effectof arctigen in,a lignan compound,on tumour necrosis factoralpha and nitric oxide production,and lymphocyte proliferation[J].J pharm Pharmacol,1999,51(11):1267-1273.
[40]Umehara K,Nakamura M,Miyase T,et al.Studies on differentiation inducers VI.lignan derivatives from Arctium fructus(Ⅱ)[J].Chem Pharm Bull,1996,44(12):2300-2304.
Research Progress on Anti-cancer Active Com ponents and Action Mechanism of Arctii Fructus
ZHANG Xing-de1,2,ZHANG Cai-qin1,2,LIU Qi-di1,2,LIPeng1,3,QIN Kun-ming1,3,CAIBao-chang1,2,3
(1.Engineering Center of State Ministry of Education for ChineseMedicine Processing,Nanjing University of Chinese Medicine,Nanjing210029,China;2.Key Laboratory of State Administration of TCM for Standardization of Chinese Medicine Processing,Nanjing210046,China;3.Nanjing Haichang Chinese Medicine Group Co.,Ltd,Nanjing210061,China)
Arctii Fructus is a common clinical used traditional Chinese medicine,which has lots of pharmacological effect, such as anti-cancer effect, anti-virus effect, anti-inflammatory action and anti-diabetic effect.Modern research has demonstrated that lignan components are the main anti-cancer components in Arctii Fructus.Themain anti-cancer actionmechanisms involved cancer cells proliferation inhibition,cancer cells apoptosis,cytotoxic effect,cancer cellsmigration inhibitory effect,anti-mutation activity and so on.In this paper,we reviewed the actionmechanisms of themain anti-cancer active components in Arctii Fructus,and provided more information for clinical use of Arctii Fructus in treating cancer
Arctii Fructus;Anti-cancer;Action mechanism
2012-04-13)
江蘇高校優勢學科建設工程資助項目 (ysxk-2010);南京中醫藥大學中藥學一級學科開放課題資助項目(2011ZYX2-013);江蘇省自然科學基金資助項目 (BK2011135);江蘇省企業博士集聚計劃資助項目
*[通訊作者]蔡寶昌,Tel:(025)86798281,E-mail:bccai@126.com

