藍(lán)圓肌肉組織蛋白酶B的純化與性質(zhì)分析
鐘 嬋,沈建東,蔡秋鳳,翁武銀,曹敏杰
(集美大學(xué)生物工程學(xué)院,福建廈門 361021)
鐘 嬋,沈建東,蔡秋鳳,翁武銀,曹敏杰*
(集美大學(xué)生物工程學(xué)院,福建廈門 361021)
在魚糜制品生產(chǎn)過程中,凝膠劣化現(xiàn)象是引起魚糜品質(zhì)下降的重要原因。研究表明,溶酶體中的內(nèi)源性組織蛋白酶B會(huì)促進(jìn)肌原纖維蛋白的降解,進(jìn)而導(dǎo)致魚糜凝膠劣化。迄今為止,多種魚體肌肉中的組織蛋白酶B已有研究,但海水經(jīng)濟(jì)低值魚藍(lán)圓鲹中該酶的情況卻尚未報(bào)道。本研究采用硫酸銨沉淀和柱層析相結(jié)合的方法,從藍(lán)圓鲹肌肉中分離純化得到分子量約為27ku的組織蛋白酶B。酶學(xué)性質(zhì)結(jié)果顯示,該酶最適溫度和最適pH分別為55℃和5.5,半胱氨酸蛋白酶抑制劑E-64能有效抑制其活性。對(duì)肌原纖維蛋白的降解實(shí)驗(yàn)表明,在最適條件下,藍(lán)圓鲹組織蛋白酶B對(duì)肌原纖維蛋白有一定的降解作用。因此,組織蛋白酶B參與肌原纖維蛋白的降解,更可能參與在低pH條件下魚糜凝膠劣化。
藍(lán)圓鲹,組織蛋白酶B,性質(zhì),肌原纖維蛋白
魚糜制品因口感和風(fēng)味良好受到國內(nèi)外消費(fèi)者的歡迎,2009年我國魚糜制品的總產(chǎn)量為84.7萬t,占總水產(chǎn)加工品總量的5.7%[1]。魚糜制品在生產(chǎn)過程中常在55~60℃的溫度帶內(nèi)產(chǎn)生因肌肉結(jié)構(gòu)蛋白分解,導(dǎo)致的凝膠形成能力明顯下降的現(xiàn)象(凝膠劣化)。凝膠劣化不僅影響魚糜制品的彈性,更影響其商品價(jià)值。目前研究表明,酸性半胱氨酸蛋白酶[2-3]和堿性肌原纖維結(jié)合型絲氨酸蛋白酶[4-5]是導(dǎo)致魚糜劣化的主要內(nèi)源性蛋白酶。其中半胱氨酸蛋白酶主要指存在于肌肉細(xì)胞溶酶體中的組織蛋白酶L、B和H,在魚糜凝膠劣化中起著一定的作用。李樹紅[6]等人認(rèn)為,鰱魚(Hypophthalmichthys molitrix)魚肉經(jīng)漂洗后仍殘留組織蛋白酶L、B和H的活性,其中組織蛋白酶L的殘留率為25.79%,組織蛋白酶B為11.46%,而組織蛋白酶 H只有 6.86%。Jiang等人[2,7]的研究表明,組織蛋白酶 B與 L對(duì)鯖魚(Scomber australasicus)的肌原纖維蛋白有著明顯的降解作用。Liu等人[8]發(fā)現(xiàn)組織蛋白酶B和L能夠破壞鰱魚魚糜凝膠的網(wǎng)狀結(jié)構(gòu),進(jìn)而引起凝膠劣化現(xiàn)象。藍(lán)圓鲹作為一種重要的經(jīng)濟(jì)海水魚類,據(jù)統(tǒng)計(jì),2009年的總量為54.0萬t[1]。由于海洋魚類資源的持續(xù)減少,海水紅色肉魚已成為有較高經(jīng)濟(jì)價(jià)值的魚種。但因其肌肉中紅色肉含量多,脂肪含量高,蛋白酶活性強(qiáng),鮮度下降快等問題,紅色肉魚類的資源一直沒有得到合理的利用。因此,研究該魚類肌肉中的組織蛋白酶,尤其是探討導(dǎo)致魚體肌肉軟化的組織蛋白酶的性質(zhì)及其與肌原纖維蛋白降解的關(guān)系,可為解決魚糜生產(chǎn)過程中凝膠劣化問題提供一定的理論依據(jù)。
1 材料與方法
1.1 材料與儀器
新鮮藍(lán)圓鲹(Decapterus maruadsi)、羅非魚(Oreochromis niloticus) 福建省廈門市集美菜市場; SP-Sepharose、Sephacryl S-200 HR層析樹脂 瑞典Amersham Biosciences公司;Z-Phe-Arg-MCA、Z-Arg-Arg-MCA等熒光底物 日本Peptide Institute公司;反-環(huán)氧丁二酰基-L-亮氨酰胺基(4-胍基)(E-64)
美國Amresco公司;Chymostatin、Leupeptin 德國Roche公司;乙二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、N,N,N',N'-四甲基乙二胺(TEMED)、溴酚蘭 美國Sigma公司;標(biāo)準(zhǔn)蛋白 立陶宛Fermentas公司;十二烷基硫酸鈉(SDS,電泳純)、二硫叔糖醇(DTT)、丙烯酰胺 美國Bio-Rad公司;其他試劑
均為國產(chǎn)分析純。
Avanti JA-25大型高速冷凍離心機(jī) 美國Beckman公司;BioPhotometer紫外分光光度計(jì) 德國Eppendorf公司;FP-6200熒光分光光度計(jì) 日本Jasco公司;G:BOX凝膠成像儀 英國Syngene公司; WB-14恒溫水浴鍋 德國Memmert公司。
1.2 實(shí)驗(yàn)方法
1.2.1 組織蛋白酶B的分離純化 藍(lán)圓鲹肌肉中組織蛋白酶B的分離純化主要參考Jiang等人[9]的方法,純化過程中的溶液均含有5mmol/L L-半胱氨酸。取新鮮的藍(lán)圓鲹骨骼肌加入4倍魚肉重量的50mmol/L乙酸鈉緩沖液(pH4.5)(緩沖液A)進(jìn)行組織搗碎,在8,000×g離心30min,用四層絹布過濾取其上清液。上清液經(jīng)過30%~70%硫酸銨鹽析后,沉淀用少量的緩沖液A溶解,在相同的緩沖液中充分透析脫鹽。將透析后的樣品上樣于事先用緩沖液A平衡的SP-Sepharose陽離子交換層析柱(2.5cm× 15cm),緩沖液A流洗去除未吸附的蛋白,再用含0~1mol/L NaCl鹽濃度的緩沖液A進(jìn)行線性洗脫,收集活性峰,用10ku截留膜超濾濃縮。將濃縮后的樣品上樣于用含有0.15mol/L NaCl的20mmol/L Tris-HCl緩沖液(pH7.0)(緩沖液 B)平衡的 Sephacryl S-200 HR凝膠過濾層析柱,收集活性峰,檢測純度及酶活力。
1.2.2 組織蛋白酶B活力的測定 組織蛋白酶活力測定主要參考Barrett等人[10]的方法。組織蛋白酶B以Z-Phe-Arg-MCA和Z-Arg-Arg-MCA為熒光底物,在0.1mol/L的乙酸鈉緩沖液(pH5.5)中進(jìn)行酶活測定,反應(yīng)緩沖液中含1mmol/L EDTA和2mmol/L DTT。
具體步驟如下:在 900μL反應(yīng)緩沖液中,將50μL酶液與50μL濃度為10μmol/L的熒光底物充分混合,在55℃水浴反應(yīng)10min后立刻用1.5mL終止液終止反應(yīng)。反應(yīng)釋放出的7-氨基-4-甲基香豆素(7-amino-4-methycoumarin,AMC)用熒光分光光度計(jì)在激發(fā)光波長為380nm和發(fā)射光波長為450nm下進(jìn)行測定。對(duì)照組的反應(yīng)條件一致,除用緩沖液代替熒光底物。酶活力單位(Units)定義為每分鐘釋放1nmol AMC所需要的酶量。
1.2.3 組織蛋白酶B的性質(zhì)分析
1.2.3.1 溫度對(duì)酶活力的影響 溫度對(duì)酶活力的影響是在0.1mol/L的乙酸鈉緩沖液(pH5.5)中,將組織蛋白酶B在不同溫度(20~70℃)下反應(yīng)10min后,測定其酶活力。以反應(yīng)溫度為橫坐標(biāo),組織蛋白酶B的相對(duì)酶活力為縱坐標(biāo)作圖。
1.2.3.2 pH對(duì)酶活力的影響 pH對(duì)酶活力的影響是在0.1mol/L不同pH緩沖液(pH3.0~8.0)中,組織蛋白酶B在55℃下反應(yīng)10min,測定其酶活力。以反應(yīng)pH為橫坐標(biāo),組織蛋白酶B相對(duì)酶活力為縱坐標(biāo)作圖。其中所用不同pH緩沖液為:0.1mol/L乙酸鈉緩沖液(pH3.0~5.5)、0.1mol/L磷酸鹽緩沖液(pH6.0~7.0)和0.1mol/L Tris-HCl緩沖液(pH8.0)。
1.2.3.3 底物特異性研究 底物特異性是在0.1mol/L的乙酸鈉緩沖液(pH5.5)中,組織蛋白酶 B與10μmol/L的不同類型的熒光底物混合均勻,按酶活測定方法測定其對(duì)不同類型底物的水解程度。以水解Z-Phe-Arg-MCA熒光底物為對(duì)照。所用熒光底物有:Z-Phe-Arg-MCA,Z-Arg-Arg-MCA,Arg-MCA,Boc-Phe-Ser-Arg-MCA,Boc-Gln-Arg-Arg-MC,Boc-Leu-Arg-Arg-MCA,Suc-Ala-Ala-Pro-Phe-MCA,Suc-Leu-Leu-Val-Tyr-MCA。
1.2.3.4 不同抑制劑對(duì)酶活力的影響 抑制劑對(duì)酶活力的影響是在0.1mol/L的乙酸鈉緩沖液(pH5.5)中,組織蛋白酶B與不同類型的抑制劑混合均勻,在4℃下孵育30min后,測定其剩余的酶活力。對(duì)照樣品的反應(yīng)條件一致,但不加任何抑制劑。所用抑制劑有:E-64、Chymostatin、Leupeptin、EDTA和PMSF。
1.2.4 組織蛋白酶B對(duì)肌原纖維蛋白的作用
1.2.4.1 肌原纖維蛋白的制備 由于藍(lán)圓鲹肌肉肌原纖維蛋白(myofibrillar protein,MF)在55℃下,其自身會(huì)發(fā)生明顯的降解[11],因此,選擇自身降解較慢的羅非魚肌原纖維為蛋白降解底物更為合理。肌原纖維的制備主要參照Yanagihara等人[12]的方法。具體如下:新鮮藍(lán)圓鲹取其背部肌肉,加入4倍魚肉重量的20mmol/L Tris-HCl緩沖液(pH7.0)進(jìn)行組織搗碎。在8,000×g離心10min,取沉淀部分重復(fù)上述步驟 4次后,沉淀部分用含 0.5mol/L NaCl的20mmol/L Tris-HCl緩沖液(pH7.0)充分溶解,懸濁液在12,000×g離心20min,用絹布過濾,取上清部分,即為肌原纖維蛋白。
1.2.4.2 組織蛋白酶 B對(duì)肌原纖維蛋白降解的影響 在含有0.5mol/L NaCl和5mmol/L L-半胱氨酸的0.1mol/L乙酸鈉緩沖液(pH5.5)中,將50μL濃度為6mg/mL的藍(lán)圓鲹 MF與30μL酶活力單位為20U/mg的組織蛋白酶B充分混合,在55℃下反應(yīng)不同時(shí)間。時(shí)間梯度為:0、15、30、60、120、180、240、300min。孵育不同時(shí)間后,樣品與上樣緩沖液和5%巰基乙醇充分混合,于95℃加熱10min。樣品進(jìn)行SDS-PAGE電泳分析,觀察肌原纖維蛋白的降解情況。
2 結(jié)果與討論
2.1 組織蛋白酶B的分離純化
樣品經(jīng)過預(yù)處理和硫酸銨鹽析后,上樣于SPSepharose陽離子交換層析柱。由圖1(A)可知,目的蛋白吸附于SP-Sepharose層析柱,而大量的雜蛋白未被層析柱吸附,因此該層析柱能有效地將雜蛋白與目的蛋白分開。吸附部分的蛋白質(zhì)用含0~1mol/L NaCl的緩沖液進(jìn)行線性洗脫,有2個(gè)水解Z-Phe-Arg-MCA的酶活峰被洗脫下來。其中,前者為組織蛋白酶B,后者為組織蛋白酶L。在底物特異方面,組織蛋白酶B與L有著明顯的區(qū)別,組織蛋白酶L只分解熒光底物Z-Phe-Arg-MCA,而組織蛋白酶B不僅水解Z-Phe-Arg-MCA,同是也分解Z-Arg-Arg-MCA熒光底物。因此,本研究的目的蛋白組織蛋白酶B約在0.2mol/L NaCl的鹽濃度下被洗脫下來。將活性峰超濾濃縮后上樣于Sephacryl S-200 HR凝膠過濾層析柱,結(jié)果如圖1(B)所示。對(duì)活性部分進(jìn)行電泳分析,由SDS-PAGE電泳圖譜結(jié)果(圖2)可知純化得到分子量約為27ku左右的單一蛋白條帶。有研究結(jié)果表明,魚類肌肉中的組織蛋白酶B的分子量約為24~29ku,比組織蛋白酶L的分子量相對(duì)低。如花腹鯖魚為 28ku[9],白腹鯖魚(Scomber japonicus)為23ku[13]。根據(jù)分子量和底物特異性的結(jié)果推測本研究純化得到的單一條帶為組織蛋白酶B。從藍(lán)圓鲹肌肉650g中可純化得到0.4mg組織蛋白酶B,得率約為3%,純化倍數(shù)為2619.3倍。

表1 藍(lán)圓鲹組織蛋白酶B的純化表Table 1 Summary of purification of cathepsin B from blue scad(Decapterus maruadsi)
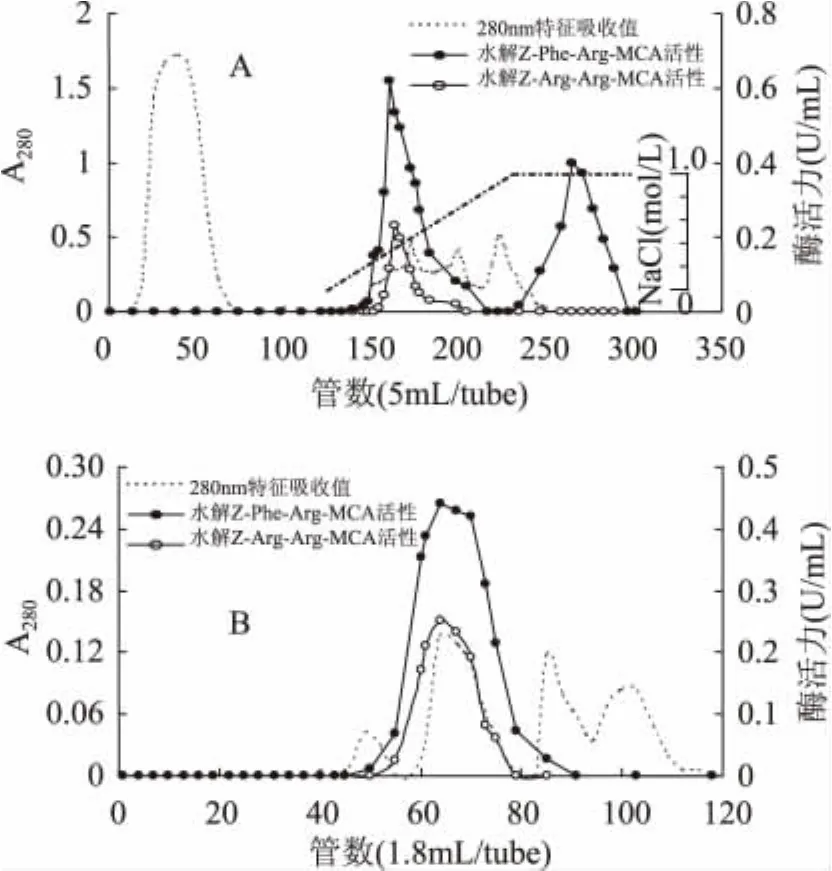
圖1 藍(lán)圓鲹組織蛋白酶B純化柱層析圖Fig.1 Chromatographic purification of cathepsin B from blue scad(Decapterus maruadsi)
2.2 溫度和pH對(duì)酶活力的影響

圖2 藍(lán)圓鲹組織蛋白酶B純化過程的SDS-PAGE圖譜Fig.2 SDS-PAGE of cathespin B from blue scad (Decapterus maruadsi)in the purification processing
如圖3(A)所示,藍(lán)圓鲹肌肉中組織蛋白酶B的最適溫度為55℃。當(dāng)溫度為20℃時(shí),組織蛋白酶B僅表現(xiàn)出最適溫度時(shí)30%左右的酶活力;當(dāng)溫度為70℃時(shí),由于高溫引起的蛋白變性,組織蛋白酶B的活性下降很快,僅為最適溫度時(shí)的10%左右。該結(jié)果與Jiang等人[9]從鯖魚中分離出組織蛋白酶B的溫度性質(zhì)表現(xiàn)相似。
如圖3(B)所示,組織蛋白酶B的最適pH為5.5。當(dāng)pH為4.0時(shí),組織蛋白酶B酶活力相對(duì)較弱,僅有最適pH時(shí)50%的活性;當(dāng)pH大于7.0時(shí),組織蛋白酶B酶活性下降很快,直至pH8.0時(shí),該酶幾乎不表現(xiàn)酶活力。鯖魚[9]和大馬哈魚(Oncorhynchus keta)[14]中都得到相似的結(jié)果。因此,魚糜經(jīng)過清水或者堿水漂洗后,組織蛋白酶B的活性有大部分的損失,但是仍然有部分的殘留[6]。由于魚糜凝膠劣化常常發(fā)生在55~60℃的溫度區(qū)域,組織蛋白酶B的最適溫度與該溫度區(qū)域一致,因此,推測殘留的組織蛋白酶B可能在該溫度下表現(xiàn)出一定的酶活力,從而促進(jìn)肌原纖維蛋白的降解。
2.3 底物特異性研究
組織蛋白酶B對(duì)熒光底物的水解作用表現(xiàn)專一。如表2所示,其僅對(duì)組織蛋白酶底物中的Z-Phe-Arg-MCA和Z-Arg-Arg-MCA產(chǎn)生強(qiáng)烈分解,而對(duì)其他類型的熒光底物,包括胰蛋白酶類底物Boc-Glu-Arg-Arg-MCA、Boc-Leu-Arg-Arg-MCA和Boc-Phe-Ser-Arg-MCA、胰凝乳蛋白酶底物Suc-Ala-Ala-Pro-Arg-MCA和Suc-Leu-Leu-Val-Tyr-MCA以及氨肽酶和組織蛋白酶H的底物Arg-MCA都表現(xiàn)出不分解或者分解程度很低。

圖3 藍(lán)圓鲹組織蛋白酶B的最適溫度(A)和最適pH(B) Fig.3 Optimal temperature(A)and pH(B)of cathepsin B from blue scad(Decapterus maruadsi)
底物特異性是區(qū)別組織蛋白酶B與組織蛋白酶L的重要區(qū)別之一。2種組織蛋白酶對(duì)底物的水解作用都十分專一,只分解組織蛋白酶類的底物。但組織蛋白酶L僅分解在P2位為芳香族氨基酸殘基的Z-Phe-Arg-MCA熒光底物[15-16],而組織蛋白酶B不僅對(duì)Z-Phe-Arg-MCA熒光底物有強(qiáng)烈的分解,對(duì)Z-Arg-Arg-MCA也有明顯的水解作用[9,13]。

表2 組織蛋白酶B的底物特異性Table 2 Substrate specificity of cathepsin B
2.4 不同抑制劑對(duì)酶活力的影響
蛋白酶抑制劑E-64、Leupeptin和Chymostatin對(duì)組織蛋白酶B有強(qiáng)烈的抑制效果。如表3所示。當(dāng)E-64濃度為0.01mmol/L、Chymostatin和 Leupeptin濃度為0.1mmol/L時(shí),幾乎可以完全抑制組織蛋白酶B的酶活力。Chymostatin和Leupeptin不僅是半胱氨酸蛋白酶抑制劑,同時(shí)也分別是胰凝乳蛋白酶和絲氨酸蛋白酶抑制劑。絲氨酸蛋白酶抑制劑PMSF對(duì)組織蛋白酶B沒有表現(xiàn)明顯的抑制作用。金屬蛋白酶抑制劑EDTA的濃度為20mmol/L時(shí),對(duì)組織蛋白酶B有微弱的抑制,但當(dāng)其濃度為5mmol/L時(shí)表現(xiàn)出部分激活的作用。EDTA是巰基活性劑,因此證明組織蛋白酶B是一種巰基蛋白酶,該結(jié)果與Masahiro等人[13]對(duì)白腹鯖魚的研究結(jié)果相似。
2.5 組織蛋白酶B對(duì)肌原纖維的作用
本實(shí)驗(yàn)室之前的研究表明,藍(lán)圓鲹肌原纖維蛋白在55℃下自身降解較快[11],難于判斷外加組織蛋白酶B對(duì)其降解的影響,因此選擇自身降解較慢的羅非魚肌原纖維為實(shí)驗(yàn)原料更為合理。如圖4所示,組織蛋白酶B與羅非魚肌原纖維蛋白在55℃,pH5.5下反應(yīng),當(dāng)反應(yīng)時(shí)間為120min時(shí),肌球蛋白重鏈(Myosin heavy chain,MHC)發(fā)生明顯的降解作用。當(dāng)反應(yīng)時(shí)間延長到300min時(shí),MHC幾乎降解80%。相比于對(duì)MHC的降解,組織蛋白酶B對(duì)肌動(dòng)蛋白和原肌球蛋白的作用并不明顯。因此,組織蛋白酶B較容易作用于MHC的降解,進(jìn)而影響肌原纖維蛋白的結(jié)構(gòu)穩(wěn)定。Jiang等人對(duì)鯖魚的組織蛋白酶B[9]的研究也指出,該蛋白酶對(duì)于鯖魚肌原纖維中的MHC的降解有明顯的促進(jìn)作用[2],與本研究的結(jié)果相似。

表3 抑制劑對(duì)組織蛋白酶B活力的影響Table 3 Effect of inhibitor on cathepsin B
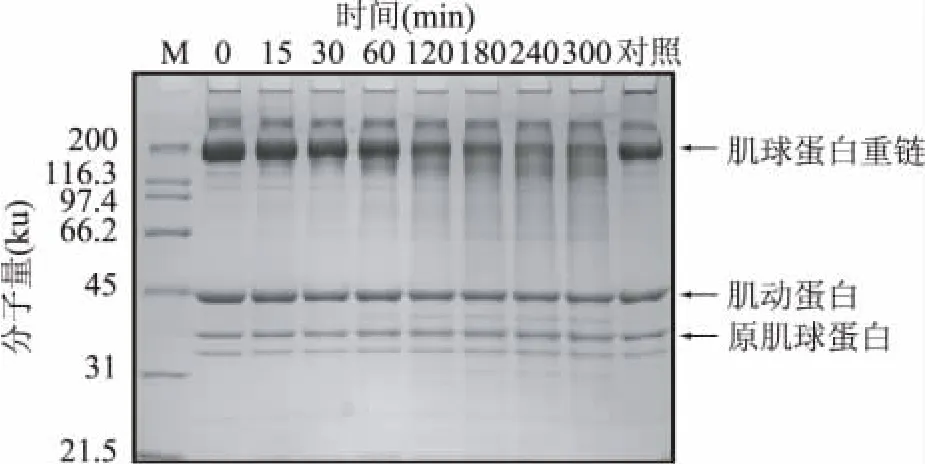
圖4 藍(lán)圓鲹組織蛋白酶B對(duì)肌原纖維蛋白降解的影響Fig.4 Effect of cathepsin B from blue scad (Decapterus maruadsi)on degradation of myofibrillar proteins
據(jù)報(bào)道,魚糜的凝膠劣化常常發(fā)生在溫度55~60℃。因此,魚體中最適溫度為55~60℃的酶類應(yīng)該受到更多的關(guān)注。組織蛋白酶B與L相似,其最適溫度為55℃[9,16],該酶是一種熱穩(wěn)定的蛋白酶。在魚糜的生產(chǎn)過程中,魚肉通常在冰水或者低濃度的堿水中反復(fù)漂洗,去除肌漿中的蛋白酶及色素等其它物質(zhì)。組織蛋白酶B不僅是水溶性的蛋白酶,同時(shí)也是酸性蛋白酶。雖然經(jīng)過反復(fù)的漂洗,但是組織蛋白酶B仍不能完全被去除,李樹紅等人[6]的研究發(fā)現(xiàn),經(jīng)過2次清水和1次鹽水漂洗后,鰱魚肌肉中的組織蛋白酶B殘留率為11.46%。這些殘留的組織蛋白酶B仍可能促進(jìn)肌原纖維的降解。雖然眾多研究認(rèn)為組織蛋白酶L在魚體肌原纖維的降解和魚糜凝膠劣化中起著重要的作用[16-17],但是組織蛋白酶B與L的性質(zhì)相似,該酶在魚體中的作用也十分的重要。Jiang等人[2]研究鯖魚中的肌原纖維降解時(shí),發(fā)現(xiàn)添加一定量的組織蛋白酶B時(shí),對(duì)肌原纖維蛋白的降解有著明顯的促進(jìn)作用,因此,認(rèn)為組織蛋白酶B與肌原纖維蛋白的降解也有著密切的關(guān)系,該結(jié)論與本實(shí)驗(yàn)的結(jié)果相似。盡管組織蛋白酶B在中性pH下對(duì)蛋白的分解作用比肌原纖維結(jié)合型絲氨酸蛋白酶[4-5]弱,但在其酶學(xué)最適條件下,對(duì)肌原纖維蛋白的分解,尤其是對(duì)MHC,有著明顯的促進(jìn)作用。因此,在魚糜制品生產(chǎn)過程中,抑制殘留的組織蛋白酶B的活性,將有可能減少魚肉肌原纖維蛋白的降解作用,部分解決魚糜凝膠劣化的問題。
3 結(jié)論
從藍(lán)圓鲹肌肉中分離純化得到組織蛋白酶B,其分子量約為27ku,得率約為3%,純化倍數(shù)為2619.3倍。純化的組織蛋白酶B能夠被半胱氨酸蛋白酶抑制劑E-64、Leupeptin和Chymostatin強(qiáng)烈抑制。同時(shí),低濃度的EDTA可以激活組織蛋白酶B的酶活力,推測組織蛋白酶B也是一種巰基蛋白酶。在溫度為55℃和pH5.5時(shí),組織蛋白酶B表現(xiàn)最大的酶活力。在該條件下,組織蛋白酶B能夠促進(jìn)肌原纖維蛋白的降解作用,尤其是肌球蛋白重鏈(MHC)的分解。
[1]農(nóng)業(yè)部漁業(yè)局.中國漁業(yè)年鑒2010[M].北京:中國農(nóng)業(yè)出版社,2010:187.
[2]Jiang S T,Lee B L,Tsao C Y,et al.Mackerel cathepsins B and L effects on thermal degradation of surimi[J].Journal of Food Science,1997,62(2):310-315.
[3]Liu H,Yin L,Li S,et al.Effects of endogenous cathepsins B and L on degradation of silver carp(Hypophthalmichthys Molitrix) myofibrillar proteins[J].Journal of Muscle Foods,2008,19(2): 125-139.
[4]Cao M J,Jiang X J,Zhong H C,et al.Degradation of myofibrillar proteins by a myofibril-bound serine proteinase in the skeletal muscle of crucian carp(Carasius auratus)[J].Food Chemistry,2006,94(1):7-13.
[5]Cao M J,Hara K,Osatomi K,et al.Myofibril-bound serine proteinase(MBP)and its degradation of myofibrillar proteins[J]. Journal of Food Science,1999,64(4):644-647.
[6]李樹紅,張楠,劉歡,等.鰱魚背肌肌原纖維蛋白自溶與內(nèi)源組織蛋白酶B,L,H的關(guān)系[J].中國農(nóng)業(yè)大學(xué)學(xué)報(bào),2004,9 (5):71-75.
[7]Jiang S T,Lee J J,Chen H C.Proteolysis of actomyosin by cathepsins B,L,L-like,and X from mackerel(Scomber australasicus)[J].Journal of Agricultural and Food Chemistry,1996,44(3):769-773.
[8]Liu H,Yin L,Zhang N,et al.Isolation of cathepsin B from the muscle ofsilver carp(Hypophthalmichthysmolitrix)and comparison of cathepsins B and L actions on surimi gel softening[J].Food Chemistry,2008,110(2):310-318.
[9]Jiang S T,Lee J J,Chen H C.Purification and characterization of cathepsin B from ordinary muscle of mackerel(Scomber australasicus)[J].Journal of Agricultural and Food Chemistry,1994,42(5):1073-1079.
[10]Barrett A J,Kirschke H.Cathepsin B,cathepsin H,and cathepsin L[J].Methods Enzymol,1981,80:535-561.
[11]Sun L C,Yoshida A,Cai Q F,et al.Mung bean trypsin inhibitor is effective in suppressing the degradation of myofibrillar proteins in the skeletal muscle of blue scad(Decapterus maruadsi)[J].Journal of Agricultural and Food Chemistry,2010,58(24): 12986-12992.
[12]Yanagihara S,Nakaoka H,Hara K,et al.Purification and characterization of serine proteinase from white croaker skeletal muscle[J].Nippon Suisan Gakkaishi,1991,57(1):133-142.
[13]Matsumiya M,Mochizuki A,Otake S.Purification and characterization of cathepsin B from ordinary muscle of common mackerelScomber japonicus[J].Nippon Suisan Gakkaishi,1989,55(12):2185-2190.
[14]Yamashita M,Konagaya S.Purification and characterization of cathepsin B from thewhite muscleofchum salmon,Oncorhynchus keta[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1990,96(4):733-737.
[15]Visessanguan W,Benjakul S,An H.Purification and characterization of cathepsin L in arrowtooth flounder(Atheresthes stomias)muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134(3): 477-487.
[16]Liu H,Yin L,Zhang N,etal.Purification and characterization of cathepsin L from the muscle of silver carp (Hypophthalmichthys molitrix)[J].Journal of Agricultural and Food Chemistry,2006,54:9584-9591.
[17]Hu Y,Morioka K,Itoh Y.Participation of cysteine protease cathepsin L in the gel disintegration of red bulleye(Priacanthus macracanthus)surimi gel paste[J].Journal of the Science of Food and Agriculture,2010,90(3): 370-375.
Purification and characterization of cathepsin B from the skeletal muscle of blue scad(Decapterus maruadsi)
ZHONG Chan,SHEN Jian-dong,CAI Qiu-feng,WENG Wu-yin,CAO Min-jie*(College of Biological Engineering,Jimei University,Xiamen 361021,China)
During the manufacturing process of surimi,the modori phenomenon was an important factor that affected the final quality of the products.According to current studies,cathepsin B in the lysosome played a significant role in the degradation of myofibillar proteins.Cathepsin B in the muscle of various species of fish had been investigated.However,cathepsin B in marine fish blue scad(Decapterus maruadsi)was infrequently reported.In the present study,cathepsin B was purified by ammonium sulfate precipitation and a series of column chromatographies.SDS-PAGE showed that the molecular mass of the purified enzyme was about 27ku.The optimal temperature and pH of the enzyme were 55℃ and 5.5,respectively.Cathepsin B was effectively inhibited by cysteine proteinase inhibitor E-64.Under optimal conditions,cathepsin B could promote the degradation of myofibrillar proteins.Therefore,cathepsin B might participate in not only degradation of myofibrillar proteins,but also modori at acidic pH range.
Decapterus maruadsi;cathepsin B;characterization;myofibrillar protein
TS201.2+5
A
1002-0306(2012)10-0108-05
2011-10-13 *通訊聯(lián)系人
鐘嬋(1986-),女,碩士研究生,主要從事食品生物技術(shù)方面的研究。
國家自然科學(xué)基金(31071519);廈門市科技計(jì)劃項(xiàng)目(3502Z20111042)。

