Oct3/4在體外誘導大鼠骨髓間質(zhì)干細胞神經(jīng)分化中的作用*
王舒陽, 韓 瑞, 張廣宇, 王翠琴, 彭 越, 魯晶晶, 彭 濤, 賈延劼
(鄭州大學第一附屬醫(yī)院神經(jīng)內(nèi)科, 河南 鄭州 450052)
1000-4718(2012)03-0385-08
2011-10-13
2011-11-28
國家自然科學基金資助項目(No.30770758;No.81071114)
△通訊作者 Tel:0371-66295112; E-mail:jiayanjie1971@yahoo.com.cn
·論著·
Oct3/4在體外誘導大鼠骨髓間質(zhì)干細胞神經(jīng)分化中的作用*
王舒陽, 韓 瑞, 張廣宇, 王翠琴, 彭 越, 魯晶晶, 彭 濤, 賈延劼△
(鄭州大學第一附屬醫(yī)院神經(jīng)內(nèi)科, 河南 鄭州 450052)
目的探討Oct3/4在體外誘導大鼠骨髓間充質(zhì)干細胞(MSCs)分化為神經(jīng)元中的作用。方法構(gòu)建大鼠Oct3/4慢病毒載體(Oct3/4-LV)并感染大鼠MSCs;實驗分為感染組(感染Oct3/4-LV)、陰性對照組(感染FU-PGC-NC-LV)和未感染組3組;采用β-巰基乙醇誘導各組大鼠MSCs分化為神經(jīng)元。倒置熒光顯微鏡下觀察MSCs感染后形態(tài)學變化;MTT法檢測細胞存活率;免疫細胞化學法檢測神經(jīng)元烯醇化酶(NSE)、微管相關(guān)蛋白 2(MAP-2)、膠質(zhì)纖維酸性蛋白(GFAP) 和Oct3/4的表達變化;Western blotting法檢測MAP-2和Oct3/4蛋白的表達變化;RT-PCR法檢測MAP-2和Oct3/4 mRNA的表達變化。結(jié)果(1)陽性克隆PCR證明大鼠Oct3/4慢病毒載體構(gòu)建成功,孔稀釋法測定病毒滴度為2×1011TU/L。(2)倒置顯微鏡下觀察大鼠Oct3/4慢病毒載體感染成功,感染復數(shù)(MOI)值為10,感染48 h時感染率最高,熒光表達最強;感染率可達83.4%±2.2%。感染組中,MSCs形態(tài)發(fā)生變化;MTT提示感染組細胞存活率顯著降低(P<0.05)。(3)β-巰基乙醇可以誘導大鼠MSCs向神經(jīng)元分化,其中以感染組誘導效果最佳,具有比較典型的神經(jīng)元形態(tài),NSE和MAP-2的表達率與其它各組相比顯著增高(P<0.05)。(4)感染組與其它各組同時點的Oct3/4表達相比均顯著增高(P<0.01)。并且隨著誘導時間的延長,各組Oct3/4表達持續(xù)減少,誘導后5 h與誘導前相比存在顯著差異(P<0.05)。結(jié)論Oct3/4在大鼠MSCs分化為神經(jīng)元的過程中可能起到了重要的調(diào)控作用。
Oct3/4; 骨髓間充質(zhì)干細胞; 神經(jīng)元; 慢病毒
Oct3/4是POU域家族轉(zhuǎn)錄因子中的一員,主要表達于胚胎干細胞及生殖細胞中,是胚胎干細胞多潛能性的維持因子和生殖系細胞的調(diào)控因子,是目前已知的與胚胎發(fā)育全能性相關(guān)的重要轉(zhuǎn)錄因子,是哺乳動物體內(nèi)全能性胚胎干細胞的標志物[1]。骨髓間充質(zhì)干細胞(mesenchymal stem cells, MSCs)是一種具有多向分化潛能的干細胞,在特定條件下可以向神經(jīng)元等分化[2],但具體分化機制尚不清楚。Niwa等[3]指出Oct3/4對細胞分化的控制是劑量依賴性的,其mRNA轉(zhuǎn)錄水平,或者說蛋白表達水平的不同可能是維持細胞不同的分化狀態(tài)的主要因素,并且在誘導胚胎干細胞向神經(jīng)元分化過程中,Oct3/4的表達水平總是與神經(jīng)發(fā)生能力相對應,經(jīng)過連續(xù)傳代,Oct3/4的含量持續(xù)減少,神經(jīng)發(fā)生能力也隨之降低。那么Oct3/4是否在MSCs向神經(jīng)元分化過程中起作用尚不清楚。本研究構(gòu)建Oct3/4基因慢病毒載體,將其感染大鼠MSCs,然后觀察Oct3/4在大鼠MSCs在誘導分化為神經(jīng)元過程中的表達變化,探討Oct3/4在大鼠MSCs橫向分化為神經(jīng)元中作用。
材 料 和 方 法
1細胞來源
SPF級Wistar大鼠股骨中分離提取MSCs,連續(xù)傳10代以上,液氮凍存,實驗前常規(guī)復蘇。其中SPF級Wistar大鼠,雌雄不限,150~200g,由河南省實驗動物中心提供,許可證號為SCXK(豫) 2005-0001。293T細胞由鄭州大學生物化學教研室惠贈。
2主要試劑
AgeI購自NEB;In-FusionTMPCR Cloning Kit購自Clontech;pGC-FU載體和病毒包裝3個質(zhì)粒:pGC-LV載體、pHelper 1.0 載體和 pHelper 2.0 載體均購自上海吉凱基因化學有限公司;DMEM、Opti-MEM液體培養(yǎng)基、胎牛血清和Lipofectamine 2000購自Invitrogen;Oct3/4(Oct3/4 H-134,sc-9801)、神經(jīng)元特異性烯醇化酶(neuron-specific enolase, NSE H-300,sc-15343)、微管相關(guān)蛋白 2(microtubulin-associated protein 2,MAP-2,sc-20172)和膠質(zhì)纖維酸性蛋白(glial fibrillary acidic protein, GFAP H-50,sc-9065)兔抗多克隆抗體購自Santa Cruz;Cy3標記山羊抗兔IgG(H+L)購自碧云天公司;RNeasy Mini試劑盒、Qiagen? OneStep RT-PCR試劑盒購自Qiagen;凝聚胺(polybrene)、多聚賴氨酸、噻唑藍(MTT)購自Sigma;其它生化試劑均為進口分裝或國產(chǎn)分析純。所用引物由上海吉凱基因技術(shù)有限公司根據(jù)設計合成,見表1。
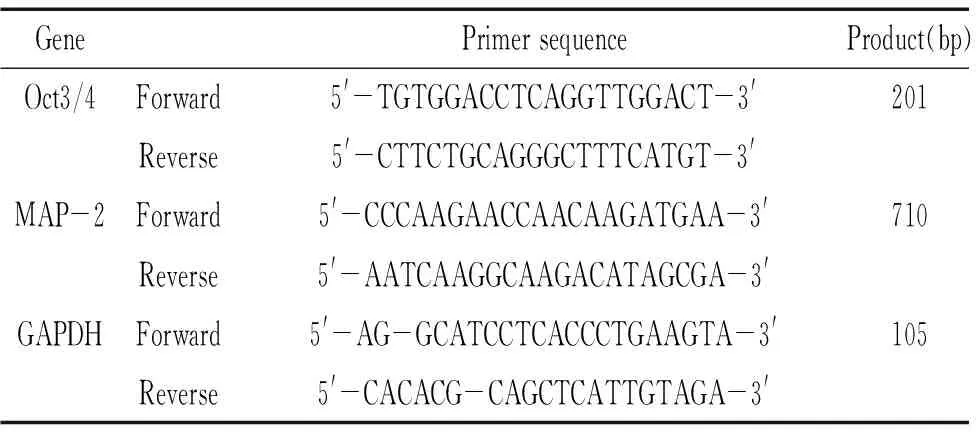
表1 引物序列
3主要方法
3.1Oct3/4慢病毒載體的構(gòu)建
3.1.1目的基因的獲取及慢病毒載體質(zhì)粒的構(gòu)建 首先按照NCBI數(shù)據(jù)庫中查找的Oct3/4(Gene ID: 18999)的序列,設計含有AgeI酶切位點的引物序列。上述設計引物進行PCR擴增,瓊脂糖電泳分離純化。應用AgeI酶將pGC-FU 載體及純化的PCR產(chǎn)物分別進行酶切消化,轉(zhuǎn)化大腸桿菌感受態(tài)細胞進行陽性克隆PCR鑒定。
3.1.2慢病毒的包裝、濃縮及測定 感染前24 h,以6×108/L密度將293T細胞接種于15 cm2細胞培養(yǎng)皿,細胞密度達70%~80%時可用于轉(zhuǎn)染。常規(guī)將各DNA溶液(pGC-LV 載體20 μg,pHelper 1.0載體15 μg,pHelper 2.0載體10 μg)與 Lipofectamine 2000混合,室溫下轉(zhuǎn)染293T細胞,37 ℃、5% CO2細胞培養(yǎng)箱中培養(yǎng)8 h后,轉(zhuǎn)入含10%血清的細胞培養(yǎng)基37 ℃、5%CO2繼續(xù)培養(yǎng)48 h。離心收集轉(zhuǎn)染后的293T細胞上清液,分裝后-80 ℃保存。同樣方法制備僅含GFP報告基因的陰性對照慢病毒載體。采用孔稀釋法進行病毒滴度測定,倒置熒光顯微鏡下觀察感染后細胞GFP表達情況。
3.1.3感染復數(shù)(multiply of infection,MOI)的測定 參考我們的方法[4],倒置熒光顯微鏡下觀察各組細胞熒光表達情況,計數(shù)熒光陽性細胞的百分比。
3.2大鼠MSCs感染及實驗分組 感染前1d,取培養(yǎng)10代以上的大鼠MSCs,以2×109/L的密度接種至24孔板,置于37 ℃、5% CO2培養(yǎng)箱內(nèi)培養(yǎng)。感染時,每孔細胞中加入含有Oct3/4-LV病毒液,以最適MOI值進行感染;陰性對照組加入僅含F(xiàn)U-PGC-NC-LV的病毒液,以相同的MOI值進行感染。
根據(jù)感染情況將同時點的MSCs細胞分為3組,感染組:感染Oct3/4-LV,即含有Oct3/4慢病毒和GFP;陰性對照組:感染FU-PGC-NC-LV,即只含有GFP;未感染組:不感染慢病毒,其它培養(yǎng)條件同感染組。在倒置顯微鏡下觀察感染后24、48、72、96 h細胞形態(tài)學變化及GFP熒光表達情況,評價細胞感染效率。MTT比色法評價各組細胞存活率[4],在酶標儀570 nm處讀取各組的吸光度值(A)。
3.3體外誘導MSCs分化為神經(jīng)元 取各組細胞進行誘導實驗。參考我們的方法[4],DMEM完全培養(yǎng)基,D-Hanks’液清洗3次,加入預誘導液(DMEM培養(yǎng)基+10%胎牛血清+1 mmol/L β-巰基乙醇)置于37 ℃、5% CO2條件下培養(yǎng)24 h。預誘導后,加入誘導液(DMEM培養(yǎng)基,5~10 mmol/L β-巰基乙醇),37 ℃、5% CO2條件下培養(yǎng)5 h。
3.4免疫細胞化學染色法 將各組細胞用PBS清洗之后,迅速經(jīng) 4%多聚甲醛的固定液中于 4 ℃固定過夜,0.2% Triton X-100處理10min,并用封閉液封閉1 h。然后分別用Oct3/4抗體(2.0 mg/L)、NSE抗體(1.0 mg/L)、MAP-2抗體(1.0 mg/L)和GFAP抗體(1.0 mg/L)4 ℃孵育 24 h。用PBS 洗3遍后,用Cy3標記山羊抗兔IgG(1∶200)在室溫下進行染色標記,DAPI復染后,觀察。
細胞圖像通過顯微鏡用× 20攝取。每組獨立的實驗都會采集超過30個區(qū)域的細胞。而且,在明視野下所采集的每幅圖像都盡量包含相同的細胞數(shù)目。應用Image-Pro Plus 6.0專業(yè)圖像分析軟件分析各實驗組的熒光圖片單個細胞的累積吸光度值,進行統(tǒng)計學分析。
3.5Western blotting 分別收集各組細胞,PBS液漂洗1遍,按照106加入100 μL雙去污裂解液(10 mmol/L pH 6.8 Tris-HCl,1%SDS,1%Triton-X100,100 mg/L PMSF,100 mg/L抑肽酶)的比例充分裂解細胞,4 ℃ 12 000 r/min離心10 min,保留上清,-80 ℃貯存?zhèn)溆茫訠CA法測定總蛋白濃度。SDS-PAGE采用5%濃縮膠,8%分離膠,上樣量為100 μg,電壓90 V恒壓18 min跑到濃縮分離交界處,更改電壓為120 V,繼續(xù)電泳55 min。電泳結(jié)束后取出凝膠轉(zhuǎn)移至同等大小的硝酸纖維素膜上。轉(zhuǎn)移后的硝酸纖維素膜置于封閉液(含5%脫脂奶粉的TBST溶液)4 ℃過夜,加入兔抗Oct3/4多克隆抗體(1∶100),室溫處理2 h,TBST漂洗10min×3次;辣根過氧化物酶聯(lián)抗兔IgG(1∶5 000),室溫處理2 h,PBST漂洗10 min×3次;ECL顯色液中反應至條帶清晰。
3.6RT-PCR 采用RNeasy Mini試劑盒分離純化各組細胞的總RNA,分光光度法測定計算提取的總RNA含量及濃度。參照Qiagen? OneStep RT-PCR試劑盒實驗操作說明進行RT-PCR,總反應體系50.0 μL,其中5×Qiagen OneStep RT-PCR 緩沖液10.0 μL,dNTP Mix 2.0 μL,Qiagen OneStep RT-PCR Enzyme Mix 2.0 μL,5×Q-Solution 10.0 μL,RNase 抑制劑10 U,RNA 1.0 μg,引物 0.6 μmol/L。擴增條件為:50 ℃逆轉(zhuǎn)錄30 min,94 ℃預變性3 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35個循環(huán),72 ℃ 5 min。然后,取RT-PCR產(chǎn)物10.0 μL,加上樣緩沖液2.0 μL,在2%瓊脂糖凝膠上電泳,80 V 30 min,凝膠圖像成像系統(tǒng)拍攝保存實驗結(jié)果,凝膠圖像分析系統(tǒng)(Gel-Pro Analyzer 3.0)分析各目的基因與β-actin基因條帶灰度值,計算出相對表達量。
4統(tǒng)計學處理
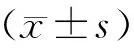
結(jié) 果
1Oct3/4慢病毒載體的構(gòu)建及滴度測定
將Oct3/4重組質(zhì)粒進行陽性克隆的PCR鑒定,PCR產(chǎn)物1 266 bp,見圖1。選取陽性克隆測序,測序結(jié)果與Oct3/4序列完全一致。證明大鼠Oct3/4慢病毒載體構(gòu)建成功,見圖2。將收集的慢病毒液以10倍梯度稀釋后,分別感染293T 細胞,計算出慢病毒的最終滴度為2×1011TU/L。
2Oct3/4慢病毒感染MSCs
感染24 h后,感染組MSCs部分細胞收縮呈圓形、梭形,少數(shù)細胞脫落、死亡。倒置熒光顯微鏡下觀察,感染組中在細胞核可以觀察到部分綠色熒光;而陰性對照組可見綠色熒光分布在細胞質(zhì)中。感染48 h時,轉(zhuǎn)染成功的細胞,立體感增強,細胞數(shù)量有所增加,GFP表達最理想。其中MOI值為10,感染48 h時感染率最高,熒光表達最強,感染率可達83.4%±2.2%,陰性對照組和感染組GFP感染率沒有明顯差異,但是細胞形態(tài)變化沒有感染組顯著,見圖3、表2。
Figure 1. PCR results for constructedOct3/4 vector. A:ddH2O; B:empty vector; C:GAPDH; D:marker; F: nothing; E,G-I:transformant ofOct3/4.
圖1Oct3/4慢病毒載體構(gòu)建PCR結(jié)果
Figure 2.Oct3/4 lentiviral vector.
圖2Oct3/4慢病毒載體構(gòu)建
MTT結(jié)果提示,感染前各組MSCs的細胞活性無統(tǒng)計學意義(P>0.05);感染24 h,感染組細胞活性顯著下降,與各對照組比較均有統(tǒng)計學意義(P<0.05),各對照組之間無統(tǒng)計學意義。感染48 h、72 h、96 h后細胞活性值雖較24 h有所上升(P<0.05),但與其它組比較仍有統(tǒng)計學意義(P<0.05),見表3。
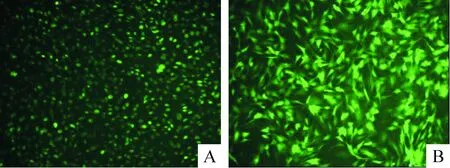
Figure 3. The cell infection rate (48 h after transfection, ×200). A: transfection group; B: positive control group.
圖3慢病毒感染4d的細胞感染率

表2 細胞感染效率

表3 各組MSCs細胞活性
*P<0.05vsother groups.
3β-巰基乙醇體外誘導MSCs分化為神經(jīng)元
3.1形態(tài)學觀察 未感染組MSCs誘導后細胞形態(tài)結(jié)構(gòu)變化較慢。誘導5 h,少量細胞出現(xiàn)神經(jīng)元改變,胞體收縮呈多角形或圓形,突起細長,有數(shù)個分支,部分在局部形成網(wǎng)絡。多數(shù)細胞仍未發(fā)生變化,呈扁平樣,無突起。感染Oct3/4慢病毒組誘導后,細胞形態(tài)變化更為明顯,誘導5 h多數(shù)細胞胞體收縮呈圓形、錐形,細胞突起細長,交織成網(wǎng),立體感較強,形成較典型的神經(jīng)元結(jié)構(gòu),少量細胞脫落、死亡。陰性對照組類似于未感染組,見圖4。
3.2免疫細胞化學染色法 未感染組誘導5 h,神經(jīng)元標記物NSE和MAP-2有少量表達。陰性對照組與未感染組類似。感染組誘導5 h,NSE和MAP-2的表達均顯著高于其它各組(P<0.05)。各組GFAP表達率均小于1%,無顯著差異,見圖5、6及表4。
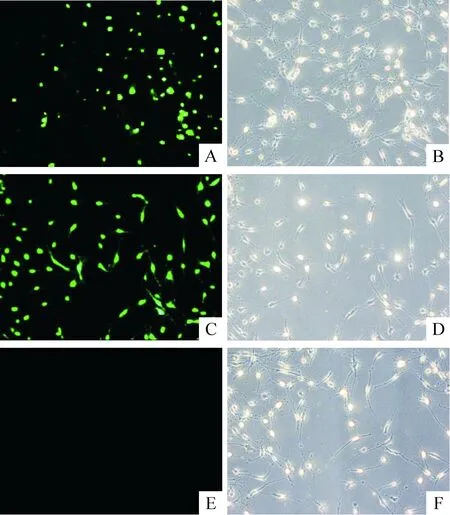
Figure 4. β-mercaptoethanol induced MSCs into neurons(×200). A,B:transfection group; C,D: negative control group; E,F: non-transfection group.
圖4β-巰基乙醇誘導各組MSCs向神經(jīng)元分化
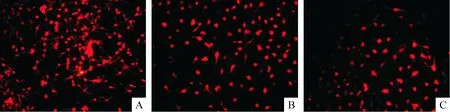
Figure 5. β-mercaptoethanol induced MSCs into neurons and expression of MAP-2 5 h after induction (×200). A: transfection group; B: negative control group; C: non-transfection group.
圖5β-巰基乙醇誘導各組MSCs向神經(jīng)元分化和MAP-2的表達
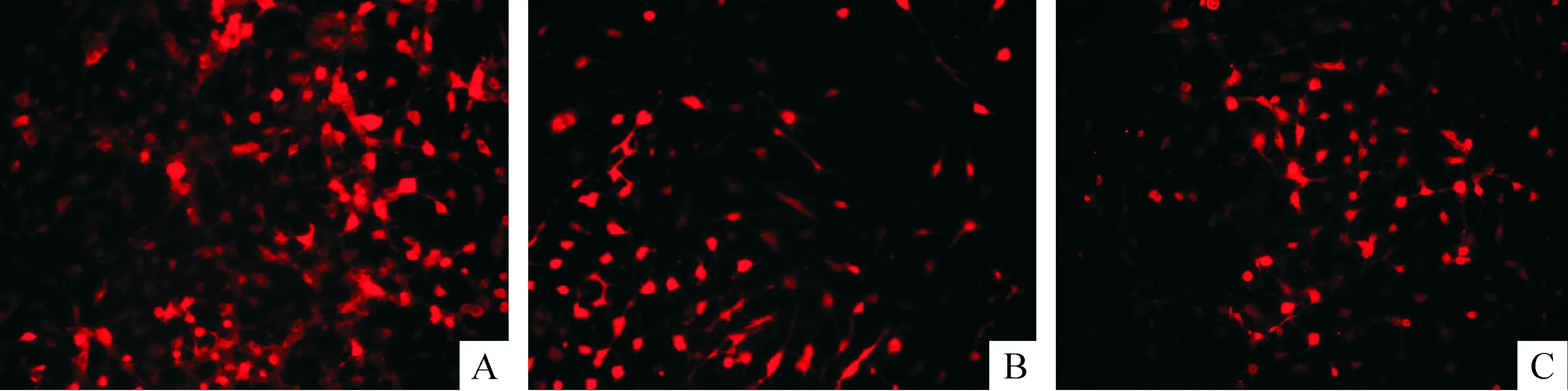
Figure 6. β-mercaptoethanol induced MSCs into neurons and expression of NSE 5 h after induction (×200). A: transfection group; B: negative control group; C: non-transfection group.
圖6β-巰基乙醇誘導各組MSCs向神經(jīng)元分化和NSE的表達
表4β-巰基乙醇誘導5h各組細胞免疫化學染色結(jié)果

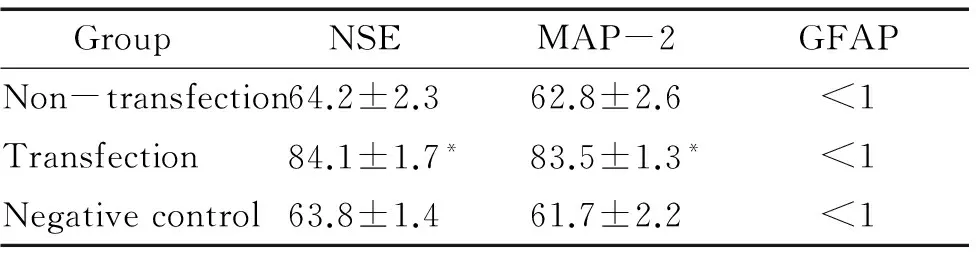
GroupNSEMAP-2GFAPNon-transfection64.2±2.362.8±2.6<1Transfection84.1±1.7*83.5±1.3*<1Negativecontrol63.8±1.461.7±2.2<1
*P<0.05vsother groups.

圖7MAP-2蛋白的表達
3.3Western blotting結(jié)果 各組分別誘導分化5 h,均可見MAP-2表達,MAP-2蛋白量為74 kD。并且未轉(zhuǎn)染組和陰性對照組無明顯差異,感染組MAP-2的表達較前2組顯著增高,見圖7。
3.4RT-PCR結(jié)果 各組分別誘導分化5 h,MAP-2 mRNA均有表達,擴增產(chǎn)物為710 bp。未轉(zhuǎn)染組和陰性對照組無明顯統(tǒng)計學差異,感染組MAP-2的表達較前2組顯著增高,見圖8。
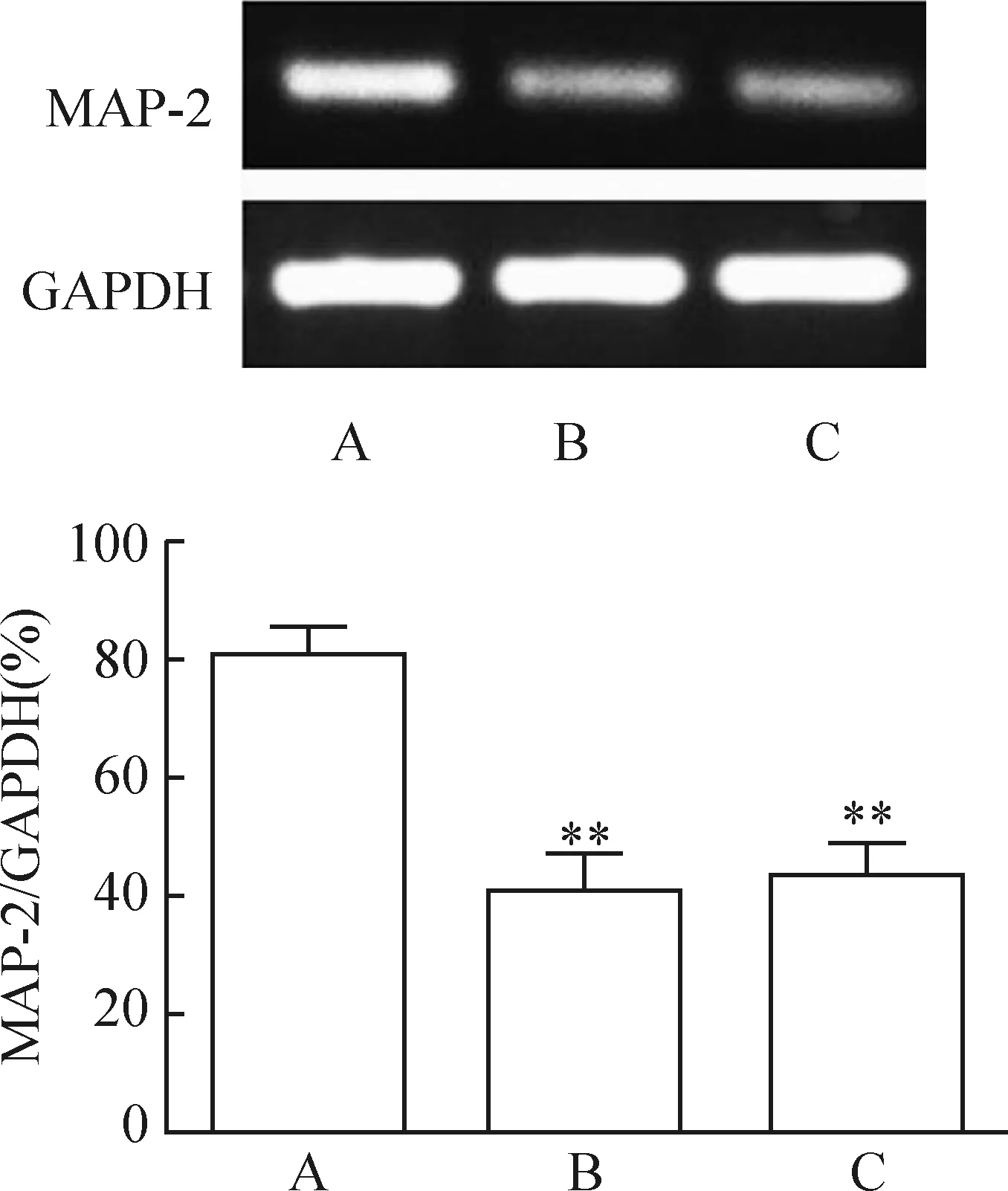
圖8MAP-2mRNA的表達
4Oct3/4的表達變化
4.1免疫細胞化學染色結(jié)果 誘導前,未感染組細胞核中有部分Oct3/4表達。陰性對照組與未感染組無明顯差異。感染組細胞核中Oct3/4表達明顯增強,與其它各組相比有顯著差異(P<0.01)。誘導分化5 h后,各組細胞中Oct3/4表達顯著減少(P<0.05),但感染組Oct3/4表達仍顯著高于其它2組(P<0.01),見圖9、表5。
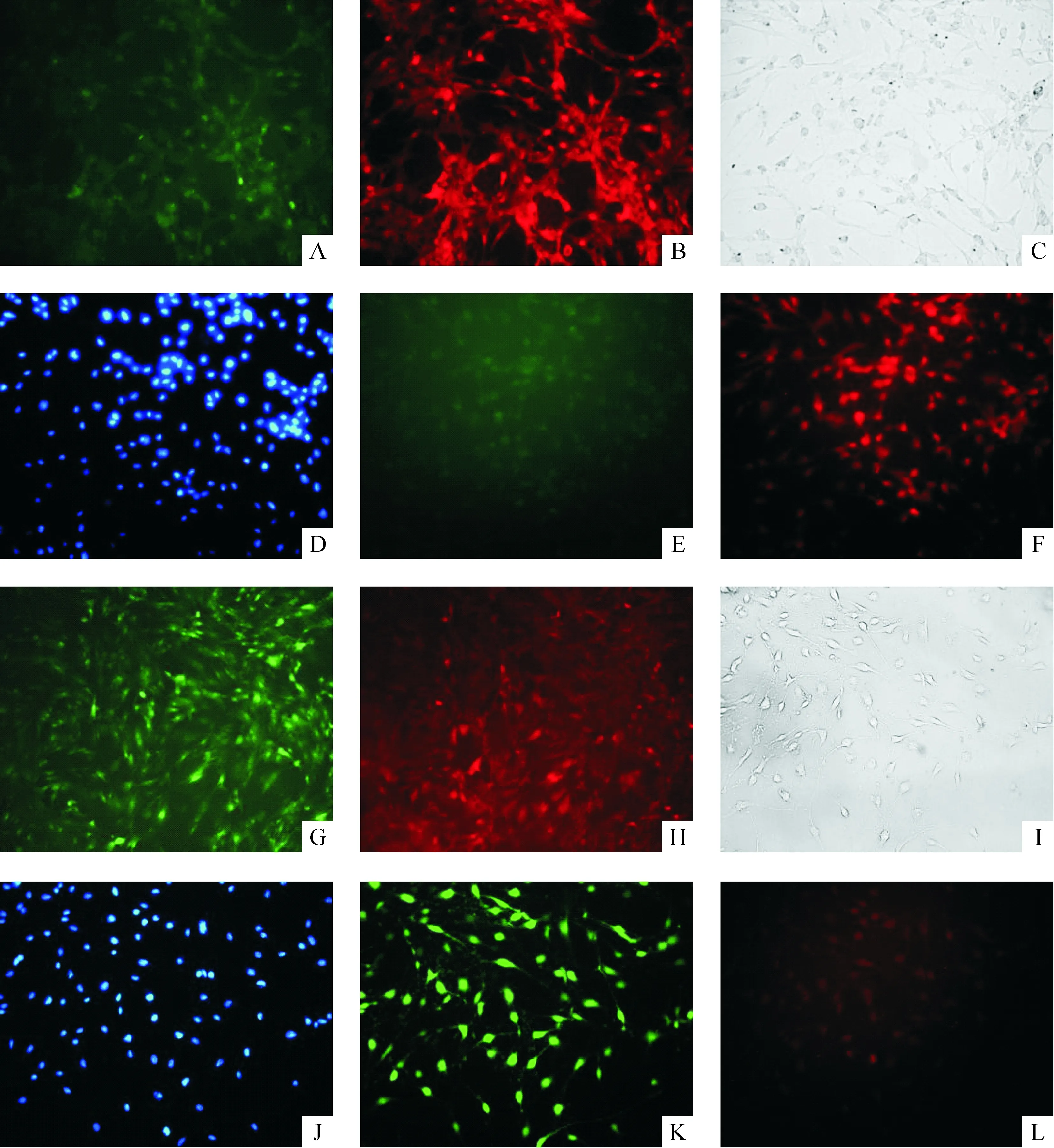
Figure 9. β- mercaptoethanol induced MSCs into neurons and expression of Oct3/4 5 h after induction (Cy3 and DAPI straining, ×200). A,B:transfection group before induction; C-F:transfection group 5 h after induction; G,H: negative control group before induction; I-L: negative control group 5 h after induction.
圖9β-巰基乙醇誘導各組MSCs向神經(jīng)元分化和Oct3/4的表達
表5β-巰基乙醇誘導5h各組細胞Oct3/4免疫化學染色結(jié)果

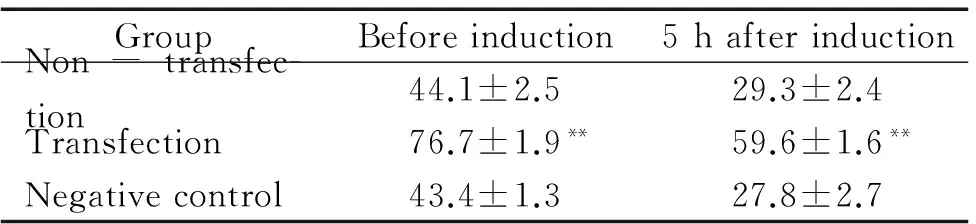
GroupBeforeinduction5hafterinductionNon-transfec-tion44.1±2.529.3±2.4Transfection76.7±1.9**59.6±1.6**Negativecontrol43.4±1.327.8±2.7
**P<0.01vsother groups.
4.2Western blotting結(jié)果 誘導前,各組均有Oct3/4表達,Oct3/4蛋白分子量為46 kD。其中,感染組Oct3/4蛋白表達明顯高于其它各組(P<0.05),陰性對照組與未感染組相比無明顯差異。誘導分化5 h后,各組Oct3/4蛋白量表達較誘導前均顯著減少(P<0.05),陰性對照組與未感染組相類似,無顯著差異,感染組Oct3/4蛋白量表達仍顯著高于其它2組(P<0.05),見圖10。
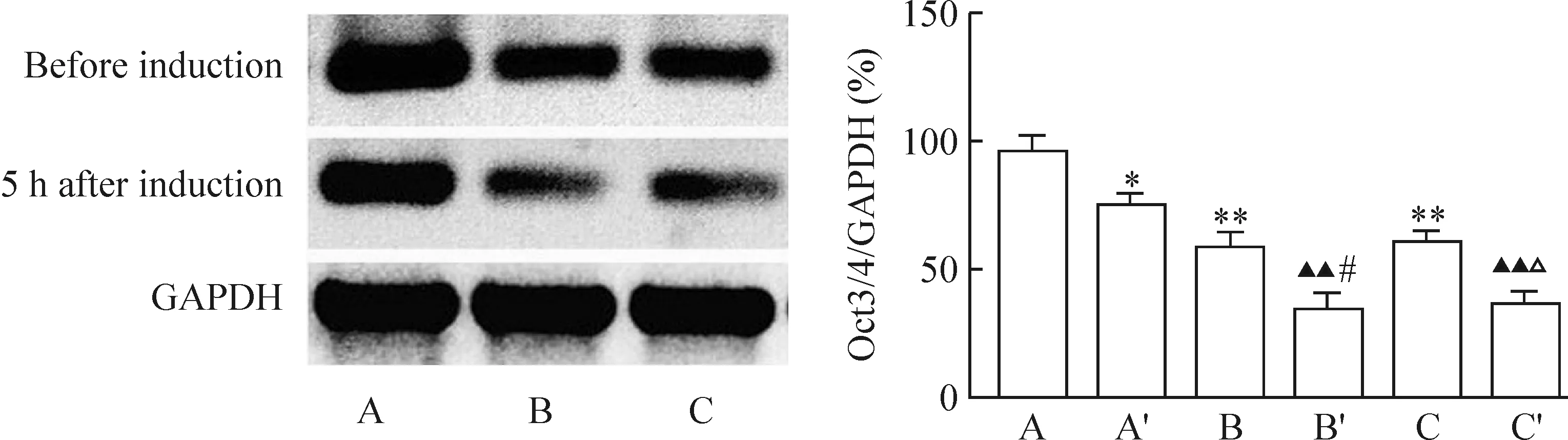
圖10Oct3/4Westernblotting結(jié)果
4.3RT-PCR結(jié)果 誘導前,各組均有Oct3/4 mRNA表達,其擴增產(chǎn)物為201 bp。其中,感染組Oct3/4 mRNA表達明顯高于其它各組,與其它各組相比有顯著差異(P<0.05),陰性對照組與未感染組類似,無顯著差異。誘導分化5 h后,各組Oct3/4 mRNA表達較誘導前均顯著減少(P<0.05),陰性對照組與未感染組無顯著差異,感染組Oct3/4 mRNA表達仍顯著高于其它2組(P<0.05),見圖11。
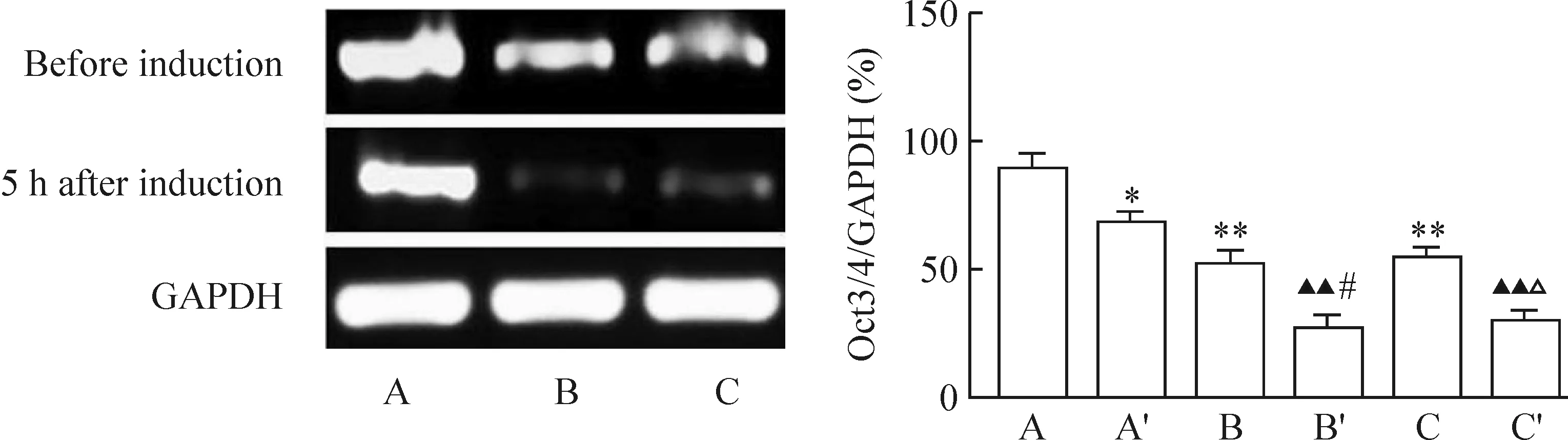
圖11Oct3/4RT-PCR結(jié)果
討 論
慢病毒載體是近年來廣泛應用于基因治療等領(lǐng)域的一種新的基因轉(zhuǎn)移技術(shù)[5-6],本研究成功構(gòu)建了含有Oct3/4基因的慢病毒載體,通過PCR篩選陽性克隆測序結(jié)果表明,為研究Oct3/4在MSCs誘導分化為神經(jīng)元中的作用提供了較理想的實驗工具。感染Oct3/4慢病毒載體的MSCs與其余各組相比在形態(tài)上發(fā)生了明顯變化,根據(jù)我們的研究結(jié)果推測,感染Oct3/4慢病毒載體可能在一定程度提高了部分細胞的全能性,這與Kim 等[7]研究結(jié)果相一致。
Oct3/4在維持胚胎干細胞全能性中起著重要作用,被認為是保持細胞全能性的至關(guān)重要的因子[1],但Oct3/4不僅存在于胚胎干細胞中,在胎兒及成人不同組織的干細胞和祖細胞中[8],甚至在分化程度較低的神經(jīng)干細胞中也均有表達[9]。Oct3/4不同的表達水平可以引起胚胎干細胞向不同胚層的分化,特別是在向神經(jīng)外胚層分化的過程中,Oct3/4的表達明顯減少[10]。
Rodda等[11]研究發(fā)現(xiàn)Oct3/4在胚胎干細胞中處于調(diào)節(jié)細胞全能性的頂層位置,Oct3/4與Sox2、Nanog通過參與LIF-STAT、BMP、Wnt等信號轉(zhuǎn)導通路[12-13],對胚胎干細胞中的管家基因進行調(diào)控,從而保持胚胎干細胞的全能性。其中以LIF-STAT信號通路最為重要。在此通路中,Oct3/4與Nanog通過對STAT3表達的調(diào)節(jié),進而調(diào)控JAK-STAT3信號轉(zhuǎn)導實現(xiàn)對細胞增殖分化的調(diào)節(jié)[14]。Hao等[15]研究發(fā)現(xiàn)在MSCs向神經(jīng)元定向分化的過程中,通過抑制JAK -STAT3信號通路,可以減少向星形膠質(zhì)細胞分化的比例,提高神經(jīng)元分化比例。此外,Oct3/4還與Zfp143、Zfp206、Zfp521等多種鋅指蛋白相互作用,在維持胚胎干細胞的多潛能性及向神經(jīng)元分化的過程中起到了重要的調(diào)節(jié)作用。其中Zfp521更是在腦神經(jīng)形成過程中發(fā)揮決定性作用[16],我們將另文報道Zfp521與Oct3/4在大鼠骨髓間充質(zhì)干細胞分化為神經(jīng)元中的作用。
本研究發(fā)現(xiàn),MSCs感染Oct3/4慢病毒后,Oct3/4表達量顯著增加,通過β-巰基乙醇誘導后,MSCs向神經(jīng)元分化效率顯著提高,神經(jīng)元早中期標志物NSE和成熟神經(jīng)元特異性標志物MAP-2表達均明顯增高,且未見GFAP表達;增加Oct3/4的表達,可以促進MSCs向神經(jīng)元分化。而且在誘導前后,通過免疫細胞化學法、Western blotting和RT-PCR法證明,Oct3/4隨著誘導分化的進行,表達量也隨之減少。這些結(jié)果提示Oct3/4可能在MSCs分化神經(jīng)元中起較重要的作用,但是具體機制尚不明確,可能與前述作用有關(guān)。
本研究MTT結(jié)果發(fā)現(xiàn)感染組細胞存活率顯著降低,這可能因為Oct3/4作為維持細胞全能性相關(guān)的重要轉(zhuǎn)錄因子和調(diào)控因子,其過表達影響了細胞的正常生長。
綜上所述,本研究發(fā)現(xiàn)Oct3/4在MSCs向神經(jīng)元誘導分化過程中,表達量隨著誘導分化的進行而減少;而且采用慢病毒載體建立Oct3/4過表達的MSCs神經(jīng)分化效率提高,提示Oct3/4在大鼠MSCs誘導分化為神經(jīng)元過程中可能起到了重要的調(diào)控作用。
[1] Morrison GM, Brickman JM. Conserved roles for Oct4 homologues in maintaining multipotency during early vertebrate[J]. Development, 2006, 133(10): 2011-2022.
[2] 王留東, 趙二義, 文全慶, 等. Caveolin-1在大鼠骨髓間質(zhì)干細胞分化為神經(jīng)元中的作用[J].中國病理生理雜志,2010,26(7): 1385-1389.
[3] Niwa H, Miyazaki J, Smith AG, et al.Quantitative expression of Oct-3 /4 defines differentiation, dedifferentiation or self-renewal of ES cells[J]. Nat Genet, 2000, 24(4): 372-376.
[4] 景黎君, 賈永林, 魯晶晶, 等. MicroRNA-9-1慢病毒載體的構(gòu)建及其對小鼠骨髓間質(zhì)干細胞誘導分化為神經(jīng)元的影響[J]. 中國病理生理雜志,2011,27(2): 326-331.
[5] Naldini L, Bl?mer U, Gallay P, et al.Invivogene delivery and stable transduction of nondividing cells by a lentiviral vector[J]. Science, 1996, 272(5259):263-267.
[6] Kafri T, Bl?mer U, Peterson DA, et al.Sustained expression of genes delivered directly into liver and muscle by lentiviral vectors[J]. Nat Genet, 1997, 17(3):314-317.
[7] Kim JB, Sebastiano V, Wu G, et al. Oct4-induced pluripotency in adult neural stem cells[J]. Cell, 2009, 136(3):411-419.
[8] Zhao M, Isom SC, Lin H, et al. Tracing the stemness of porcine skin-derived progenitors (pSKP) back to specific marker gene expression[J]. Cloning Stem Cells, 2009, 11(1): 111-122.
[9] Chin JH, Shiwaku H,Goda O, et al. Neural stem cells express Oct-3/4 [J]. Biochem Biophys Res Commun, 2009, 388 (2) :247-251.
[10]Thompson M, Liu SJ, Zou LN, et al. Pluripotency factors in embryonic stem cells regulate differentiation into germ layers[J].Cell, 2011,145(6), 875-889.
[11]Rodda DJ, Chew JL, Lim LH, et al. Transcriptional regulation ofNanogby Oct4 and Sox2[J]. J Biol Chem, 2005, 280(26):24731-24737.
[12]Haegele L, Ingold B, Naumann H, et al. Wnt signaling inhibits neural differentiation of embryonic stem cells by controlling bone morphogenetic protein expression[J]. Mol Cell Neurosci, 2003 , 24(3):696-708.
[13]Ying QL, Nichols J, Chambers I, et al. BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3[J]. Cell, 2003, 115 (3) :281-292.
[14]Niwa H, Burdon T, Chambers I, et al. Self-renewal of pluripotent embryonic stem cells is mediated via activation of STAT3[J]. Genes Dev, 1998, 12(13): 2048-2060.
[15]Hao H, Wang Y, Cheng F, et al. Role of JAK-STAT3 signaling pathway during neuronal differentiation of rat bone marrow mesenchymal stem cells[J]. Neural Regen Res, 2010, 5(5):337-341.
[16]Kamiya D, Banno S, Sasai N, et al. Intrinsic transition of embryonic stem-cell differentiation into neural progenitors[J]. Nature, 2011, 470(7335):503-509.
RoleofOct3/4indifferentiationofratbonemarrowmesenchymalstemcellsintoneurons
WANG Shu-yang, HAN Rui, ZHANG Guang-yu, WANG Cui-qin, PENG Yue, LU Jing-jing, PENG Tao, JIA Yan-jie
(DepartmentofNeurology,TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China.E-mail:jiayanjie1971@yahoo.com.cn)
AIM: To investigate the role of Oct3/4 in inducing differentiation of rat bone marrow mesenchymal stem cells (MSCs) into neuronsinvitro.METHODSLentivirus (LV) vector containingOct3/4 gene was constructed and transfected into rat bone marrow MSCs. The MSCs were divided into non-transfection group, transfection group (transfected withOct3/4-LV) and negative control group (transfected with FU-PCG-NC-LV). β-mercaptoethanol (β-ME) was used to induce differentiation of MSCs into neurons. Morphological changes and the fluorescence in transfected MSCs were observed under inverted fluorescence microscope. The expression of Oct3/4 and microtubulin-associated protein 2(MAP-2) at mRNA and protein levels was detected by RT-PCR and Western blotting. The expression of Oct3/4 and the neural cell specific markers neuron-specific enolase(NSE), MAP-2 and glial fibrillary acidic protein(GFAP) were determined by immunocytochemical method. The viability of the MSCs was analyzed by MTT assay.RESULTSThe results of PCR confirmed that theOct3/4-LV was successfully constructed and the virus titer was 2×1011TU/L. The best transfection efficiency and survival rate appeared when multiply of infection(MOI) was 10 and at 48 h, and the fluorescence of MSCs was mostly displayed. The efficiency of transfection was up to 83.4%±2.2%. The shape of the MSCs was changed in transfection group, and the survival rate of the MSCs in transfection group was significant lower than that in other groups (P<0.05). MSCs were induced by β-ME to differentiate into neurons and the best efficiency of induction was observed in transfection group. The typical neuronal morphology was observed in transfection group after induction and the expression levels of NSE and MAP-2 were higher than those in other groups (P<0.05). Compared with other groups, the expression of Oct3/4 in transfection group was significantly increased (P<0.01). Furthermore, the expression of Oct3/4 was time-dependently decreased and there was significant difference between before induction and 5 h after induction (P<0.05).CONCLUSIONOct3/4 may have an important role in regulating the differentiation of rat MSCs into neurons.
Oct3/4; Bone marrow mesenchymal stem cells; Neurons; Lentivirus
R329.21
A
10.3969/j.issn.1000-4718.2012.03.001

