雷奈酸鍶通過上調骨形態發生蛋白2的表達促進骨髓間充質干細胞分化為成骨細胞*
王 瑒, 李 正, 王小娜, 蘭愛平, 吳 文△
(1南方醫科大學,廣東 廣州 510515;2廣東省人民醫院東病區內分泌科,廣東 廣州 510080;3中山大學中山醫學院生理學教研室,廣東 廣州 510080)
1000-4718(2012)03-0404-05
2011-11-04
2011-12-08
十一五國家科技支撐項目(No. 2006BAI02B03);廣東省科技計劃(No. 2008B060600039;No. 2009B030801261)
△通訊作者 Tel:020-83827812-70912;E-mail:wuwen1964@163.com
雷奈酸鍶通過上調骨形態發生蛋白2的表達促進骨髓間充質干細胞分化為成骨細胞*
王 瑒1,2, 李 正1,2, 王小娜1,2, 蘭愛平3, 吳 文1,2△
(1南方醫科大學,廣東 廣州 510515;2廣東省人民醫院東病區內分泌科,廣東 廣州 510080;3中山大學中山醫學院生理學教研室,廣東 廣州 510080)
目的探討雷奈酸鍶(strontium ranelate,Sr)是否可以通過上調骨形態發生蛋白 2(bone morphogenetic protein 2,BMP-2)的表達而促進大鼠骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)分化為成骨細胞。方法對大鼠BMSCs進行分離、純化、培養及向成骨細胞的定向誘導分化,并在誘導培養時,根據實驗目的加入不同濃度Sr以及BMP-2的拮抗劑noggin。用酶標法檢測成骨細胞分化和功能成熟的早期標志物——堿性磷酸酶(alkaline phosphatase,ALP)活性的變化,用茜素紅染色檢測細胞鈣化水平,用Western blotting法檢測BMP-2蛋白的表達水平。結果應用0.1~7 mmol/L Sr處理細胞7 d均可使細胞ALP活性顯著增加,其中濃度為3 mmol/L時效果最顯著;應用3 mmol/L Sr處理細胞21 d可使細胞鈣化結節明顯增多;應用0.1~7 mmol/L Sr處理細胞7 d后細胞內BMP-2蛋白水平明顯增高;在Sr處理BMSCs前,應用BMP-2拮抗劑noggin預處理細胞2 h不僅抑制Sr對BMP-2表達的上調作用,還拮抗Sr對ALP活性及鈣化結節形成的促進作用。結論上調BMP-2的表達可能是Sr促進大鼠BMSCs分化為成骨細胞的作用機制之一。
雷奈酸鍶; 骨髓間充質干細胞; 骨形態發生蛋白 2; 成骨細胞
雷奈酸鍶(strontium ranelate,Sr)是由法國Servier公司研制開發的一類新型抗骨質疏松藥物,是第一種被稱為具有雙重治療作用——促進骨形成并抑制骨吸收的新藥,主要用于治療和預防絕經后婦女的骨質疏松癥以降低椎體和髖部骨折的危險性。骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)能夠保持其干細胞的表型而引起多向分化,定向誘導其向成骨分化可為研究骨組織工程、骨折修復和骨質疏松等難題提供理論基礎。有學者報道Sr可促進小鼠BMSCs和人BMSCs[1-2]向成骨細胞分化,能增加細胞堿性磷酸酶(alkaline phosphatase,ALP)的活性、I型膠原、骨鈣素等成骨細胞標志的表達,同時也能促進細胞的鈣化。Caverzasio等[3]對Sr促進成骨細胞系增殖的機制進行研究,發現Sr能夠通過兩種獨特的細胞學機制增加成骨細胞系的復制:(1)直接與鈣感應受體(calcium-sensing receptor,CaSR)相互作用,觸發絲裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)p38等信號活化;(2)通過釋放一種自分泌生長因子來促進成骨細胞的增殖,但其具體機制尚不明確。Choudhary等[1]發現Sr誘導小鼠的MSCs向成骨細胞分化與環氧化酶 2和前列腺素E2的介導有關;Fromigué等[4]認為激活活化T細胞核因子c1(nuclear factor of activated T cells c1,NFATc1)以及下游經典和非經典的Wnt信號通路(Wnt signaling pathways)對雷奈酸鍶誘導的成骨細胞復制和分化均有影響。
研究人員對于骨形態發生蛋白(bone morphogenetic proteins,BMPs)的興趣可以追溯到上世紀60年代,Marshall Urist將脫鈣骨基質移植到肌肉內后引起了異位成骨[5]。BMPs通過協調細胞分化、增殖、生長和凋亡,在各種組織器官如牙齒、腎臟、前列腺、乳腺、皮膚、毛發、肌肉、心臟和神經等的不同發育過程以及體內平衡中發揮了重要作用[6]。BMPs在調節成骨細胞分化以及其后的骨形成過程中也起了重要作用。在人類和動物的體外模型中,已經證實BMPs可以刺激干細胞分化為成骨細胞[7-8],其中BMP-2是現在被研究最多的一種。而在Sr促進BMSCs分化為成骨細胞的過程中,是否存在著BMP-2的作用還未見報道。為此,本實驗觀察在Sr刺激大鼠BMSCs分化為成骨細胞過程中對BMP-2表達的影響及其作用,為探討Sr可能的促成骨機制提供新穎的實驗資料。
材 料 和 方 法
1主要材料
4周齡雄性SD大鼠購自中山大學實驗動物中心;DMEM培養基和胎牛血清購自Gibco;青霉素、β-甘油磷酸鈉、地塞米松、抗壞血酸購自Sigma;雷奈酸鍶干混懸劑由法國Servier公司惠贈;堿性磷酸酶檢測試劑盒購自南京建成生物工程研究所;細胞茜素紅(alizarin red S)鈣染色試劑盒購自上海杰美基因醫藥科技有限公司;BMP-2抗體購自Bioworld;noggin購自R&D。
2主要方法
2.1大鼠BMSCs的獲取 取4周齡雄性SD大鼠1只,頸椎脫臼法處死后用75%乙醇浸泡5 min,在無菌條件下分離出兩側股骨及脛骨,剔除表面的肌肉、筋膜等組織,剪去股骨近端和脛骨遠端,暴露骨髓腔,用含10%胎牛血清、100 kU/L青霉素及100 mg/L鏈霉素的DMEM低糖完全培養基反復沖洗骨髓腔,收集細胞,1 000 r/min離心5 min,棄上清,加入2 mL上述DMEM培養液重懸細胞,種植于培養瓶中并吹打混勻,標記為原代P0,置于37 ℃、5% CO2、80%相對濕度的培養箱中培養。24 h后更換新鮮培養液以去除未貼壁細胞和各種雜質,加入5 mL新鮮培養液。此后每隔2~3 d換液1次,倒置相差顯微鏡下觀察細胞生長狀況,直至細胞接近80%~90%融合時進行傳代。此后每隔3~4 d傳代1次。
2.2BMSCs的成骨分化 選取第3~5代BMSCs為研究對象,根據不同實驗需要將細胞種植于培養皿或培養板中,加入成骨誘導液(含10%胎牛血清、100 kU/L青霉素及100 mg/L鏈霉素、10-8mol/L地塞米松、10 mmol/L β-甘油磷酸鈉、50 mg/L抗壞血酸的DMEM低糖培養基)培養。
2.3ALP活性檢測 選取第3代細胞,以約1×108/L的密度接種于24孔板,各實驗組給予不同處理因素后,于第7 d采用酶標法檢測ALP活性。檢測時將細胞收集后以0.2% Triton X-100裂解液及反復凍融法充分裂解,裂解后用PBS洗2遍,12 000 r/min離心10 min,取上清液按試劑盒說明書進行操作,于酶標儀520nm波長處測定結果。
2.4茜素紅鈣化結節染色 選取第3代細胞,接種于24 mm×24 mm蓋玻片上,蓋玻片預先置于6孔板中。各實驗組給予不同處理因素后,于第21 d按照細胞茜素紅鈣染色試劑盒說明書對樣本進行固定、染色及澄清處理,倒置顯微鏡下觀察鈣結節染色情況,每組取5個樣本,每樣本隨機取1個視野(×100),比較各組間的差異。
2.5Western blotting法檢測BMP-2蛋白表達水平 選取第3代細胞,接種于60 mm 培養皿中,各實驗組給予不同的處理因素后,用預冷的PBS洗2遍,加入細胞裂解液,4 ℃裂解30 min,12 000 r/min離心10 min,取上清液,用BCA蛋白質定量試劑盒進行蛋白定量。總蛋白經SDS-PAGE分離后,轉移到PVDF膜上。用5%脫脂奶粉封閉1.5 h,隨后加入BMP-2抗體(1∶1 000),4 ℃過夜,用TBST洗3次,每次10min,加入Ⅱ抗(1∶2 500)孵育1.5 h,再用TBST洗3次,每次10 min。將膜用發光試劑ECL顯色,暗室曝光,凝膠成像系統掃描并分析結果。
3統計學處理
結 果
1Sr增加BMSCs的ALP活性
0 mmol/L、0.1 mmol/L、1 mmol/L、3 mmol/L、5 mmol/L及7 mmol/L Sr處理細胞7 d,各實驗組與對照組相比,ALP活性均有所增加, 當Sr濃度為0.1 mmol/L時,與對照組相比,ALP活性即有顯著增加(P<0.05),當Sr濃度增加至3 mmol/L時,ALP活性增至最大,而5 mmol/L及7 mmol/L時,ALP活性增加幅度降低。可認為在0.1~7 mmol/L濃度范圍內,Sr對BMSCs向成骨分化的促進作用具有一定的劑量依賴性,見表1。
表1不同濃度Sr對ALP活性的影響

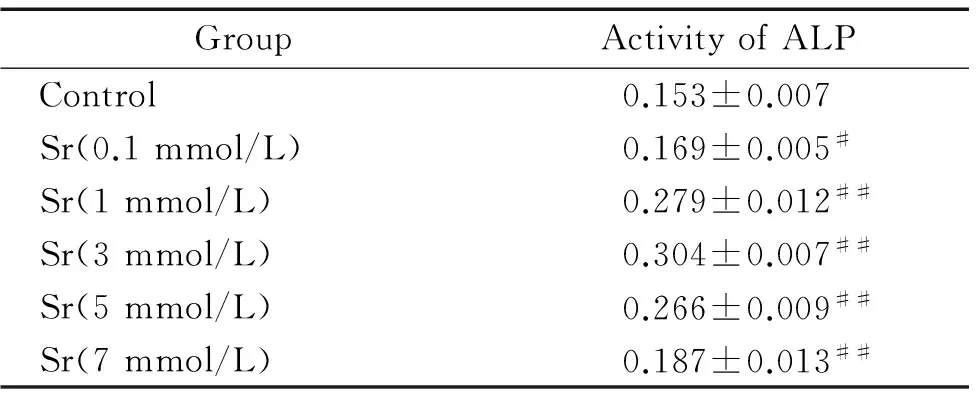
GroupActivityofALPControl0.153±0.007Sr(0.1mmol/L)0.169±0.005#Sr(1mmol/L)0.279±0.012##Sr(3mmol/L)0.304±0.007##Sr(5mmol/L)0.266±0.009##Sr(7mmol/L)0.187±0.013##
#P<0.05,##P<0.01vscontrol.
2Sr促進BMSCs的鈣結節生成
圖1顯示,3 mmol/L Sr處理BMSCs 21 d,與對照組相比細胞內鈣結節生成明顯增多,見圖1。
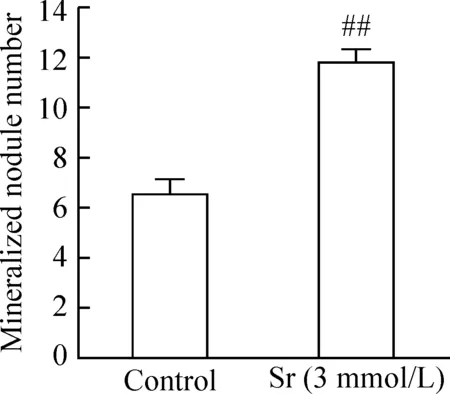
圖1Sr促進BMSCs鈣結節形成
3Sr上調BMSCs的BMP-2表達
圖2A顯示,0.1 mmol/L、1 mmol/L、3 mmol/L、5 mmol/L及7 mmol/L Sr處理BMSCs 7 d后,與對照組相比,細胞內BMP-2表達均明顯升高,Sr的濃度為1 mmol/L 時BMP-2表達水平達到最高值,Sr的濃度為7 mmol/L時,BMP-2表達的上升幅度明顯下降,但仍明顯高于對照組(P<0.05),呈現出一定的濃度依賴性;圖2B顯示,1 mmol/L Sr分別處理BMSCs 1 d、3 d、5 d、7 d及10 d后,與對照組相比,細胞內BMP-2表達均明顯升高,在1~7 d的時間范圍內,Sr呈時間依賴性地促進BMP-2表達,Sr處理BMSCs 7 d時,BMP-2表達水平達到高峰,處理10 d時,BMP-2表達水平顯著下降,但仍明顯高于對照組(P<0.05),見圖2。
4BMP-2拮抗劑noggin抑制Sr對BMP-2表達的上調作用
圖3顯示,1 mmol/L Sr處理BMSCs 7 d后,與對照組相比,細胞內BMP-2表達明顯增加(P<0.01),在Sr處理BMSCs前,給予100 μg/L noggin預處理2 h后,細胞內BMP-2表達明顯下降。100 μg/L noggin或PBS本身對BMP-2的基礎表達無明顯影響,見圖3。
5BMP-2拮抗劑noggin抑制Sr對ALP活性的促進作用
3 mmol/L Sr處理BMSCs 7 d后,與對照組相比,細胞內ALP活性顯著增加(P<0.05),在Sr處理細胞前,給予100 μg/L noggin預處理2 h后,細胞內ALP活性顯著降低(P<0.05)。Noggin(100 μg/L)或PBS本身對ALP活性無明顯影響,見圖4。
6BMP-2拮抗劑noggin抑制Sr對鈣結節生成的促進作用
圖5顯示,3 mmol/L Sr處理BMSCs 21 d后,與對照組相比,細胞內鈣結節數量明顯增加,在Sr處理細胞前,給予100 μg/L noggin預處理2 h后,細胞內鈣結節數量明顯減少。Noggin (100 μg/L)或PBS本身對鈣結節形成無明顯影響,見圖5。
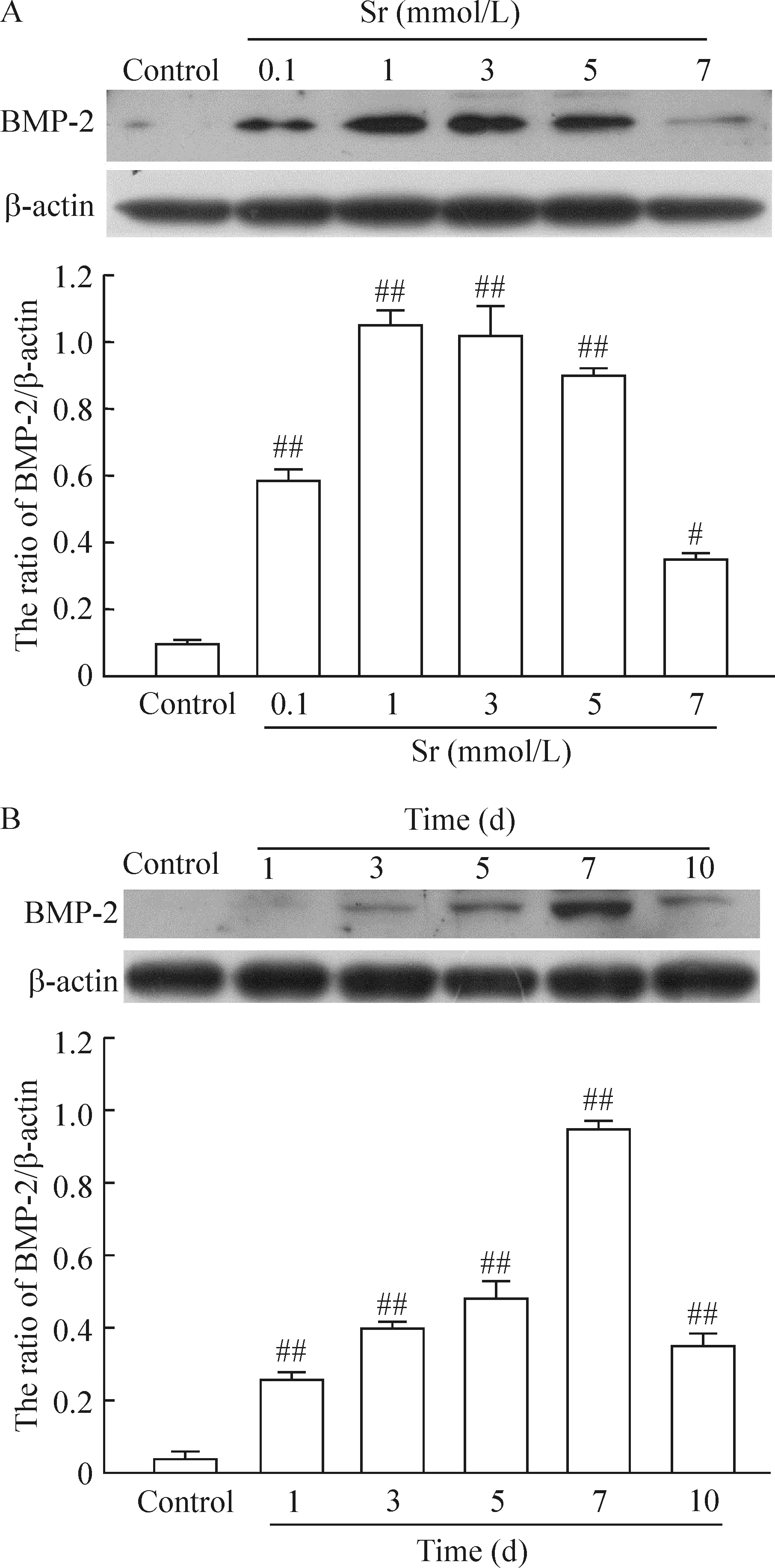
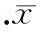
圖2Sr對BMSCsBMP-2表達的影響
討 論
Urist[5]于上世紀60年代最早利用脫鈣骨基質在肌肉內誘發異位成骨,這一實驗結果提示在骨基質中可能含有一種活性蛋白質, 這種活性蛋白質可以在骨骼和骨骼以外的部位誘生出骨和軟骨組織,它后來被命名為BMPs。BMPs是一組具有類似高度保守結構的的功能強大的糖蛋白,除BMP-1屬于金屬肽鏈內切酶家族(the astacin family of metallo-endopeptidases)外,其余均屬于轉化生長因子 β(transforming growth factor β,TGF-β)超家族。迄今為止,在人類胚胎發生、骨骼形成、造血生成及神經發育過程中,已經鑒定出骨形態發生蛋白家族超過20種具有各種不同作用的成員[9]。BMP-2已經成為BMPs家族里被研究最廣的成員,其功能主要是從骨折愈合、骨質缺損以及一些脊柱融合模型中分析得出[10]。已有臨床前研究和臨床研究表明,BMP-2可以在骨缺損、非連續骨折、脊柱融合、骨質疏松癥和根管手術中使用[11]。Govender等[12]報道一項包括450例受試者的前瞻性、隨機、對照、單盲研究結果,接受包含重組BMP-2治療的試驗組獲得了更快的骨折愈合(P<0.01)和更少的感染發生率(P<0.05)。重組人BMP-2是唯一在脛骨骨折和脊柱融合應用方面具有完整前瞻、隨機臨床試驗的BMP[13],并于2002年7月2日被美國FDA批準作為一種骨移植替代物用于脊柱融合[14]。此外,BMP-2在腫瘤學領域也發揮了它特有的作用[15]。
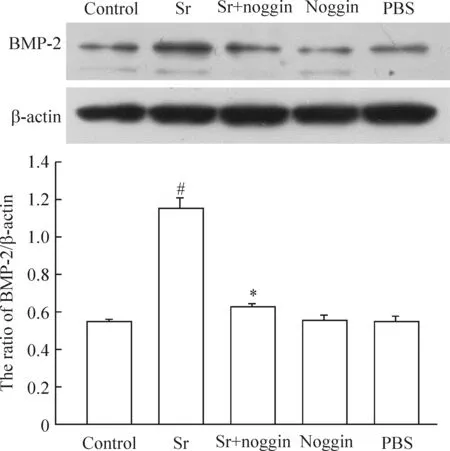
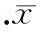
圖3BMP-2抑制劑noggin預處理拮抗Sr對BMP-2表達的促進作用
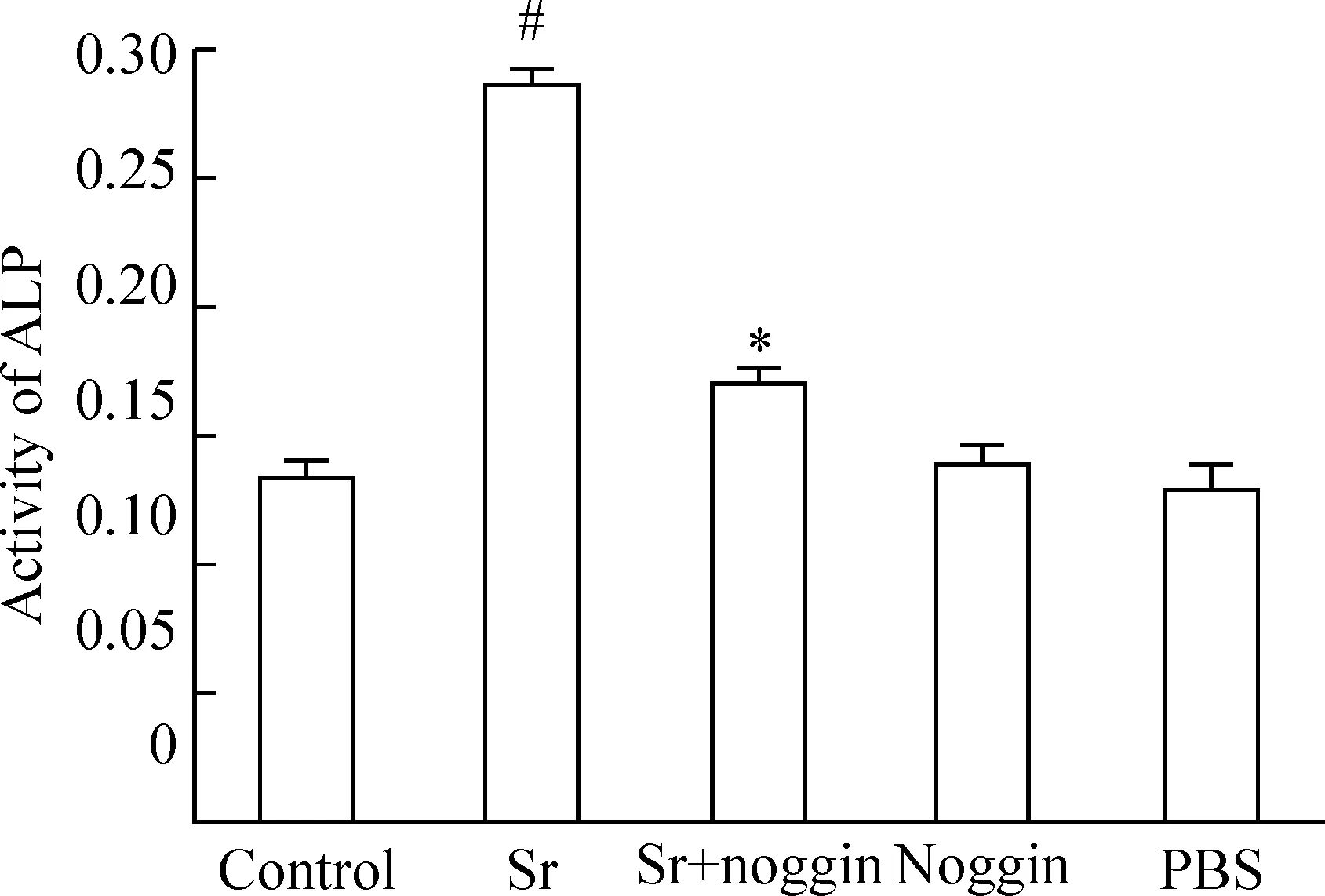
圖4BMP-2抑制劑noggin預處理阻斷Sr對ALP活性的促進作用

Figure 5. Preconditioning with BMP-2 inhibitor noggin inhibited Sr-induced mineralization in BMSCs(×100).A:control;B:Sr;C:Sr+noggin;D:noggin;E:PBS.
圖5BMP-2抑制劑noggin預處理阻斷Sr對鈣結節生成的促進作用
本研究證實了Sr可促進BMSCs分化為成骨細胞,這與國內外很多研究結論相一致[2-3]。重要的是本研究首次證實,在BMSCs分化為成骨細胞的過程中,Sr上調了BMP-2的表達,而且BMP-2的拮抗劑noggin不僅拮抗Sr對BMP-2表達的上調作用,還抑制Sr的促成骨作用,這提示上調的BMP-2介導了Sr對BMSCs分化為成骨細胞的促進作用,為深入闡明鍶鹽抗骨質疏松的機制提供了新的實驗依據,也為防治骨質疏松癥以及各種骨科疾病新藥的研發提供了新的作用靶點。
[1] Choudhary S, Halbout P, Alander C, et al. Strontium ranelate promotes osteoblastic differentiation and mineralization of murine bone marrow stromal cells: involvement of prostaglandins[J]. J Bone Miner Res,2007,22(7):1002-1010.
[2] Sila-Asna M, Bunyaratvej A, Maeda S, et al. Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell[J]. Kobe J Med Sci,2007,53(1-2):25-35.
[3] Caverzasio J. Strontium ranelate promotes osteoblastic cell replication through at least two different mechanisms[J]. Bone,2008,42(6):1131-1136.
[5] Urist MR.Bone: formation by autoinduction[J]. Science,1965,150(698):893-899.
[6] Ye L, Mason MD, Jiang WG.Bone morphogenetic protein and bone metastasis, implication and therapeutic potential[J].Front Biosci, 2011,1(16):865-897.
[7] Reddi AH.Bone morphogenetic proteins: from basic science to clinical applications[J].J Bone Joint Surg Am,2001,83-A Supp 1(Pt 1):S1-S6.
[8] Gautschi OP, Frey SP, Zellweger R.Bone morphogenetic proteins in clinical applications[J].ANZ J Surg,2007,77(8):626-631.
[9] Bragdon B, Moseychuk O, Saldanha S,et al. Bone morphogenetic proteins: a critical review[J]. Cell Signal,2011,23(4):609-620.
[10]Valdes MA, Thakur NA, Namdari S,et al. Recombinant bone morphogenic protein-2 in orthopaedic surgery: a review[J].Arch Orthop Trauma Surg,2009,129(12):1651-1657.
[11]Chen D, Zhao M, Mundy GR.Bone morphogenetic proteins[J].Growth Factors,2004,22(4):233-241.
[12]Govender S, Csimma C, Genant HK, et al. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients[J]. Bone Joint Surg Am,2002,84-A(12):2123-2134.
[13]Khan SN, Lane JM.The use of recombinant human bone morphogenetic protein-2 (rhBMP-2) in orthopaedic applications[J].Expert Opin Biol Ther,2004,4(5):741-748.
[14]McKay B.Local sustained delivery of recombinant human bone morphogenetic protein-2 (rhBMP-2)[J].Conf Proc IEEE Eng Med Biol Soc,2009,2009:236-237.
[15] 黃培德, 黃飛程, 陳 陽, 等. 重組人骨形成蛋白-2提高人乳腺癌細胞MCF-7的遷移性[J]. 中國病理生理雜志, 2010,26(5):931-936.
Strontiumranelatepromotesdifferentiationofbonemarrowmesenchymalstemcellstoosteoblastsbyincreasingexpressionofbonemorphogeneticprotein2
WANG Yang1, 2, LI Zheng1, 2, WANG Xiao-na1, 2, LAN Ai-ping3, WU Wen1,2
(1SouthernMedicalUniversity,Guangzhou510080,China;2DepartmentofEndocrinology,EastWardofGuangdongGeneralHospital,Guangzhou510080,China;3DepartmentofPhysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:wuwen1964@163.com)
AIM: To explore whether strontium ranelate (Sr) promotes differentiation of rat bone marrow mesenchymal stem cells (BMSCs) to osteoblasts by increasing the expression of bone morphogenetic protein 2 (BMP-2).METHODSRat BMSCs were isolated, purified and cultured, then were induced to differentiate into osteoblasts. The cells were treated with different concentrations of Sr or noggin (an inhibitor of BMP-2) according to the experimental purposes. The activity of alkaline phosphatase (ALP) was measured by colorimetry. Mineralized nodules were measured by alizarin red staining. The expression of BMP-2 was detected by Western blotting.RESULTSTreatment with Sr at concentrations of 0.1 mmol/L to 7 mmol/L for 7 d obviously increased the activity of ALP,and Sr at concentration of 3 mmol/L produced the maximum effect. Exposure of the cells to Sr at concentration of 3 mmol/L for 21 d significantly increased mineralized nodules. Exposure of the cells to Sr at concentrations of 0.1 mmol/L to 7 mmol/L for 7 d markedly increased the expression of BMP-2. Preconditioning with noggin at concentration of 100 μg/L for 2 h not only inhibited Sr-induced expression of BMP-2, but also antagonized the increase in the activity of ALP and mineralization induced by Sr in BMSCs.CONCLUSIONUp-regulation of the expression of BMP-2 may be one of the mechanisms by which Sr promotes differentiation of rat BMSCs to osteoblasts.
Strontium ranelate; Bone marrow mesenchymal stem cells; Bone morphogenetic protein 2; Osteoblasts
R589
A
10.3969/j.issn.1000-4718.2012.03.004

