肺癌干細胞中存在容積激活氯通道*
毛張凡, 徐小惠, 黃 杰, 耿 慶, 康敢軍
(1武漢大學人民醫院胸外科,湖北武漢430060;2華中科技大學同濟醫院藥劑科,湖北武漢430030)
肺癌是人類發病率和死亡率最高的惡性腫瘤。盡管肺癌的治療手段日新月異,但其5年生存率經多年研究仍無明顯改善。腫瘤干細胞(cancer stem cells,CSCs)學說的提出為癌癥治療帶來了新的曙光。有研究表明干細胞中存在多種離子通道電流,如大鼠骨髓間質干細胞、大鼠胚胎干細胞和小鼠心臟干細胞中均存在不同類型的離子通道電流[1-4]。研究顯示容積激活氯通道(volume-activated chloride channel,VACC)與腫瘤的發生發展關系密切。其參與腫瘤細胞增殖、遷移、凋亡并與腫瘤的多藥耐藥性密切相關[5-6]。但目前對VACC和腫瘤關系的研究均限于已分化腫瘤細胞。因此本實驗觀察CSCs中是否存在VACC,為進一步研究其在腫瘤發生發展中的作用奠定基礎。
材料和方法
1 細胞分選、培養及純度測定
肺癌細胞系A549(購自上海研吉生物科技有限公司)用含10%胎牛血清(Gibco)的RPMI-1640培養基(Gibco)培養,細胞傳代和收集均采用0.25%胰酶消化進行。采用免疫磁珠分選(magnetic cell separation,MACS)法分離肺癌細胞系A549中的CD133+和CD133-細胞,MACS體系為Miltenyi產品。取對數生長期的肺癌細胞系A549細胞108個,離心后重懸于400μL磁珠分選緩沖液中,加入100μL FcR封閉劑。制成單細胞懸液后與100μL CD133磁珠避光4℃孵育30 min。加入5 000 μL buffer,300×g離心10 min,洗滌細胞。用500μL MACS緩沖液重懸細胞。將磁分選MS柱放入磁分選器,加入500μL MACS緩沖液洗柱2次,加入細胞懸液,未與磁珠結合的CD133-細胞隨緩沖液流出。500μL MACS緩沖液沖洗吸附柱3次。將MS柱移出分離器,1 000μL磁珠分選緩沖液沖洗即獲得純化的CD133+細胞。為獲取更高純度,可將陽性分選產物加于另一新的分選柱,陰性細胞流出,500μL MACS緩沖液沖洗吸附柱3次,重復以上的陽性分選過程。為防止CD133+細胞分化,分選后所獲CD133+細胞用含20μg/L表皮生長因子(epidermal growth factor,EGF,Peprotech)和10μg/L堿性成纖維生長因子(basic fibroblast growth factor,bFGF,Peprotech)的無血清RPMI-1640培養基重懸,培養。
流式細胞儀(Becton Dickinson)測定分選的CD133+細胞磁珠分選純度。1×106個細胞重懸于500μL緩沖液中,加入5μL CD133/APC熒光標記的抗體(克隆TMP4,e-Bioscience),4℃孵育30 min后上機檢測。
2 膜片鉗記錄電流
采用全細胞膜片鉗記錄方法,應用膜片鉗放大器(HEKA,EPC-9,German)和 PULSE軟件(HEKA,Lambrecht,German)在電壓鉗制狀態下記錄CSCs上的容積激活氯電流。吸取細胞液少許,加入1 mL細胞池內,該細胞不易貼壁,故待細胞沉底行封接后,再以細胞外液灌流。玻璃電極(外徑1.2 mm)經微電極拉制儀分二步拉制而成,充灌電極內液進入細胞外液后阻抗為2.0~3.0 MΩ。電極接觸細胞前補償液接電位,輕施負壓進行封接,使封接電阻達GΩ以上。形成高阻封接后,繼續施加脈動負壓或給予短暫電脈沖擊穿膜片形成全細胞記錄模式。補償瞬時和緩慢電容電流,并根據需要補償串聯電阻,鉗位誤差控制在小于5 mV。通過膜片鉗放大器發放刺激沖動,激發的電流信號經AgCl-Ag電極引導、放大器放大,由A/D轉換器轉換為數字信號,存于硬盤中以備分析。電流信號經截止頻率2.9 kHz的四階貝塞爾低通濾波,采樣頻率5 kHz。實驗控制在室溫22~23℃。所有細胞電流記錄均是在分選后24 h內完成。
臺式液(mmol/L):136 NaCl,5.4 KCl,1.0 MgCl2,1.8 CaCl2,0.33 NaH2PO4,10 glucose,10 HEPES,用 NaOH 將 pH值調至7.3。低滲臺式液(0.6T,~180 mosmol/L)由臺式液中NaCl從140減至80 mmol/L制備。等滲臺式液(1T,~300 mosmol/L)由0.6T低滲臺式液中加入125 mmol/L甘露醇制備。電極內液 (mmol/L):20 KCl,110 K -aspartate,1.0 MgCl2,10 HEPES,5 EGTA,0.1 GTP,5.0 Na2- phosphocreatine和5.0 Mg2-ATP,用KOH 將 pH值調至7.2。氯通道阻滯劑5-nitro-2-(3-phenylpropylamino)benzoic acid(NPPB)購自Tocris(Bristol)。其余試劑均購自Sigma。
結 果
1 免疫磁珠法分選、純化肺CD133+CSCs
用免疫磁珠法從非小細胞肺癌細胞系A549中分離得到CD133+的CSCs,并用流式細胞儀檢測其純度約92%,見圖1A、B。
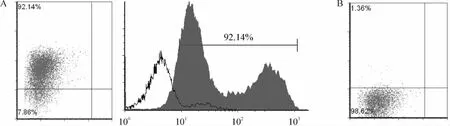
Figure 1.The purity of CD133+and CD133- cells.A:the purity of CD133+was 92.14%;B:the purity of CD133 - was 98.62%.圖1 CD133+和CD133-細胞純度
2 在CD133+的CSCs記錄到容積激活氯電流
膜片鉗鉗制電位-40 mV,施予-100~+70 mV、階躍10 mV、300 ms去極化脈沖。CD133+CSCs表現為小股內向電流和大股伴隨著外向整流的外向電流。對鉀通道阻滯劑[5 mmol/L 4 - AP,5 mmol/L tetraethylamminonium(TEA),0.5 mmol/L Ba2+]不敏感,說明該電流不是鉀電流;可被氯通道阻滯劑[100μmol/L 5-nitro-2-(3-phenylpropylamino)benzoic acid(NPPB)]阻斷,說明該電流為氯電流。為研究是否為容積激活性氯通道,將細胞外液由等滲(1T)換為低滲(0.6T)后,可觀察到細胞腫脹誘導產生的膜電流明顯增強,并可被NPPB阻斷(10 min)。NPPB被洗脫后,膜電流強度恢復(10 min)。
共用全細胞膜片鉗記錄40個CD133+CSCs,在其中22個細胞上記錄到容積激活氯電流,見圖2。
討 論
CSCs是腫瘤發生及復發的根源,故對CSCs的研究可能從根本上了解腫瘤,治療腫瘤。目前已從血液系統及乳腺、腦、前列腺、胰腺、黑色素瘤、大腸、肺的惡性腫瘤中分離得到CSCs。CD133常在各種腫瘤干細胞的研究中用于標記CSCs。Eramo等[7]及 Tirino等[8]以 CD133 為表面標志分離得到小細胞肺癌和非小細胞肺癌的CSCs。本實驗用免疫磁珠法從非小細胞肺癌細胞系A549中分離得到的CD133+CSCs,并用流式細胞儀檢測其純度約92%。
離子通道通常在興奮組織中存在并起非常重要的生理作用,如心血管系統。最近的研究表明離子通道與腫瘤亦關系密切。如離子通道在非興奮性組織起源的腫瘤中高表達,而在相同起源的正常組織中低表達或不表達;并且在腫瘤的發生發展過程中,離子通道表達類型和活性發生改變,并與腫瘤細胞的增殖和凋亡密切相關。隨著研究的深入,發現鉀、鈉、氯、鈣通道在腫瘤發生發展的不同階段均發揮重要作用,它們通過對膜電位、細胞周期、胞內第二信使(cAMP、cGMP、Ca2+等)濃度、胞質pH值及細胞體積等進行調節,影響腫瘤細胞增殖、分化和凋亡;而且參與腫瘤轉移及血管形成[9]。各類離子通道協同作用,與參與其中的信號途徑形成復雜而龐大的網絡,共同調控腫瘤的增殖、分化、轉移、凋亡等生物學特性[10]。
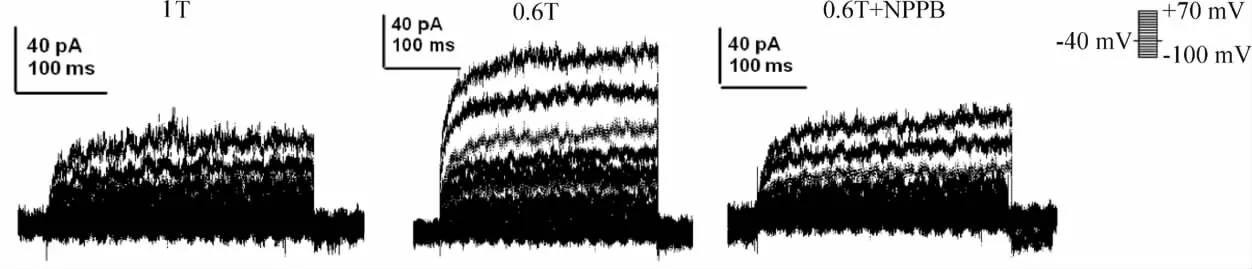
Figure 2.Voltage-dependent current was recorded in a representative cell with 300 ms voltage steps between -100 and+70 mV from a holding potential of-40 mV,then back to -40 mV as shown in the inset.Voltage-dependent current was recorded during 1T(isotonic solution),0.6T(hypotonic solution)plus100 μmol/L NPPB.The 0.6T -induced current was outwardly rectifying and significantly inhibited by NPPB at test potential.圖2 全細胞膜片鉗記錄的容積激活氯電流
目前尚無對CSCs的膜電流研究,本實驗旨在研究CSCs中的氯通道。在氯通道與腫瘤的關系中,對VACC研究較為深入,其參與腫瘤細胞增殖、遷移、凋亡并與腫瘤的多藥耐藥性密切相關,且以ClC-3較為重要[5]。VACC在多種腫瘤組織中高表達,其阻滯劑能顯著抑制腫瘤細胞的增殖。VACC還參與腫瘤細胞的遷移。腫瘤細胞在遷移過程中為了適應新的環境,往往要發生體積形態的變化,VACC即是在這個過程中起重要作用。凋亡性容積減小(apoptotic volume decrease,AVD)是細胞凋亡早期等張性體積皺縮現象,啟動細胞凋亡的發生。VACC是AVD中氯離子外流的重要途徑,與腫瘤細胞凋亡的啟動密切相關,發揮重要作用[11]。由于氯離子通道既受細胞信號轉導通路的調節,又是細胞內外大分子交換的通路,故已有研究證實氯通道與腫瘤多藥耐藥性的關系密切[12-13]。如P-糖蛋白(P -glycoprotein,P -gp)由多藥耐藥基因編碼,是細胞膜上一種能量依賴性藥物排出泵,具有容積激活氯通道功能,P-gp能將化療藥物泵出胞外,導致耐藥。氯通道阻滯劑可封閉P-gp,顯著抑制藥物外排,逆轉腫瘤的耐藥性[14]。CSCs對化療藥具有天然的耐受性,容積激活氯通道可能與之有關。
本實驗中通過全細胞膜片鉗在肺癌CD133+CSCs中記錄到容積激活氯電流。曾有學者在骨髓間充質干細胞及心臟干細胞中記錄到容積激活氯電流,并證明其通道蛋白類型為ClC-3[2,4],本實驗結果與其一致。目前以ClC-3為靶點的藥物已進入二期臨床試驗階段,故本實驗結果意義重大。本實驗是首次對腫瘤干細胞電生理的研究,將為后續研究奠定基礎。
[1] Bettiol E,Clement S,Krause KH,et al.Embryonic and adult stem cell-derived cardiomyocytes:lessons from in vitro models[J].Rev Physiol Biochem Pharmacol,2006,157:1-30.
[2] Tao R,Lau CP,Tse HF,et al.Functional ion channels in mouse bone marrow mesenchymal stem cells[J].Am J Physiol Cell Physiol,2007,293(5):C1561 - C1567.
[3] Wang K,Xue T,Tsang SY,et al.Electrophysiological properties of pluripotent human and mouse embryonic stem cells[J].Stem Cells,2005,23(10):1526 -1534.
[4] Han Y,Chen JD,Liu ZM,et al.Functional ion channels in mouse cardiac c - kit+cells[J].Am J Physiol Cell Physiol,2010,298(5):C1109 - C1117.
[5] Poulsen KA,Andersen EC,Hansen CF,et al.Deregulation of apoptotic volume decrease and ionic movements in multidrug-resistant tumor cells:role of chloride channels[J].Am J Physiol Cell Physiol,2010,298(1):C14 -C25.
[6] 陳麗新,王立偉,朱林燕,等.Cl-在鼻咽癌細胞調節性容積回縮中的作用[J].中國病理生理雜志,2002,18(5):490-493.
[7] Eramo A,Lotti F,Sette G.Identification and expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ,2008,15(3):504 -514.
[8] Tirino V,Camerlingo R,Franco R.The role of CD133 in the identification and characterisation of tumour-initiating cells in non- small- cell lung cancer[J].Eur J Cardiothorac Surg,2009,36(3):446-453.
[9] Kunzelmann K.Ion channels and cancer[J].J Membr Biol,2005,205(3):159 -173.
[10] Prevarskaya N,Skryma R,Shuba Y.Ion channels and the hallmarks of cancer[J].Trends Mol Med,2010,16(3):107-121.
[11] 柏志全,李春英,李 媛,等.氯通道在華蟾酥毒基誘導的鼻咽癌細胞凋亡中起重要作用[J].中國病理生理雜志,2011,27(5):833-837.
[12] Weylandt KH,Nebrig M,Jansen-Rosseck N,et al.ClC-3 expression enhances etoposide resistance by increasing acidification of the late endocytic compartment[J].Mol Cancer Ther,2007,6(3):979 -986.
[13] Ise T,Shimizu T,Lee EL,et al.Roles of volume-sensitive Cl-channel in cisplatin-induced apoptosis in human epidermoid cancer cells[J].J Membr Biol,2005,205(3):139-145.
[14] Vaalburg W,Hendrikse NH,Elsinga PH,et al.P-glycoprotein activity and biological response[J].Toxicol Appl Pharmacol,2005,207(2 Suppl):257 -260.

