燕麥發芽過程中淀粉及其相關酶活性的動態變化
徐建國 郝艷芳 閆華娟 田呈瑞 介琳霞
(山西師范大學食品科學與工程系1,臨汾 041004)
(陜西師范大學食品工程與營養科學學院2,西安 710062)
燕麥發芽過程中淀粉及其相關酶活性的動態變化
徐建國1郝艷芳1閆華娟1田呈瑞2介琳霞1
(山西師范大學食品科學與工程系1,臨汾 041004)
(陜西師范大學食品工程與營養科學學院2,西安 710062)
研究了裸燕麥發芽過程中淀粉及其相關酶活性的動態變化。結果表明,發芽過程中,燕麥還原糖和可溶性糖含量及α-淀粉酶、β-淀粉酶和總淀粉酶活力明顯地先增加后降低;直鏈淀粉、支鏈淀粉和總淀粉的含量均隨著發芽的進行呈下降趨勢,發芽72 h分別降低了25.86%、11.08%和17.31%。相關性分析表明,燕麥發芽期間還原糖、可溶性糖含量分別與α-淀粉酶、β-淀粉酶及總淀粉酶活力呈顯著正相關,而直鏈淀粉、支鏈淀粉及總淀粉含量均與淀粉酶活力呈顯著負相關。
燕麥 發芽 淀粉 淀粉酶
燕麥(Avena L.)作為一種人類和動物消費的谷物,營養豐富,且富含酚類物質、甾醇、植酸、維生素E等多種生物活性成分[1-2],具有抗氧化、降血壓、降血脂和降血糖等多種生理功能[2-5]。淀粉是燕麥的主要營養成分,其質量分數一般在43%~64%,其中直鏈淀粉質量分數約25.2%~29.4%。另外燕麥淀粉中含有1.0%~3.0%的脂質,燕麥淀粉與蛋白質、脂肪等物質連接緊密[6]。淀粉的組成及含量顯著地影響著淀粉在食品中的作用效果。研究表明,種子萌發利用外界條件激活內源酶,并在酶的作用下使其營養物質和植物化學成分發生一系列的生理生化變化,可以改善其營養品質和提高消化率[7-8]。淀粉在淀粉酶的作用下水解產生還原糖、低聚糖等,其含量、結構及加工性質也會隨之發生變化。但有關發芽燕麥食品的開發利用及燕麥發芽過程中淀粉及其相關物質的動態變化研究目前仍未有詳細報道。本文以山西產裸燕麥籽粒為材料,主要探討了發芽過程中燕麥淀粉的組成、含量及其相關酶活性的動態變化,以期為燕麥資源的進一步開發利用提供參考。
1 材料與方法
1.1 試驗材料及試劑
裸燕麥(Avena nuda L.):來自于山西呂梁地區,于2008年秋天收獲;葡萄糖、3,5-二硝基水楊酸、可溶性淀粉、麥芽糖等藥品或試劑均為國產。
1.2 主要儀器與設備
5840R冷凍離心機:Gene公司;TU-1900紫外分光光度計:北京普析通用有限公司;SC-5A超級恒溫槽:上海比朗儀器有限公司;F80型高速粉碎機:金壇市金城國勝實驗儀器廠。
1.3 試驗方法
1.3.1 燕麥的浸泡和發芽
干燥的燕麥籽粒挑選除雜后,用1%的次氯酸鈉溶液浸泡30 s消毒,用去離子水反復沖洗干凈,在25℃下用去離子水浸泡12 h,每4 h換水通氣1次。浸泡結束后取部分樣品記作S12,其余樣品瀝干水分后平鋪在濾紙上,置于25℃的培養箱中發芽72 h,發芽過程中保持相對濕度95%以上,每間隔12 h取樣,樣品分別記作 G12、G24、G36、G48、G60、G72。所有樣品取樣后立即冷凍干燥,-20℃保存直到樣品分析。
1.3.2 還原糖和可溶性糖的測定
還原糖和可溶性糖的含量采用3,5-二硝基水楊酸比色法測定[9]。以葡萄糖含量(mg/mL)為橫坐標,吸光度值為縱坐標,繪制標準曲線。得到回歸方程為:y=0.449 9x-0.001 8(R2=0.999 6)。
1.3.3 淀粉及組分含量的測定
燕麥中直鏈淀粉和支鏈淀粉含量的測定采用雙波長比色法[10],總淀粉含量為二者之和。
1.3.4 淀粉酶的提取及活性測定
燕麥淀粉酶的提取及其活性測定參照文獻[11]進行。酶活力單位定義:在上述反應條件下,每克燕麥每分鐘從1%的可溶性淀粉中釋放出1 μmol麥芽糖的酶量定義為1個酶活力單位(U)。
2 結果與分析
2.1 燕麥發芽過程中還原糖和可溶性糖含量的變化
燕麥發芽過程中還原糖和可溶性糖含量的變化結果見圖1。由圖1可以看出,燕麥在浸泡期間還原糖和可溶性糖含量稍有降低,這可能是因為浸泡使得燕麥種子外層的部分可溶性糖溶于水中而損失;在發芽過程中二者含量均先上升后下降。發芽24 h,還原糖和可溶性糖含量急劇增加,在發芽48 h時還原糖和可溶性糖含量最高,分別為5.25 mg/g和8.94 mg/g,再延長發芽時間,還原糖和可溶性糖含量明顯下降。還原糖和可溶性糖含量的增加可能與淀粉酶的活化和合成增加有關;發芽后期二者含量的迅速降低與種子萌發過程中,呼吸作用增強為種子萌發合成新物質及提供能量有關。
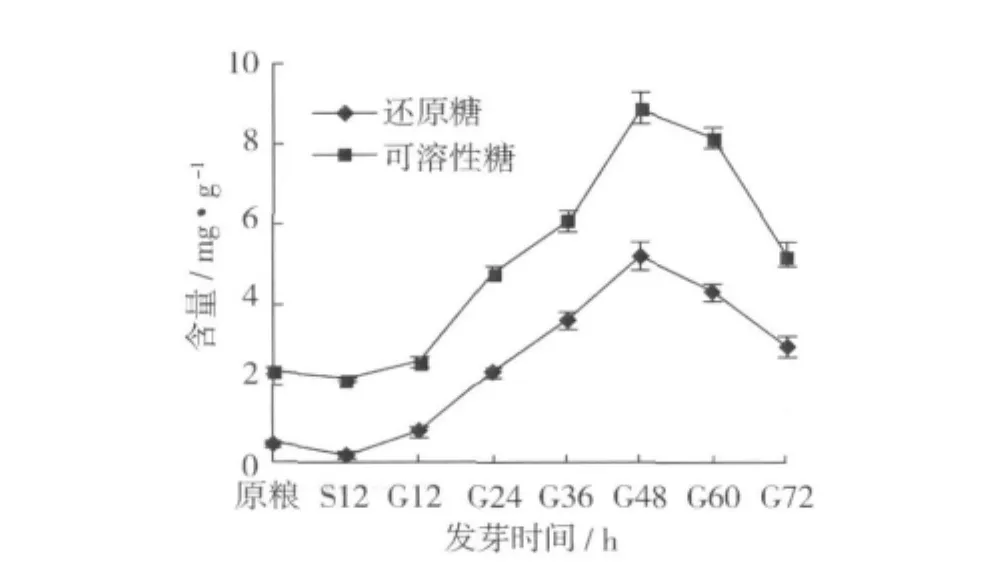
圖1 燕麥發芽過程中還原糖和可溶性糖含量的變化
2.2 燕麥發芽過程中淀粉含量的變化
燕麥發芽過程中淀粉含量的變化結果見圖2。由圖2可以看出,與原糧相比,燕麥在發芽過程中淀粉含量逐漸降低,發芽72 h淀粉含量降低17.31%。燕麥中直鏈淀粉和支鏈淀粉的質量分數分別是26.3%和36.1%,發芽過程中直鏈淀粉和支鏈淀粉的變化趨勢與淀粉含量變化一致,均隨著發芽的進行而下降,發芽72 h二者質量分數分別降低了25.86%和11.08%。直鏈淀粉和支鏈淀粉含量及比例對淀粉的糊化、老化等理化特性有很大的影響,不但直接影響食品的質地和色澤,而且影響食品的加工。淀粉是燕麥的主要成分,發芽后,燕麥中淀粉、直鏈淀粉和支鏈淀粉含量均發生一定程度的變化。因此,可以通過適當的發芽改變燕麥中直鏈和支鏈淀粉的含量及比例,從而改善其加工適性及食品品質。
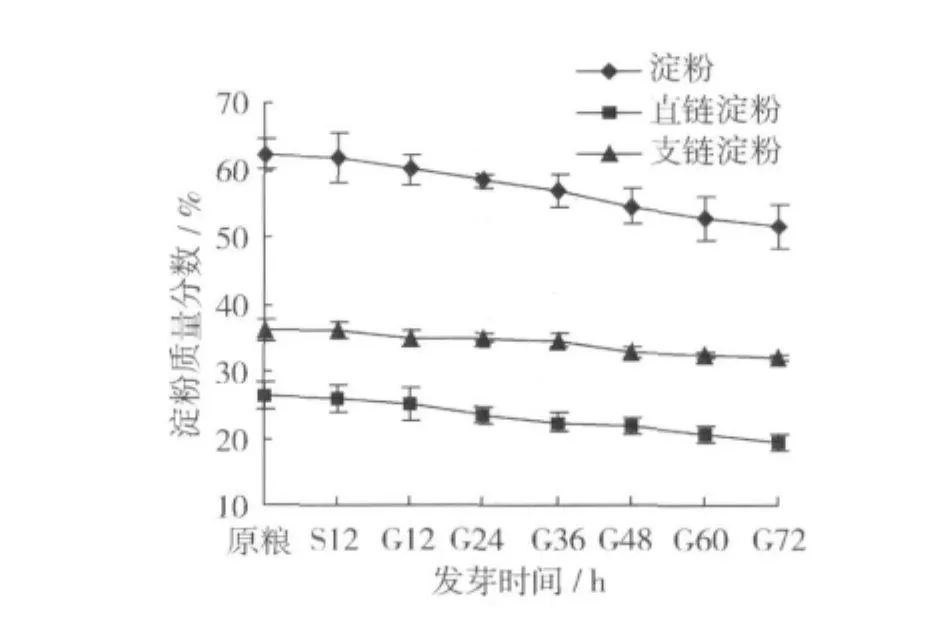
圖2 燕麥發芽過程中淀粉含量的變化
2.3 燕麥發芽過程中淀粉酶活性的變化
燕麥發芽過程中淀粉酶活性的變化結果見圖3。由圖3可以看出,燕麥中的α-淀粉酶、β-淀粉酶和總淀粉酶活力在浸泡階段沒有明顯的變化。當種子完全吸水膨脹后,萌發開始,淀粉酶活力隨著萌發時間的延長而快速增加,α-淀粉酶活力在48 h時達到最大值,為8.4 U,之后活力下降;β-淀粉酶和總淀粉酶活力均在60 h時達到最大值,分別28.7和22.4 U,之后迅速下降。α-淀粉酶的活力與β-淀粉酶的活力有明顯的差別,尤其在干種子和浸泡階段,α-淀粉酶的活力很低甚至沒有,這是因為α-淀粉酶是在種子萌發過程中誘導產生的,而β-淀粉酶是在種子發育過程中合成的,以儲存蛋白的形式存在于成熟種子中,因此即使在干種子內β-淀粉酶也存在一定的活力[12]。
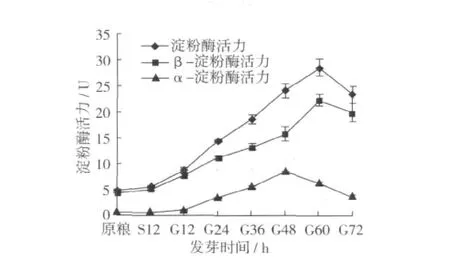
圖3 燕麥發芽過程中淀粉酶活力的變化
2.4 燕麥發芽過程中糖、淀粉含量與淀粉酶活性變化的相關性分析
在整個發芽過程中,燕麥的淀粉酶活性與還原糖含量、可溶性糖含量的變化趨勢一致,與淀粉含量的變化總趨勢上相反。相關性分析結果表明(表1),燕麥發芽期間還原糖和可溶性糖含量分別與α-淀粉酶、β-淀粉酶及總淀粉酶活力呈顯著正相關,而直鏈淀粉、支鏈淀粉及總淀粉含量均與淀粉酶活力呈顯著負相關。燕麥發芽時,內源淀粉酶被活化或合成,促使淀粉分解,使得與呼吸有關的可溶性糖和還原糖等含量增加[13-14]。因此,發芽過程中燕麥淀粉、直鏈淀粉和支鏈淀粉含量下降,還原糖和可溶性糖含量增加,但發芽后期還原糖和可溶性糖含量的下降可能是因為旺盛的呼吸作用使還原糖消耗較多。
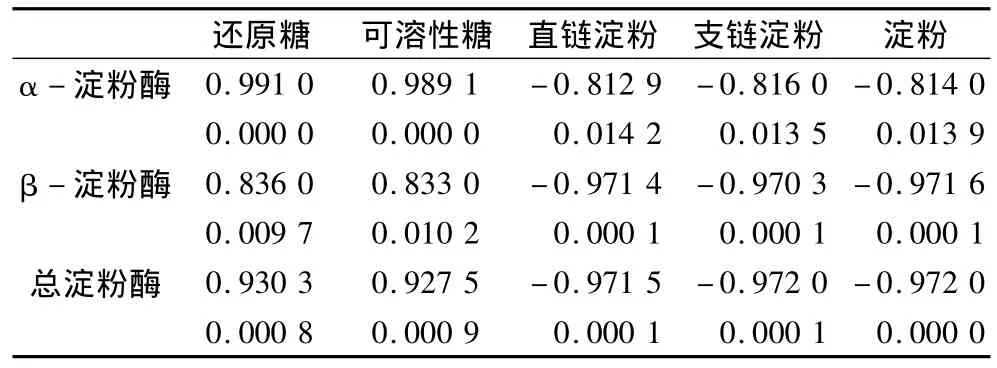
表1 燕麥發芽過程中淀粉和糖含量與淀粉酶活性的相關性分析
3 結論
燕麥發芽過程中淀粉、直鏈淀粉及支鏈淀粉含量逐漸降低,還原糖和可溶性糖含量先增加后降低,發芽48 h含量達到最大值;淀粉酶活力隨著萌發時間的延長而快速增加,達到最大值后迅速下降。其中α-淀粉酶活力在發芽48 h時達到最大值,β-淀粉酶和總淀粉酶活力均在發芽60 h時達到最大值。另外,發芽過程中燕麥直鏈淀粉和支鏈淀粉的比例發生了一定程度的變化。
[1]Peterson D M.Oat antioxidants[J].J Cereal Sci,2001,33:115-129
[2]Chen C Y,Milbury P E,Kwak H K,et al.Avenanthramides and phenolic acids from oats are bioavailable and act synergistically with vitamin C to enhance hamster and human LDL resistance to oxidation[J].J Nutr,2004,134:1459 -1466
[3]Xu J G,Tian C R,Hu Q P,et al.Dynamic changes in phenolic compounds and antioxidant activity in oats(Avena nuda L.)during steeping and germination[J].J Agric Food Chem,2009,57:10392 -10398
[4]Tapola N,Karvonen H,Niskanen L,et al.Glycemic responses of oat bran products in type 2 diabetic patients[J].Nutr Metabol Cardiovasc Dis,2005,15:255 -261
[5]Nie L,Wise M,Peterson D,et al.Mechanism by which avenanthramide- c,a polyphenol of oats,blocks cell cycle progression in vascular smooth muscle cells[J].Free Radical Bio Med,2006,41:702 -708
[6]Hoover R,Smith C,Zhou Y,et al.Physicochemical properties of Canadian oat starches[J].Carbohyd Polym,2003,52:253-261
[7]鄭藝梅.發芽糙米營養特性、γ-氨基丁酸富集及生理功效的研究[D].武漢:華中農業大學,2006
[8]張美莉.萌發蕎麥種子內黃酮與蛋白質的動態變化及抗氧化研究[D].北京:中國農業大學,2004
[9]朱海霞,石瑛,張慶娜,等.3,5-二硝基水楊酸(DNS)比色測定馬鈴薯還原糖含量的研究[J].中國馬鈴薯,2005,19(5):267-269
[10]何照范.糧油籽粒品質及其分析技術[M].北京:中國農業出版社,1985:144-150,290-294
[11]王憲澤.生物化學試驗技術原理和方法[M].北京:中國農業出版社出版,2002:77-79
[12]鄒琦.植物生理學實驗指導[M].北京:中國農業出版社,2000:151-153
[13]曹雅君,江玲,羅林廣,等.水稻品種休眠特性的研究[J].南京農業大學學報,2001,24(2):1 -5
[14]鄭藝梅,何瑞國,黃霞等.發芽對不同品種糙米碳水化合物組成及其相關酶活性的影響[J].糧食與飲料工業,2006(5):1-3.
Dynamic Changes in Starch and Relevant Enzyme Activity in Oat Groats during Germination
Xu Jianguo1Hao Yanfang1Yan Huajuan1Tian Chengrui2Jie Linxia1
(Departerment of Food Science and Engineering,Shanxi Normal University1,Linfen 041004)(College of Food Engineering and Nutritional Science,Shanxi Normal University2,Xi'an 710062)
In this paper,the changes of the content of starch and relevant enzyme activity in oat groats were in-vestigated during germination.Results revealed that the content of reduced,soluble sugar and the activity of α - amylase,β -amylase and total amylase from oat groats increased at first and then decreased rapidly during germination.The content of amylose,amylopectin,total starch from oat groats decreased with the processing of the germination and decreased by 25.86%,11.08%and 17.31%after germinated for 72 hours respectively.During germination,the content of reduced and soluble sugar were highly correlated to the activity of α -amylase,β -amylase and total amylase,however,the content of amylose,amylopectin and total starch were negatively correlated to the activity of amylase.
oat,germination,starch,amylase
Q946
A
1003-0174(2012)04-0025-04
時間:2012-03-22 13:49
網絡出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20120322.1349.002.html
山西省高校科技開發項目(2010112)
2011-07-06
徐建國,男,1971年出生,副教授,食品科學

