囊性肝包蟲囊腫周圍肝內管道的病理解剖學觀察*
楊宏強,王 菊,李 江,馬少波,卞志遠,趙 瑾,張示杰,陳孝平
2.石河子大學醫(yī)學院第一附屬醫(yī)院肝膽外科;
3.石河子大學醫(yī)學院
囊型肝包蟲病是世界畜牧地區(qū)常見的人獸共患疾病。包蟲生長發(fā)育過程即是包蟲與宿主相互作用、相互影響的過程。大量的研究表明宿主對包蟲的抑制主要與宿主的免疫反應有關[1-2],而包蟲對宿主的影響主要表現(xiàn)在對寄生的組織器官結構和功能的損傷。在囊型肝包蟲的生長發(fā)育過程中,隨著包蟲囊的不斷增大,導致肝臟組織發(fā)生了嚴重的病理解剖學改變。由于不易獲得病理組織標本,對人肝包蟲病患者的肝內組織結構尤其是肝內管道的病理學研究受到限制,相關報道較少見,本研究通過對近年來收集的手術切除的人囊型肝包蟲及其周圍的肝內血管及膽管標本,進行病理組織學研究,描述囊性肝包蟲外囊及周圍肝內血管、膽管的病理解剖學改變,探討其對肝臟產生的影響。
1 材料及方法
1.1 標本來源 選取我院2009年6月至2010年6月囊性肝包蟲患者的新鮮手術標本42例,其中肝右葉包蟲39例,肝左葉包蟲3例,所有標本均包括肝包蟲外囊及其外面附著的四級及四級以上肝內管道(實驗組)。病理教研室提供無肝病尸檢者肝組織5例(四級Glisson系統(tǒng)內管道及周圍肝組織)做正常對照(對照組),其中肝右葉組織4例,肝左葉組織1例。
1.2 主要試劑和儀器 Masson三色試劑盒、ACTIN、VEGF單克隆抗體均購于DAKO公司,通用型二抗及DAB顯色試劑盒購自于北京中杉金橋生物技術公司。
1.3 大體標本觀察 大體標本觀察肝包蟲周圍血管、膽管(Glisson系統(tǒng)為主)及周圍組織的病理解剖學改變。
1.4 制片 實驗組取包蟲外囊及其表面附著的Glisson鞘內四級管道,對照組取肝臟對應級別的Glisson系統(tǒng)組織標本經10%的中性甲醛溶液固定,石蠟包埋;制備4μm厚的組織切片備用。
1.5 標本組織HE染色 組織切片用60。C烘烤30min后進行常規(guī)HE染色,顯微鏡下觀察。
1.6 Masson染色 切片脫蠟至水,按Masson三色試劑盒說明書:加A1、A2液1∶1混和液,染色15min;流水稍洗,酸酒精分化,流水沖洗10min;加B液5min;蒸餾水洗去B液2min;加C液5min,倒去C液,加D液染25min;1%冰醋酸洗去D液約1 min;95%酒精洗3次,每次1min;無水乙醇脫水5 min,二甲苯透明,中性樹膠封固,顯微鏡觀察。
1.7 免疫組織化學染色(SP法) 組織均經常規(guī)固定,脫水石蠟包埋,每例連續(xù)切片10張,切片厚度5 μm,37。C烘箱過夜備用。每例均與HE染色對照。石蠟切片經常規(guī)脫蠟至水,將切片浸入0.1mol/L枸櫞酸鹽緩沖液(pH 6.0)中,微波修復10min(高火,750W),自然冷卻至室溫,PBS緩沖液5min×3次,10%山羊血清封閉,37。C孵育10min,滴加一抗(ACTIN、VEGF抗體,工作濃度均為1∶100)。4。C孵育過夜;PBS浸洗玻片3次(每次5min),37。C復溫1h;加通用型二抗,37。C孵育30min,DAB顯色,蘇木素復染10min,l%鹽酸乙醇分化,梯度乙醇脫水,二甲苯透明,中性樹膠封片,光學顯微鏡下觀察。
2 結 果
2.1 大體病理標本觀察結果 肝包蟲外囊組織質韌,自肝剝離面呈黃白色,表面較光滑。可見樹枝狀的Glisson系統(tǒng)內血管及膽管失去原有的解剖位置,包繞、附著于外囊表面,管道與外囊粘連緊密,不能分離,其所屬肝組織消失。外囊及附著的肝內管道的切面可以觀察到,粘附于外囊的管道略隆起,近肝門段管道管腔殘存而至遠端漸閉鎖(圖1)。
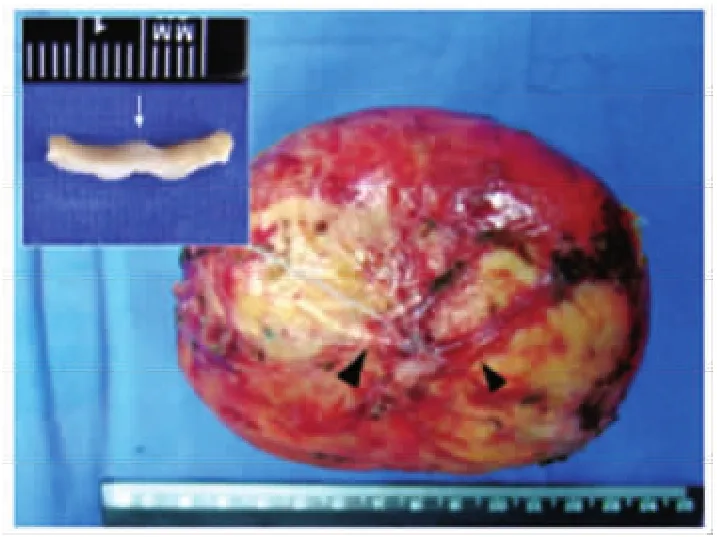
圖1 完整的肝包蟲外囊及其表面附著的樹枝狀的Glisson系統(tǒng)(▲所示)左上角圖顯示外囊及其表面附著的肝內管道橫剖面Fig.1 Unbroken ectocyst of hepatic hydatid cyst and blood vessels and bile ducts in the Glisson's system(▲)attached on the surface of ectocyst,transverse plane of the Glisson's system attached on the surface of ectocyst is showed in left-upper figure
2.2 蘇木素-伊紅染色鏡下觀察結果 對照組5例均見正常肝內Glisson鞘內結構完整,各種管道排列整齊,管腔飽滿,周圍可見疏松結締組織包繞。肝動脈管腔規(guī)則,管徑較小,管壁厚,而且內膜、中膜、外膜分界清晰。門靜脈管徑明顯較肝動脈及膽管大,管壁薄。膽管管腔規(guī)則,粘膜、肌層結構完整(圖2-Ⅰ)。高倍鏡下觀察匯管區(qū)結構清晰,肝細胞圍繞匯管區(qū)排列整齊,大小正常,細胞內結構清晰,未見明顯變性、壞死。(圖3-Ⅰ)。
實驗組42例囊性肝包蟲周圍外膜內Glisson鞘內結構紊亂,各種管道排列雜亂,管道周圍纖維組織明顯增生,管道與周圍組織分界不清。肝動脈管徑減小,動脈壁厚薄不一,而且內膜、中膜、外膜分界不及對照組清晰。門靜脈管徑明顯減小,管腔變得扁平,管壁變薄。膽管管腔不規(guī)則,管徑減小,而膽管壁變厚(圖2-Ⅱ)。肝包蟲囊腫周圍的肝組織結構形態(tài)異常、萎縮,匯管區(qū)結構不清,可見肝細胞大小不均、變性、壞死(圖3-Ⅱ)。
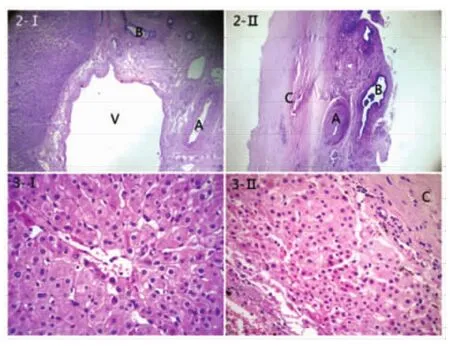
圖2 -Ⅰ 正常肝臟肝組織及肝內Glisson系統(tǒng)管道(右肝,四級)(HE×40);圖2-Ⅱ 囊型肝包蟲外囊壁及其表面附著的肝內Glisson系統(tǒng)管道(右肝,四級)及周圍肝組織(HE×40)。圖3-Ⅰ 正常肝組織(HE×400);圖3-Ⅱ 肝包蟲外囊周圍的肝組織(HE×400)。(A-肝內動脈,B-肝內膽管,C-肝包蟲外囊,V-門靜脈)Fig.2-Ⅰ Hepatic blood vessels and bile ducts in the Glisson's system (right lobe of liver,4th stage)of normal hepatic tissue of human(HE,×40)Fig.2-Ⅱ Blood vessels and bile ducts in the Glisson's system(right lobe of liver,4th stage)hepatic tissue attached on the surface of ectocyst hepatic hydatid cyst of human(HE,×40).Fig.3-Ⅰ Normal hepatic tissue(HE,×400).Fig.3-Ⅱ Hepatic tissue attached on the surface of ectocyst(HE,×400).(A-Intrahepatic Artery,B-Intrahepatic bile ducts,C-Ectocyst of hepatic hydatid cyst,V-Portal Vein)
2.3 Masson染色結果 Masson染色顯示:肌細胞呈紅色,膠原纖維呈藍色,細胞核呈藍黑色。鏡下觀察,對照組5例正常肝內Glisson鞘內以藍色為主,組織疏松,膠原纖維少,各種管道結構層次清楚。動脈管壁厚,其中膜可見大量紅染的平滑肌組織和少量藍染的膠原纖維。門靜脈壁藍染,可見少量紅染組織,即有大量的膠原纖維和少量的平滑肌組織。膽管壁以藍染為主,偶見紅染組織(圖4-Ⅰ)。實驗組42例均可見肝包蟲外囊表面附著的Glisson鞘內呈藍染纖維組織較對照組明顯增多。動脈管壁結構層次不清,中膜藍染組織明顯增多,即平滑肌減少而膠原纖維明顯增多。門靜脈壁藍染,即含有大量的膠原纖維。膽管壁藍染,管壁變薄,未見紅染組織(圖4-Ⅱ)。
2.4 Actin免疫組化結果Actin在管道內平滑肌組織呈陽性表達。顯微鏡下觀察,對照組可見Glisson鞘內肝動脈、門靜脈、膽管壁內Actin均有著色,呈陽性表達(圖5-Ⅰ)。實驗組可見肝包蟲外囊表面附著的的Glisson鞘內動脈管壁著色明顯變淡;門靜脈壁著色變淡,呈弱陽性表達;膽管壁著色亦明顯減少,呈弱陽性或陰性表達(圖5-Ⅱ),Actin染色結果說明實驗組中各管道的平滑肌成分較對照組明顯減少。
2.5 VEGF免疫組化結果 血管內皮生長因子(VEGF)主要在新生的小血管及小膽管上皮細胞內呈陽性表達。對照組:5例正常肝內Glisson鞘內偶有VEGF陽性表達(圖6-Ⅰ),未見新生的小血管及小膽管。實驗組:42例肝包蟲外囊與肝組織間均可見大量新生之小血管及小膽管增生,其上皮細胞內VEGF呈陽性表達(圖6-Ⅱ)。
3 討 論
以往的包蟲病引起肝內管道病變的研究多局限于影像學范疇[3-5],主要的原因是囊型肝包蟲病傳統(tǒng)的手術方式是內囊摘除術,這種術式很難獲得肝包蟲周圍肝內管道的臨床病理標本,而無法對其進行組織病理學觀察。新的根治性手術——外膜內外囊完整切除術的應用,不但明顯提高了手術療效[6-7],同時可以獲得包蟲囊腫周圍病變的肝內管道標本,對其進行病理學研究。
本課題組在肝包蟲外膜內外囊切除術中發(fā)現(xiàn),肝包蟲囊腫周圍Glisson系統(tǒng)內的血管和膽管變形、移位,失去原有的解剖位置,和術前的影像學結果相符[4]。本研究進一步觀察了囊腫周圍病變的肝內管道的病理變化,發(fā)現(xiàn)肝包蟲周圍肝內管道失去原有的解剖位置,包繞貼敷于外囊。HE鏡下觀察見Glisson鞘變形,其內肝動脈、門靜脈及膽管關系紊亂,管腔變窄、變形。這些改變均提示:囊性肝包蟲在膨脹性生長過程中,長期擠壓周圍肝內管道,造成肝內管道解剖位置、結構發(fā)生改變。
本課題組前期研究中提出:肝包蟲外囊與肝實質間還存在著一層新的膜樣纖維結構—“外膜”,本研究進一步證實了肝包蟲外囊周圍病變的Glisson鞘及其內的肝動脈、門靜脈及膽管是“外膜”的重要組成部分。本實驗Masson及Actin染色鏡下觀察結果顯示:肝包蟲外膜內Glisson鞘內的纖維組織明顯增多;肝動脈、門靜脈及膽管壁內平滑肌成份明顯減少而膠原纖維成份明顯增多,管壁分層結構基本消失,與周圍纖維結構分界不清,提示Glisson鞘及其內管道結構發(fā)生了纖維化。本課題組先前的研究結果表明TGF-β1和CTGF在肝包蟲外囊與肝組織間的外膜層內有高表達[8],這些與纖維化密切相關的基因可能參與了Glisson鞘及其內管道結構的纖維化的過程。
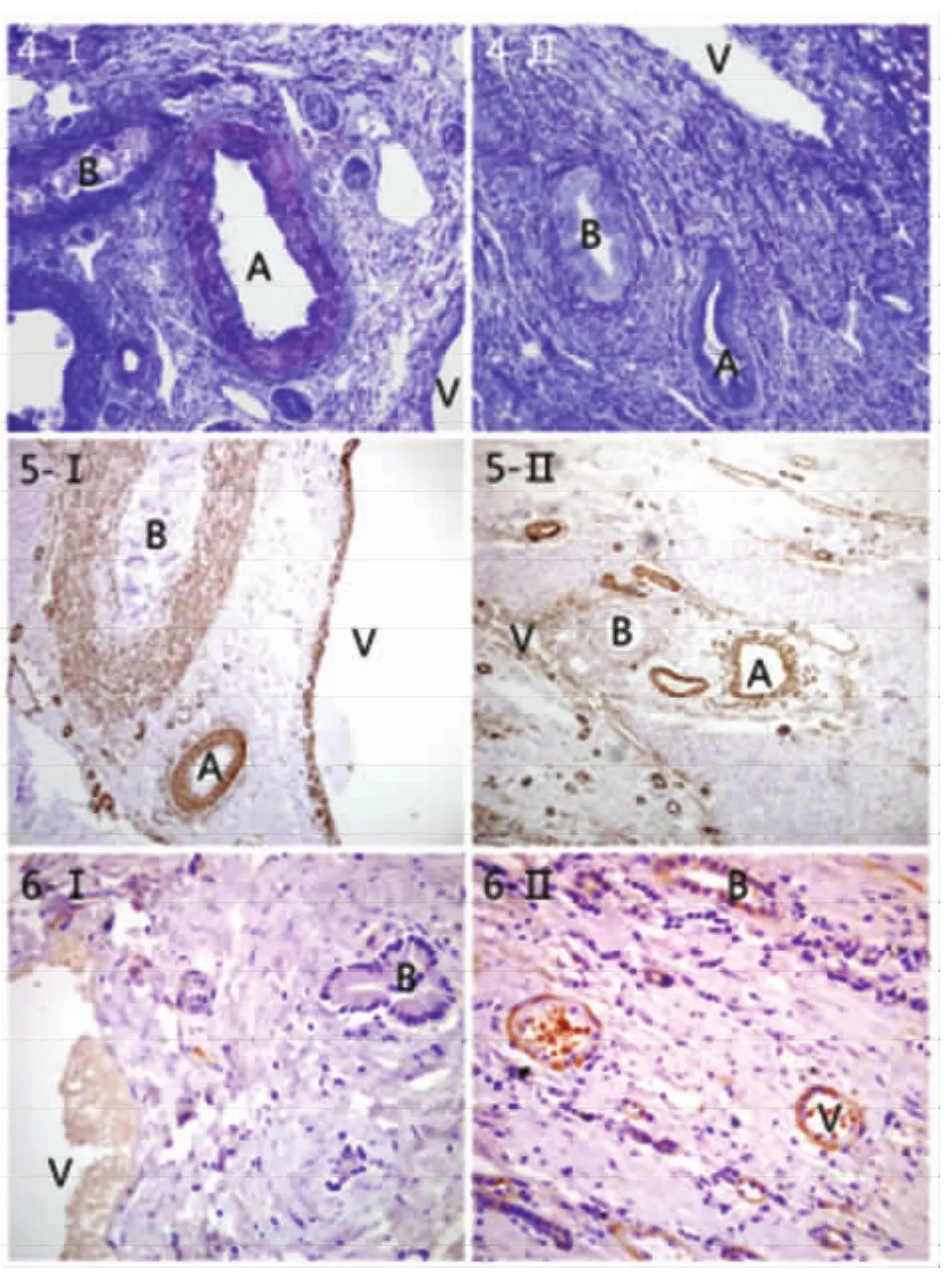
圖4 -Ⅰ 正常右肝內Glisson系統(tǒng)管道(四級)(Masson×100);圖4-Ⅰ 右肝囊型肝包蟲及其表面附著的肝內Glisson系統(tǒng)管道(四級)(Masson×100)。圖5-Ⅰ 正常右肝內Glisson系統(tǒng)管道(四級)Actin表達(免疫組化×100);圖5-Ⅱ 右肝囊型肝包蟲及其表面附著的肝內Glisson系統(tǒng)管道(四級)Actin表達(免疫組化×100)。圖6-Ⅰ 正常右肝內Glisson系統(tǒng)管道(四級)VEGF表達(免疫組化×400);(A-肝內動脈,B-肝內膽管,C-肝包蟲外囊,V-門靜脈)圖6-Ⅱ 右肝囊型肝包蟲與肝組織間VEGF表達,此圖中B為增生的膽管,V為增生的血管(免疫組化×400)Fig.4-Ⅱ Normal hepatic blood vessels and bile ducts in the Glisson's system (right lobe of liver,4th stage)of human(Masson stain,×100)Fig.4-Ⅱ Blood vessels and bile ducts in the Glisson's system(right lobe of liver,4th stage)attached on the surface of ectocyst hepatic hydatid cyst of human(Masson stain,×100)Fig.5-Ⅰ Expression of Actin in normal hepatic blood vessels and bile ducts in the Glisson's system (right lobe of liver,4th stage)of human(SP,×100)Fig.5-Ⅱ Expression of Actin in blood vessels and bile ducts in the Glisson's system (right lobe of liver,4th stage)attached on the surface of ectocyst hepatic hydatid cyst of human(SP,×100)Fig.6-Ⅰ Expression of VEGF in normal hepatic blood vessels and bile ducts in the Glisson's system (right lobe of liver,4th stage)of human(SP,×100)(A-Intrahepatic Artery,B-Intrahepatic bile ducts,C-Ectocyst of hepatic hydatid cyst,V-Portal Vein)Fig.6-Ⅱ Expression of VEGF between hepatic tissue and ectocyst hepatic hydatid cyst of human,B is proliferative bile ducts and V is proliferative blood vessel(SP,×100)
隨著肝包蟲囊腫的生長,其周圍的肝組織萎縮甚至消失。組織萎縮甚至消失的主要原因有兩方面,即細胞凋亡和壞死。前期研究結果表明,凋亡不是包蟲周圍肝細胞消失的主要原因[9],包蟲外囊鄰近的肝細胞發(fā)生變性壞死,因此,提示壞死可能是肝包蟲周圍肝細胞消失的主要方式。壞死是因病理因素而導致的被動死亡,如物理性或化學性的損害因子及缺氧與營養(yǎng)不良等均導致細胞壞死。本研究用VEGF染色鏡下觀察外膜內肝內管道周圍有大量新生小血管及小膽管增生,間接說明局部組織存在缺血缺氧現(xiàn)象。囊性肝包蟲周圍肝內管道解剖位置、組織結構的改變及其纖維化等解剖病理性改變,會導致其功能發(fā)生改變,不能維持局部肝組織正常血供及營養(yǎng)供應,導致局部組織缺血缺氧,細胞因缺血缺氧營養(yǎng)不良,而發(fā)生萎縮、壞死,并且細胞壞死又可進一步加重周圍組織的纖維化。
綜上所述,囊性肝包蟲在慢性膨脹性生長過程中,對囊腫周圍肝內管道長期壓迫,肝內管道移位變形并發(fā)生纖維化,其功能受到嚴重影響,導致局部組織缺血缺氧,而組織缺血缺氧是導致肝包蟲囊腫周圍的肝組織萎縮、變性、壞死而消失的原因之一。
[1]Da Silva AM.Human echinococcosis:a neglected disease[J].Gastroenterol Res Pract,2010:2010.
[2]Siracusano A,Rigano R,Ortona E,et al.Immunomodulatory mechanisms duringEchinococcusgranulosusinfection[J].Exp Parasitol,2008,119(4):483-489.
[3]Hosch W,Stojkovic M,Janisch T,et al.MR imaging for diagnosing cysto-biliary fistulas in cystic echinococcosis[J].Eur J Radiol,2008,66(2):262-267.
[4]楊宏強,彭心宇,張示杰,等.肝內管道CT三維重建在囊性肝包蟲病中的應用研究及意義[J].實用放射學雜志,2006,22(5):543-545.
[5]朱明生,桂東川,趙峰,等.91例肝包蟲囊腫退行性變的CT診斷分析[J].中國人獸共患病學報,2009,25(2):200-201.
[6]彭心宇,張示杰,牛建華,等.肝包蟲外膜內完整摘除術[J].中華普通外科雜志,2002,17(9):529-530.
[7]彭心宇,張示杰,牛建華,等.肝包蟲病外科治療術式選擇的新觀點(附684例報道)[J].腹部外科,2003,16(1):19-21.
[8]姜濤,牛建華,彭心宇,等.肝包蟲囊壁及周圍肝組織中CTGF與TGF-β1的表達[J].石河子大學學報(自然科學版),2007,25(3):321-326.
[9]呂游,張示杰,彭心宇,等.囊型肝包蟲囊周肝細胞“消失”機制的初步研究[J].中國病原生物學雜志,2006,1(5):359-362.

