氨基酸部分替代硝態氮對小白菜產量、品質及根際分泌物的影響
曹小闖,吳良歡,陳賢友,韓科峰
(浙江大學環境與資源學院,教育部環境修復與生態健康重點實驗室,浙江省亞熱帶土壤和植物營養重點實驗室,杭州310058)
近年來,隨著“有機農業”和“有機食品”發展的不斷高漲,植物的有機營養問題越來越引起人們的高度重視。研究發現,植物不僅能吸收、同化氨基酸、核酸、磷脂等小分子有機氮化物,而且還能吸收利用如血紅蛋白、溶菌酶、核糖核酸酶等高分子有機氮化物[1-2],其中氨基酸態氮是植物有機氮養分的重要來源。植物能被動分泌且主動吸收根際分泌的有機氮化物[3],這是植物主動適應環境變化的機制之一。小白菜中含有大量的維生素、礦物質、碳水化合物、維生素等營養物質,是人們日常生活中重要的植物性食品,在現代蔬菜設施栽培中人們為了提高蔬菜產量,盲目施用大量的化學氮肥,導致嚴重的硝酸鹽積累,危害人類健康[4]。已有研究發現,有機氮部分替代無機氮可降低蔬菜硝酸鹽含量,然而由于所采用的試驗材料及環境條件的不同,特別是在常規培養條件下有機氮尤其是氨基酸態氮易于被微生物分解,很多研究者對已取得的試驗結果存在很大的爭議[5-6],對無菌條件下根系分泌物含氮化合物的組成及數量知之不多,且對氨基酸部分替代硝態氮對作物品質、根系結構以及根際分泌物的影響也不甚清楚。本文以雙子葉植物小白菜(Brassica chinensis L.)為供試作物,在局部無菌水培條件下研究了單一或混合氨基酸部分替代硝態氮對小白菜的產量、品質以及根際分泌物的影響,以期為蔬菜養分綜合高效管理提供理論依據。
1 材料與方法
1.1 試驗材料與設計
試驗于2010年7~9月份在浙江大學華家池校區植物有機營養實驗室內進行,供試作物為小白菜(Brassica chinensis L.),品種為“浙白6號”,試驗設4個處理:1)100%硝態氮;2)20%甘氨酸+80%硝態氮;3)20%谷氨酸+80%硝態氮;4)4%甘氨酸+4%谷氨酸+4%丙氨酸+4%脯氨酸+4%天冬氨酸+80%硝態氮,分別記為NO-3、Gly、Glu、AAS,每個處理中總氮的濃度都為12.5 mmol/L,除氮外其它養分配方參考MS培養基的無機鹽組成稍加改變而成,其主要成分參見表1。上述無氮營養液采用121℃高壓滅菌,硝態氮和氨基酸采用超濾膜滅菌(通過孔徑為0.22 μm的微孔濾膜),然后添加到121℃高壓滅菌的無氮營養液中。
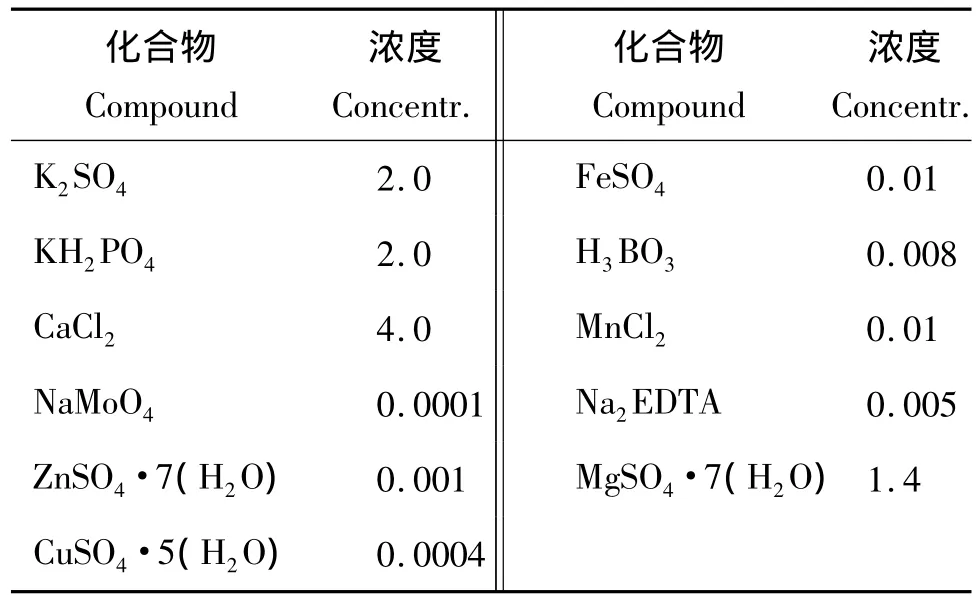
表1 無氮營養液中各元素的組成成分(mmol/L)Table 1 Chemical composition of the nutrient solution without N
將小白菜種子于25℃下浸泡12 h后,按照莫良玉等[7]組合滅菌方法進行滅菌,然后將消毒種子播于含約10 mL營養瓊脂培養基的培養皿中(直徑約為60 mm),每皿播種子15~20粒,蓋上蓋用封口膜封好,置于白天溫度25℃,夜間溫度22℃,空氣濕度為60%,光照強度為6000 lux的植培臺上發芽,并同時進行菌檢。種子發芽后,選取無菌的種子3粒點播于已滅菌且裝滿瓊脂(0.1%)的50 mL塑料離心管(上端有直徑0.5 cm小孔的蓋)中,并包上已滅菌的玻璃紙,然后置于無菌植培臺上,離心管用鋁箔包裹,以保證植物根系在黑暗條件下生長,光照和溫度條件與發芽時相同,且整個實驗期間保持一致。4 d后幼苗從離心管中長出來后去掉玻璃紙,每個離心管保留1株幼苗,然后用南大704硅橡膠密封小孔;7 d后,把苗轉移到另一批滅菌且裝有50 mL 1/2強度的霍格蘭營養液的離心管中,培養7 d后,將營養液更換為處理液,pH為6.0左右,每個處理設15個重復,每支離心管定植1株無菌苗,隨機排列,每3 d更換一次營養液,去掉污染幼苗,局部無菌培養24 d后取樣測定[8]。
培養24 d后收集根系分泌物,收集后立即加入微生物抑制劑(ampicillin),用Parafilm密封,然后置于 -24℃冰箱中冰凍保存[9]。
1.2 測定項目與方法
小白菜收獲后稱重。功能葉片葉綠素含量用SPAD-502葉綠素計測定,以頂端第3、4片葉的葉綠素計讀數(SPAD)平均值表示。根系形態用(STD1600,Epson,Nagano,Japan)型根系掃描儀進行測量。小白菜地上部經烘干、粉碎后,用濃H2SO4-H2O2法進行消解,采用半微量凱氏定氮法測定樣品的含氮量[10-11]。小白菜新鮮功能葉片游離氨基酸含量用水合茚三酮比色法測定;硝酸鹽含量用硫酸-水楊酸法測定;可溶性蛋白用考馬斯亮藍染色法測定,并用牛血清白蛋白作標準曲線;可溶性糖、淀粉含量用蒽酮比色法測定。根系活力用TTC法測定[12]。
幼苗培養24 d后,采用浸根法[13]收集根系分泌物。具體方法:用蒸餾水清洗根部3~5次,再用無菌水清洗,用濾紙吸干根表面水分,然后將根系放入盛有無菌水并包有鋁箔的50 mL離心管中,將離心管放入無菌植培臺上連續培養收集6 h。根系分泌物的收集、分離所用器具均經高壓蒸汽滅菌,然后于60℃條件下抽真空旋轉蒸發、濃縮。其中,根系分泌物中硝態氮測定采用紫外分光光度法,銨態氮測定采用靛粉藍比色法[14];用TOC儀測定根系分泌物中的可溶性總碳(TC)、可溶性總氮(TN)。可溶性總氮減去無機氮(IN=NO-3+NH+4)含量記為根系分泌物中可溶性有機氮(SON)的含量:即,SON=TN-IN,其中可溶性有機氮分為游離氨基酸態氮(FAAS)和其它可溶性有機氮(包括大分子蛋白質、有機酸、酶類,以 QSON 表示),即,QSON=SON -FAAS。
1.3 數據處理
數據采用Statistica 5.5(StaSoft Inc,USA)軟件進行統計分析,顯著性檢驗采用Daucan’s新復極差法(P<0.05)。
2 結果與分析
2.1 氨基酸部分替代硝態氮對小白菜生長及產量的影響
無菌培養24 d后,與單一硝態氮處理(NO-3)相比,Glu和Gly處理小白菜功能葉片SPAD值顯著增大(表2),分別增加了10.1%和10.4%,AAS處理中SPAD值顯著降低,降低了7.1%,葉綠素含量的提高可能是由于外源氨基酸態氮(Gly、Glu)可被小白菜直接吸收利用,并且可以轉變為其它氨基酸,如谷氨酸,而谷氨酸是葉綠素合成的底物。氨基酸部分替代硝態氮各處理都顯著降低小白菜的地上部和地下部鮮重,各處理地上部和地下部鮮重大小順序依次為NO-3>Glu>Gly>AAS,干重變化趨勢與此相同,Glu處理中小白菜生物量降低幅度最小。不同處理間根冠比都達到了顯著性差異,與NO-3處理相比,Gly、Glu、AAS三個處理根冠比分別降低了35.1%、9.5%、23.6%。
2.2 氨基酸部分替代硝態氮對小白菜生理指標的影響
表3看出,氨基酸部分替代硝態氮對小白菜品質的影響因氨基酸種類的不同而異,氨基酸部分替代硝態氮可以在一定程度上改善小白菜品質。Gly、Glu、AAS三個處理顯著降低小白菜葉片硝酸鹽含量,與NO-3處理相比,分別降低了13.0%、30.0%、15.3%,但Gly和AAS處理間沒有顯著差異;此外,Gly、Glu、AAS三個處理小白菜可溶性淀粉的含量也都顯著降低,其大小順序為NO3->Gly>AAS>Glu,且與 NO3-處理相比,分別降低了28.9%、52.9%、47.5%,Glu和 AAS兩處理間沒有顯著差異。

表2 局部無菌水培條件下氨基酸部分替代硝態氮培養24 d后對小白菜幼苗生長的影響Table 2 Effects of partial replacement of NO3--N by amino acid on the growth of pakchoi seeding after 24 days under the partial sterile hydroponics cultivation
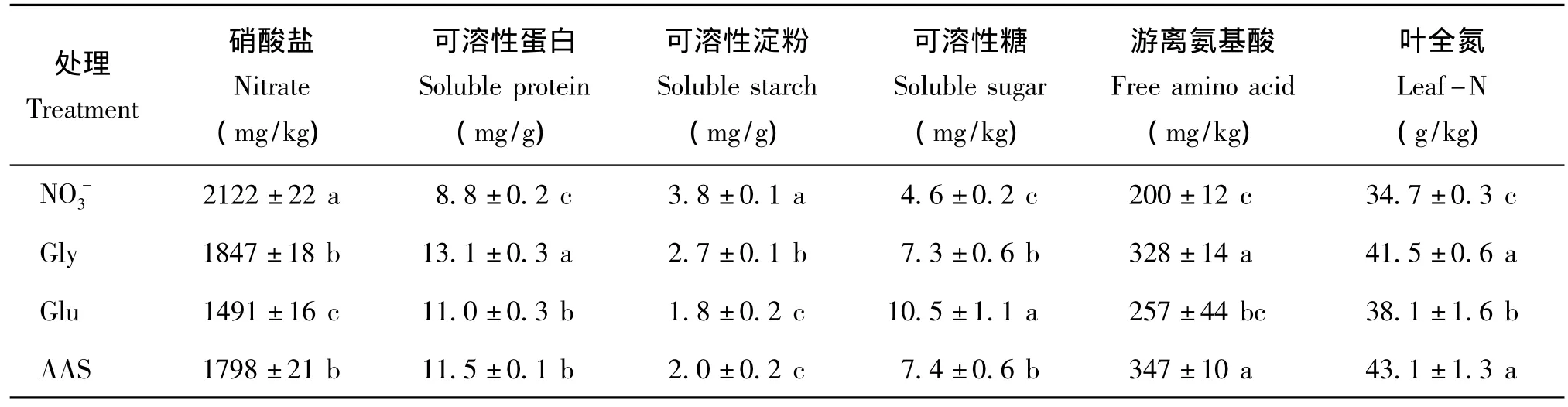
表3 局部無菌水培條件下氨基酸部分替代硝態氮培養24 d后對小白菜生理指標的影響Table 3 Effects of partial replacement of NO3--N by amino acid on the physiological indexes of pakchoi after 24 days under the partial sterile hydroponics cultivation
值得注意,與NO3-處理相比,Gly、Glu、AAS三個處理提高小白菜可溶性蛋白含量的幅度分別為49.5%、25.6%、31.3%,Gly處理小白菜可溶性蛋白含量達到13.1 mg/g,這可能由于Gly的分子量小,易于被小白菜吸收進而轉化為蛋白質有關;Gly、Glu、AAS三個處理小白菜游離氨基酸含量分別提高了63.5%、28.1%、73.1%,AAS處理中游離氨基酸含量最高,達到了347.05 mg/kg,分析原因可能與小白菜對分子態氨基酸(尤其是小分子氨基酸)的吸收同化有關,地下部吸收的分子態氨基酸在根系即經脫氨基、轉氨基作用被同化,由代謝產生的各種氨基酸迅速轉移到地上部參與蛋白質的合成。Glu處理中可溶性糖含量最高,達到了10.54 mg/kg,相對于NO3-處理,Gly、Glu、AAS處理分別提高了58.1%、128.6%、60.3%;與NO3-處理相比,20%氨基酸部分替代硝態氮(Gly、Glu、AAS處理)顯著提高小白菜葉片全氮含量,提高幅度分別為19.6%、9.8%、24.2%;AAS處理中葉片全氮含量最高,達到了43.1 g/kg,說明小白菜能高效利用有機氮。
2.3 氨基酸部分替代硝態氮對小白菜根系形態結構的影響
局部無菌條件下,20%氨基酸態氮部分替代硝態氮對小白菜總根長、根體積、根系活力的影響表現出相同的趨勢(表4),即Glu>Gly>NO-3>AAS,Glu處理促進根毛的生長,根系活力增強,與NO-3處理相比,其根系總根長、根體積、根系活力分別增加28.2%、19.0%、44.9%;相反,AAS處理顯著降低了小白菜總根長、根體積和根系活力,分別降低了11.1%、24.3%、25.9%;Gly、Glu、AAS三個處理中根表面積顯著降低,分別降低了28.9%、16.4%、35.7%。不同氨基酸部分替代硝態氮對小白菜根系直徑影響差異不大,與NO-3處理相比,僅AAS處理根直徑顯著增大,其它各處理間無顯著差異。
2.4 氨基酸部分替代硝態氮對小白菜根系分泌物的影響
表5看出,不同氨基酸處理對小白菜根系分泌物中各組分含量的影響很大。與單一NO-3處理相比,Gly、Glu、AAS三個處理根系分泌物中的硝態氮含量分別降低了19.5%、27.7%、17.1%;相反,20%氨基酸部分替代硝態氮顯著提高各處理中銨態氮、游離氨基酸、總有機碳以及總氮的含量,各處理根系分泌物中銨態氮、游離氨基酸、總有機碳和總氮含量的變化趨勢均為AAS>Gly>Glu>NO-3,但變幅不等。以游離氨基酸為例,與單一NO-3處理相比,Gly、Glu、AAS三個處理根系分泌物中的游離氨基酸含量分別提高了48.9%、46.2%、122.0%,這說明20%氨基酸部分替代硝態氮能促進根際游離氨基酸的分泌;與NO-3處理相比,Gly、AAS處理都顯著提高了根系分泌物中可溶性蛋白含量,分別提高了130.9%,268.3%,但Glu處理與其無顯著差異。已有研究指出,根際分泌物成分復雜,含有多種含氮化合物,本試驗中無機氮只占總氮的很少一部分(24% ~37%),大部分(60%以上)以游離氨基酸等有機氮形式存在,且分泌的氨基酸類氮所占比重(約45%)不依替代氨基酸種類的不同而改變(圖1),此時有機氮尤其是游離氨基酸可能充當植物生長環境中的“臨時氮庫”,可以一定程度上緩解植物對外界氮營養需求。
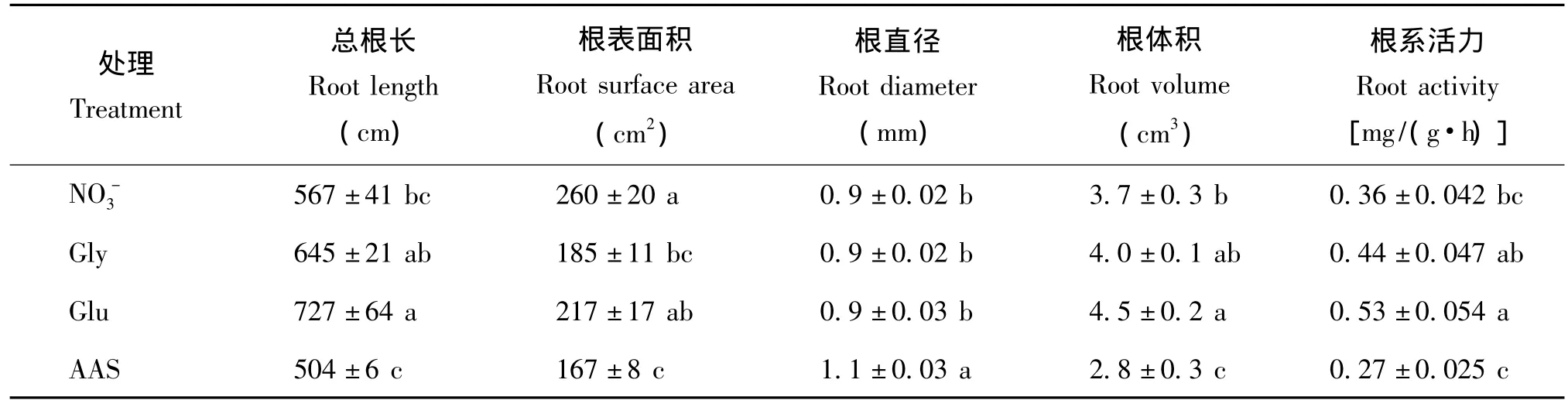
表4 局部無菌水培條件下氨基酸態氮部分替代硝態氮培養24 d后對小白菜根系形態及根系活力的影響Table 4 Effects of partial replacement of NO3--N by amino acid on the root morphology and root activity of pakchoi after 24 days under the partial sterile hydroponics cultivation
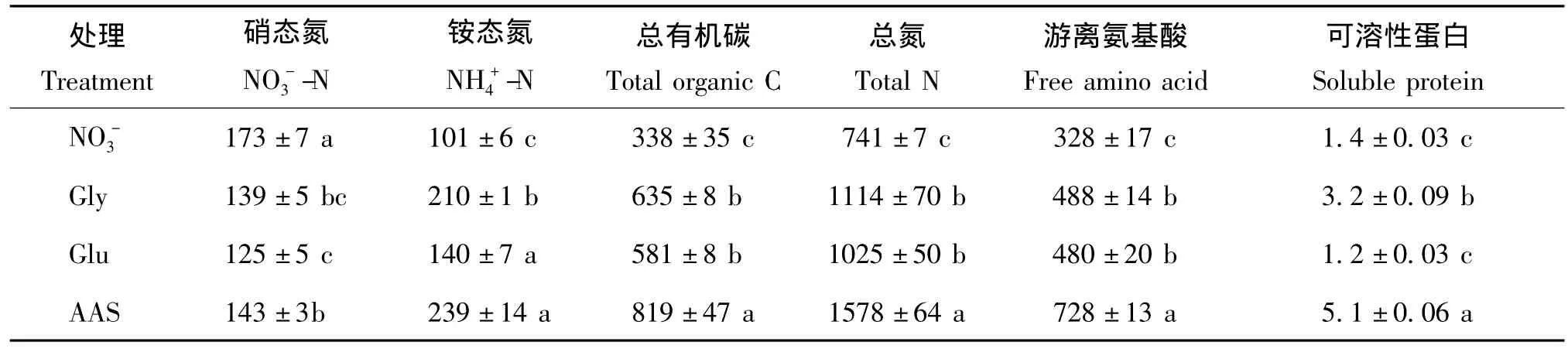
表5 局部無菌水培條件下氨基酸部分代替硝態氮培養24 d后對小白菜根系分泌物的影響(μg/g,DM)Table 5 Effects of partial replacement of NO-3-N by amino acid on the composition of root exudates of pakchoi after 24 days under the partial sterile hydroponics cultivation
2.5 氨基酸部分替代硝態氮對小白菜根際分泌物不同形態氮含量分配比例的影響
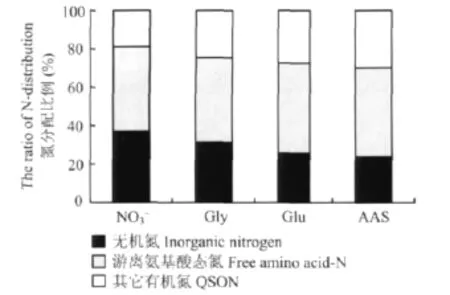
圖1 氨基酸態氮部分替代硝態氮培養24 d對小白菜根系分泌物中不同氮含量分配比例的影響Fig.1 Effects of partial replacement of NO3--N by amino acid on the ratios of different nitrogen contents in root exudates of pakchoi after 24 days of cultivation
小白菜根系分泌物中不同形態氮的含量在氨基酸部分替代硝態氮各處理中表現出明顯差異(圖1)。本試驗中所用營養液無機氮與氨基酸態氮的初始比例為4∶1,但在局部無菌培養24 d后,根系分泌物中的氮形態主要以有機氮為主,NO-3、Gly、Glu、AAS四個處理中有機氮分別是無機氮的1.70倍、2.18倍、2.87倍、3.13倍;與NO-3處理相比,Gly、Glu、AAS三個處理都降低小白菜根系分泌物中無機氮占總氮的百分比,分別降低了5.6%、11.2%、12.8%;NO-3、Gly、Glu、AAS四個處理根系分泌物中的有機氮都以氨基酸態氮為主,其占根系分泌物中總氮的百分比分別為44.26%、43.84%、46.79%、46.16%,各處理間沒有顯著差異。氨基酸態氮占根系分泌物中總氮的百分比不依所替代氨基酸的種類而有所改變,但影響小白菜根系分泌物中其它有機氮占根系分泌物中總氮的百分比,與NO-3處理相比,Gly、Glu、AAS處理中其它有機氮(比如蛋白質、有機酸、酶類)占分泌物總氮的百分比分別提高了為6.04%、8.62%、10.89%。
3 討論與結論
已經證實,氨基酸部分替代硝態氮可以明顯降低作物體內硝酸鹽含量[15],改善作物品質[16-17];但也有人發現氨基酸態氮雖能改善作物品質,但卻不能提高作物的產量,這與所采用的作物以及氨基酸類型、濃度及培養環境等有關[18]。本試驗中小白菜地上部、地下部鮮重或干重,均以NO-3處理最大,進一步說明小白菜屬喜硝植物,氨基酸部分替代硝態氮對小白菜的生長發育表現出一定的抑制作用,與前人的研究結果一致[5,19-20],其中以 Glu 處理降低幅度最低,并且可以顯著改善小白菜營養品質,這與葛體達等[20]的研究結果一致,其為開發新型氨基酸有機肥降低小白菜硝酸鹽含量提供理論依據。在嚴格局部無菌條件下避免了微生物對有機氮化物的分解,發現氨基酸部分替代硝態氮提高了小白菜葉片可溶性糖、游離氨基酸、可溶性蛋白和全氮含量,且降低葉片硝酸鹽以及可溶性淀粉含量,可一定程度改善小白菜的營養品質。
作物產量的形成是養分供應水平與根際環境條件共同作用的結果,根系的代謝狀況直接影響到地上部的生長及其品質的高低[21-23]。大量研究指出,養分缺乏對植物造成生理脅迫,將導致植物生理代謝的異常變化和根系原生質膜透性的增加,同時植物本身也可通過改變根系形態結構、分泌有機物等措施應對環境脅迫[24]。本試驗Gly、Glu處理根系形態特征發育良好,尤其是根毛的生長有利于植物對養分的吸收;相反,AAS處理抑制了小白菜地上部和地下部的生長發育,這可能和小白菜根系對不同氨基酸的吸收能力以及氨基酸的化學特性有關,Gly、Ala屬于小分子簡單氨基酸,植物根系易于吸收轉化利用,而Asp、Pro等氨基酸結構復雜、分子量大,小白菜對這些氨基酸態氮吸收能力較弱;此外,氨基酸降低了小白菜葉片硝酸鹽的含量,由于植株硝態氮營養水平下降也會抑制小白菜地上部和地下部的生長發育。
已有研究表明,在植物—土壤的“根際對話”(Rhizosphere talk)中,植物起主導作用,根際分泌物起“語言”的作用,禾谷類作物一生中大約有30% ~60%的光合產物轉移到地下部,其中有40% ~90%是以有機或無機分泌物的形式釋放到根際[25]。當遭受環境脅迫時,植物根系既可以通過釋放化感物質(酚、有機酸等)的方式提高植物對氮、磷及金屬離子的吸收,提高抗逆性等生理作用,又可以主動吸收根際分泌物[26-27],增加植物在逆境條件下的相對競爭能力。本研究各處理中小白菜地上部和地下部生物量的變化趨勢都為NO-3>Glu>Gly>AAS。根系主要分泌物含量(NH、TN、TOC、FAAS、可溶性蛋白)與小白菜的生物量呈明顯的負相關;Gly、Glu、AAS處理中小白菜的地上部生長發育受到一定程度抑制,但其根系活力明顯增強,根系分泌物中除硝態氮外各組分含量均顯著增加,AAS處理各主要分泌物是NO-3處理的2.13~3.60倍,這似乎說明其根系形態特征以及根系分泌物含量的變化可以在一定程度上緩解小白菜的氮營養脅迫,是小白菜主動適應環境脅迫的機制之一。由于氮的有效性是形成作物產量的主要限制因素,因此其不能從根本上改變小白菜生物量的變化趨勢,但通過改變根系形態特征及根際分泌物組成的“根際對話”,提高了根際中養分的循環和生物有效性,在調節其根際環境微生態系統的動態平衡,促進不同生態系統種間、種內物種的共存等方面可能發揮重要作用。
值得一提的是,與NO-3處理相比,本試驗中Gly、Glu、AAS處理根系分泌物中有機氮占總氮的百分比分別提高了5.6%、11.2%、12.8%,不同處理中有機氮主要以游離氨基酸的形式存在,因此我們推測在應對外界環境營養脅迫時根系分泌物中氨基酸態氮可能作為植物潛在的“臨時氮庫”,其重要性應引起人們的重視。此外,氨基酸態氮對小白菜氮素營養貢獻率以及根際分泌物中不同形態氮化物的流向等問題有待進一步研究。
[1]Koga N,Yamagata M,Matsumoto S et al.Evidence for direct organic nitrogen uptake by plants using specific tracer proteins[A]. HostW J etal. Plantnutrition-food securityand sustainability of agro-ecosystems[M].Dordrech:Kluwer Academic Publishers,2001.212-213.
[2]莫良玉,吳良歡,陶勤南.高等植物對有機氮吸收與利用研究進展[J].生態學報,2001,22(1):118-124.Mo L Y,Wu L H,Tao Q N.Advances in study of plant organic nitrogen nutrition[J].Acta Ecol.Sin.,2001,22(1):118-124.
[3]Jones L,Darrah R.Amino-acid influx at the soil-root interface of Zea mays L.and its implications in the rhizosphere[J].Plant Soil,1994,164:1-14.
[4]Dich J,Jrvinen R,Knekt P et al.Dietary intakes of nitrate,nitrite and NDMA in the finnish mobile clinic health examination survey[J].Food Addit.Contam.,1996,13(5):541-552.
[5]Wang H J,Wu L H,Wang M Y et al.Effects of amino acid replacing on growth,nitrate accumulation and macroelement concentrations in Pakchoi(Brassica chinensis L.)[J].Pedosphere,2007,17(5):595-600.
[6]Gunes A,Inal A,Akta M.Reducing nitrate content of net grown winter onion plants(Allium cepa L.)by partial replacement ofwith amino acid in nutrient solution[J].Sci.Hortic.,1996,65:203-208.
[7]莫良玉,吳良歡,陶勤南.植物有機營養研究中供試種子組合滅菌方法比較[J].浙江大學學報(農業與生命科學版),2000,26(6):643-646.Mo L Y,Wu L H,Tao Q N.Studies on combinative sterilization method to seed for plant organic nutrient experiments[J].J.Zhejiang Univ.(Agric.Life Sci.),2000,26(6):643-646.
[8]朱維琴,吳良歡,陶勤南.水稻有機營養研究中完全及局部無菌培養方法探討[J].植物營養與肥料學報,2004,10(5):516-521.Zhu W Q,Wu L H,Tao Q N.Studies on totally and partially enclosed sterile culture methods used in the research of rice organic nutrition[J].Plant Nutr.Fert.Sci.,2004,10(5):516-521.
[9]Warren C R,Adams P R.Uptake of nitrate,ammonium and glycine by plants of Tasmanian wet eucalypt forests[J].Tree Physiol.,2007,27:413-419.
[10]鮑士旦.土壤農化分析[M].北京:中國農業出版社,2000.Bao S D.Soil and agricultural chemistry analysis[M].Beijing:China Agricultural Press,2000.
[11]Groleau R V,Plantureux S,Guckert A.Influence of plant morphology on root exudation of maize subjected to mechanical impedance in hydroponic conditions[J].Plant Soil.,1998,201(2):231-239.
[12]王學奎.植物生理生化實驗原理和技術(第二版)[M].北京:高等教育出版社,2006.Wang X K.Principles and techniques of plant physiological biochemical experiment(2nd edn.)[M].Beijing:Higher Education Press,2006.
[13]Szmigielska A M,Van Rees K C J,Cieslinski G et al.Determination of low molecular weight dicarboxylic acids in root exudates by gas chromatography[J].J.Agric.Food.Chem.,1995,43(4):956-959.
[14]魯如坤.土壤農業化學分析方法[M].北京:中國農業科技出版社,1999.Lu R K.Method of soil and agricultural chemistry analysis[M].Beijing:China Agricultural Science and Technology Press,1999.
[15]Inal A,Tarakcioglu C.Effects of nitrogen forms on growth,nitrate accumulation,membrane permeability and nitrogen use efficiency of hydroponically grown bunch onion under boron deficiency and toxicity[J].J.Plant Nutr.,2001,24(10):1521-1534.
[16]鐘曉紅,石雪暉,肖浪濤.色氨酸提高草莓果實品質和產量試驗[J].中國果樹,2001,(2):4-7.Zhong X H,Shi X H,Xiao L T.The experiment of tryptophan improving the quality and yield of Strawberry(Fragaria ananassa Duchesne L.)[J].China Fruits,2001,(2):4-7.
[17]武彥榮,高秀瑞,陳貴林,等.外源氨基酸對不結球白菜和生菜品質的影響[J].西南農業大學學報(自然科學版),2005,27(3):60-63.Wu Y R,Gao X R,Chen G L et al.Effect of exogenous amino acids on the quality of non-heading cabage and lettuce[J].J.Southwest Agric.Univ.(Nat.Sci.),2005,27(3):60-63.
[18]Redhaiman K N A.Nitrate accumulation and metabolism in lettuce cultivars as influenced by ammonium:nitrate ratios in recirculating nutrient solution[J].India J.Agric.Res.,2001,35(4):219-225.
[19]Wang H J, Wu L H, Zhu Y H et al. Growth, nitrate accumulation,and macronutrient concentration of pakchoi as affected by external nitrate-N ∶amino acid-N ratio[J].J.Plant Nutr.,2008,31:1789-1799.
[20]葛體達,黃丹楓,蘆波,等.無機氮和有機氮對水培番茄幼苗碳水化合物積累及氮素吸收的影響[J].應用與環境生物學報,2008,14(5):604-609.Ge T D,Huang D F,Lu B et al.Effect of inorganic and organic nitrogen supply on accumulation of carbohydrate and nitrogen in tomato seedlings under hydroponic culture[J].Chin.J.Appl.Environ.Biol.,2008,14(5):604-609.
[21]李春儉,馬瑋,張福鎖.根際對話及其對植物生長的影響[J].植物營養與肥料學報,2008,14(1):178-183.Li C J,Ma W,Zhang F S.Rhizosphere talk and its impacts on plant growth[J].Plant Nutr.Fert.Sci.,2008,14(1):178-183.
[22]王樹起,韓曉增,李曉慧,等.缺磷脅迫下的大豆根系形態特征研究[J].農業系統科學與綜合研究,2010,26(2):192-196.Wang S Q,Han X Z,Li X H et al.Root morphology of soybean(Glycinemax L.)under phosphorus deficiency stress[J].Syst.Sci.Compr.Stud.Agric.,2010,26(2):192-196.
[23]陳際型.鉀素營養對水稻根系生長和養分吸收的影響[J].土壤學報,1997,34(2):182-188.Chen J X.Effect of K nutrition on rice root growth and nutrient uptake[J].Acta Pedol.Sin.,1997,34(2):182-188.
[24]陳龍池,廖利平,汪思龍,等.根系分泌物生態學研究[J].生態學雜志,2002,21(6):57-62.Chen L C,Liao L P,Wang S L et al.A review for research of root exudates ecology[J].Chin.J.Ecol.,2002,21(6):57-62.
[25]Lynch J M,Whipps J M.Substrate flow in the rhizosphere[J].Plant Soil,1990,129:1-10.
[26]Paterson E,Sim A.Rhizodeposition and C-partitioning of Lolium perenne in axenic culture affected by nitrogen supply and defoliation[J].Plant Soil.,1999,216:155-164.
[27]Jones D L,Darrah P R.Amino-acid influx at the soil-root interface of Zea Mays L.and its implications in the rhizosphere[J].Plant Soil.,1994,163:1-12.

