金屬催化端炔與亞胺衍生物親核加成制備炔丙基胺的研究進展*
成 明, 李伯剛
(1. 中國科學院 成都有機化學研究所,四川 成都 61004l;2. 中國科學院 研究生院,北京 100039; 3. 中國科學院 成都生物研究所,四川 成都 61004l)
近年來,隨著生命科學的蓬勃發展,含氮化合物引起了人們的極大興趣。在合成的這些含氮化合物中,炔丙基胺就是一類非常重要的合成中間體,被廣泛應用于合成天然產物和一些具有一定生物活性的復雜分子。炔丙基胺分子中的C≡C鍵可以很容易發生氫化反應,此法可以用來設計合成含有不同飽和側鏈的α-氨基酸衍生物。另外由于炔基的富電子特性,炔丙基胺化合物可以經歷[3+2]或[4+2]環加成反應制備其它類型的非天然氨基酸衍生物(Scheme 1)[1~7]。
在傳統的合成炔丙基胺的方法[8~10]中,通常采用炔丙基鹵化物、炔丙基磷酸酯或炔丙基三氟甲磺酸酯的氨基化反應和有機金屬炔基化試劑、格式試劑與亞胺或亞胺衍生物的親核加成反應。這些方法通常需要事先合成炔基化試劑或不穩定的亞胺衍生物,反應需要無水、無氧等苛刻條件,并且伴隨等量副產物的產生,嚴重抑制了此方法的廣泛應用。與傳統合成方法相比,金屬催化端炔與亞胺或烯胺(或原位產生的亞胺或烯胺)的親核加成反應是目前制備炔丙基胺的理想方法,并得到了充分發展。此方法主要分為兩類:間接偶聯反應和直接偶聯反應。間接偶聯反應(Scheme 2)屬于二元反應,即亞胺與端炔的直接加成反應;直接偶聯反應屬于三組分反應,即醛或酮、胺、炔三組分一步構建C-N鍵的反應。與間接偶聯反應[11~13]相比,直接偶聯反應具有以下幾個優點: (1)不需要預先合成比較活潑的亞胺或烯胺; (2)親核試劑不需要預先活化。
根據偶聯反應分類的不同,本文綜述了金屬催化端炔與醛亞胺、酮亞胺或烯胺(或原位產生的亞胺)的親核加成制備炔丙基胺的合成方法,并介紹了本小組發展的將原位產生的酮亞胺直接應用于炔加成反應來構建季碳炔丙基胺的方法。
Scheme1
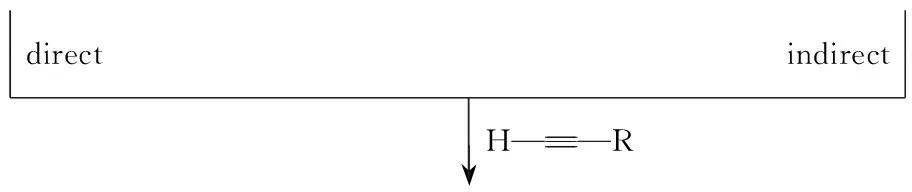
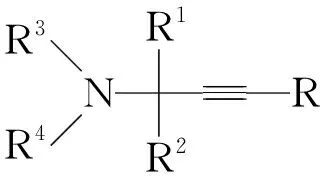
Scheme2
1 間接偶聯反應
亞胺可分為醛亞胺和酮亞胺。端炔與亞胺或烯胺的親核加成反應是一類非常重要的制備叔碳或季碳氨基化合物的合成方法,并得到充分發展。此類反應屬于二元反應,即亞胺或烯胺與炔的直接加成反應。下面分別介紹了醛亞胺、酮亞胺或烯胺與端炔的親核加成反應。
Carreira等[14]報道了三甲基硅基乙炔與醛亞胺的加成反應。在[IrCl(COD)]2催化下,合成叔碳炔丙基胺。此反應底物適應性較差。為了克服以上缺點,Carreira等[15]于2004年又報道了炔基鋅化合物與N-酰基或N-膦酰基醛亞胺的加成反應。在Zn(OTf)2催化下,合成叔碳炔丙基胺,并得到較好的產率和底物適用性(Scheme 3)。但此類反應通常需要預先制備敏感的亞胺或其衍生物、有機金屬親核試劑,且副產物等量產生。
Knochel等[16,17]分別在2002和2003年報道了烯胺作為親電試劑的間接炔加成反應,并首次報道了CuBr/(+)-Quinap催化體系,實現了端炔對烯胺的不對稱加成,產物ee值高達90%(Scheme 4)。
1995年,M A Huffman等報道了一個通過炔基鋰與N-酰基酮亞胺加成制備抗癌候選藥物取代喹唑啉酮的反應。Y G Si等[18,19]報道了炔與酮亞胺經間接偶聯反應合成季碳炔丙基胺的方法(Scheme 5)。在此反應中,在手性試劑的存在下,炔基直接與N-酰基酮亞胺可手性合成抗HIV藥物的反應。
Scheme3
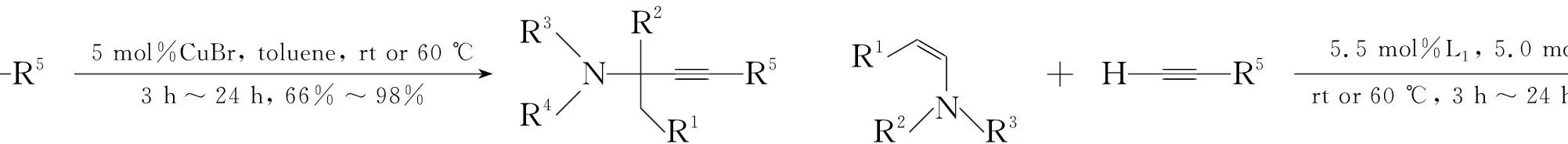
Scheme4
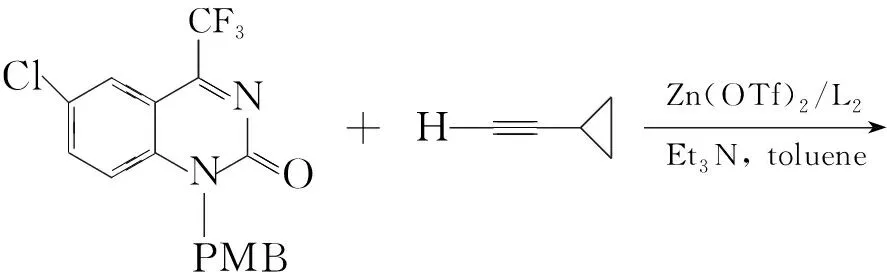
Scheme5
綜上所述,與傳統合成方法相比,間接偶聯反應盡管在一定程度上改善了合成炔丙基氨基化合物的方法,但其需要預先合成比較活潑的亞胺或烯胺和部分反應的親核試劑需要預先活化的缺點限制了此方法的廣泛應用,因此尋找一個高效、方便有用的合成方法成為迫切需要。
2 直接偶聯反應
三個或更多的化合物以一鍋煮的反應方式形成一個包含所有組分主要結構的新化合物的過程被稱為多組分反應。多組分反應過程中至少涉及兩個以上的官能團,可將其視為多個雙分子反應組合體,但它并不單純是幾個分子在數量上的疊加,還必須是一個根據多米諾規則進行的有序反應。與傳統的雙分子反應相比,多組分反應在產生分子結構的復雜性和多樣性上具有很大的優勢。其中,將亞胺和端炔應用于多組分反應的方法受到了廣泛的關注,并得到了顯著的發展。最具代表性的反應就是A3反應[20~26]。A3反應屬于三組分反應,即端炔與醛和胺原位產生的亞胺或亞胺衍生物親核加成,一步構建叔碳炔丙基胺,此類反應條件溫和,易于操作。迄今為止,Ag, Au, Cu, Ir, Zn鹽或絡合物以及Cu/Ru等雙金屬催化體系被廣泛應用于A3反應體系。其反應機理如Scheme 6所示。
盡管A3反應得到了顯著發展,但在這些直接偶聯反應中,原位產生的C=N雙鍵親電試劑僅僅局限于醛亞胺,此反應僅適用于制備叔碳炔丙基胺。與醛亞胺相比,酮亞胺由于空間位阻和電子效應的影響,其反應活性遠低于醛亞胺。因此,將原位產生的酮亞胺應用于直接偶聯反應,一直以來都是一大挑戰。迄今為止,僅有極少報道,并且都有很大的局限性。盡管如此,其在合成季碳炔丙基胺化合物的應用價值依然誘人。
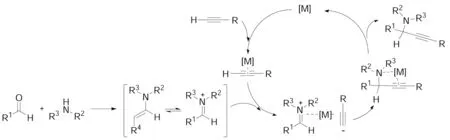
[M]=Ag, Au, Cu, Ir, Zn鹽或絡合物以及Cu/Ru等雙金屬催化體系
Scheme7
X=CH2, NAc, NBn, NCO2Et, NBz
Scheme8
R1=R2=Et, 38% yield; R1=Me, R2=Ph, 29% yield
Scheme9
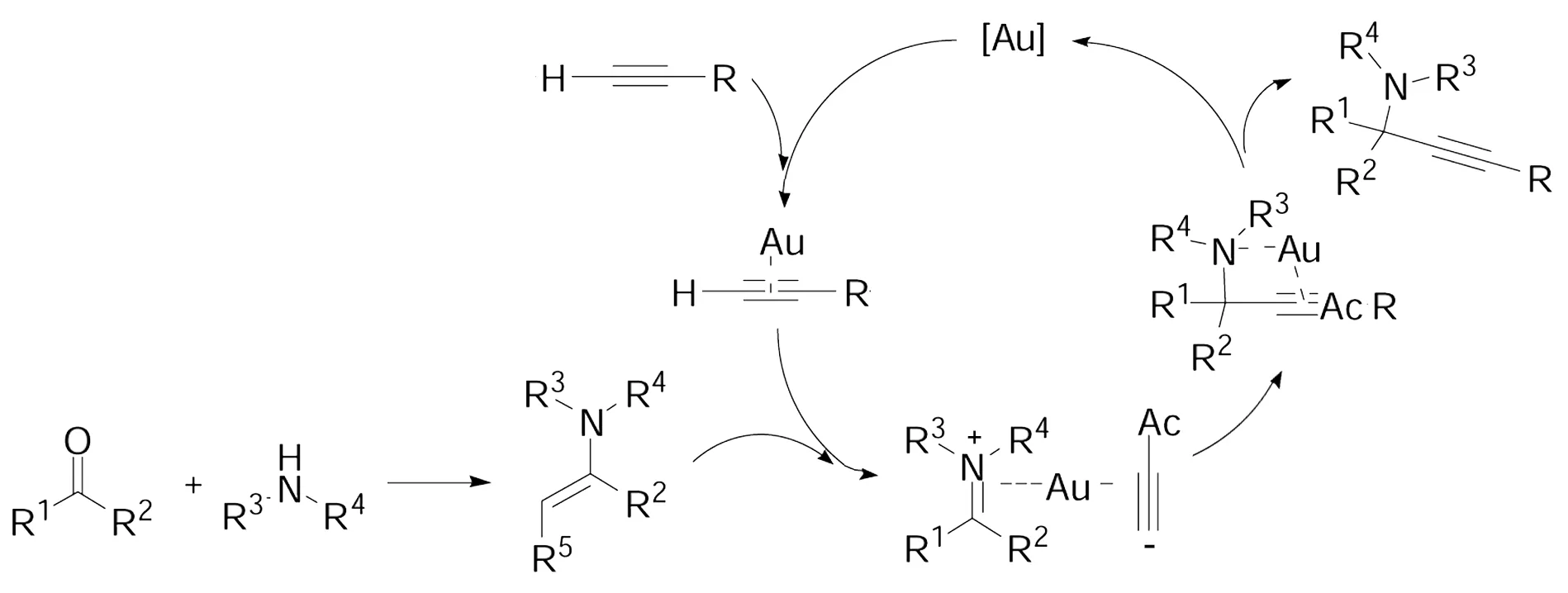
Scheme 10
近年來,Che等報道了Au[P(t-Bu)2(o-biphenyl)]Cl/AgSbF6聯合催化的分子內直接偶聯反應。但此反應需要事先合成羰基和氨基在同一分子內的特殊化合物,并且反應的底物適僅應用于N-(4-甲氧基苯基)-5-氨基戊-2-酮與苯乙炔的親核加成反應(Scheme 7)。Van der Eycken等[27]報道了CuI催化的脂肪酮、伯胺、炔三組分反應。此反應需微波輔助、高溫下才能獲得較好的產率(Scheme 8)。Yus等[28]報道了Cu(OH)x-Fe3O4催化的酮、胺、炔三組分直接偶聯反應。底物適應于苯乙炔、3-戊酮或苯乙酮和哌啶,此反應在高溫下反應7 d,且產率較低(Scheme 9)[29]。
雖然,以酮為亞胺供體的酮、胺、炔三組分直接偶聯制備季碳炔丙基胺的反應取得了一定的進展,但這些反應都受到反應條件和底物適應性的嚴重限制,極大的降低了這些反應的應用價值。因此發展一種新穎的、高效的酮、胺、炔三組分直接偶聯反應,成為化學工作者合成季碳炔丙基胺的重要目標。為此,我們小組發展了一種AuBr3催化三組分酮、胺、炔一步有效合成季碳炔丙基胺的方法。此方法具有:反應條件溫和,不需要其它添加劑或外部輔助設備,起始原料簡單易得,反應操作簡便,反應產率較高。此反應適用于脂肪酮、二級胺、端炔的偶聯加成反應,為合成季碳炔丙基胺提供一個高效、方便有用的方法(Scheme 10)[30]。
3 結論
近年來,金屬催化端炔與亞胺或烯胺(或原位產生的亞胺或烯胺)的親核加成反應已經發展成為構建叔碳或季碳C-N鍵的重要反應。其中,多組分反應是尤為重要的一類,此法不需要事先合成敏感的亞胺或烯胺,不需要預先活化親核試劑,有望成為合成叔碳或季碳炔丙基胺化合物的重要方法。
[1] Taggi A E, Hafez A M, Lectka T.α-Imino esters:Versatile substrates for the catalytic,asymmetric synthesis ofα- andβ-amino acids andβ-lactams[J].Acc Chem Res,2003,36:10-19.
[2] Ferraris D, Young B, Dudding T,etal. Catalytic,enantioselective alkylation ofα-imino esters using late transition metal phosphine complexes as catalysts[J].J Am Chem Soc,1998,120:4548-4549.
[3] Hagiwara E, Fujii A, Sodeoka M. Enantioselective addition of enol silyl ethers to imines catalyzed by palladium complexes:A novel way to optically active acylalanine derivatives[J].J Am Chem Soc,1998,120:2474-2475.
[4] Kobayashi S, Hamada T, Manabe K. The catalytic asymmetric mannich-type reactions in aqueous media[J].J Am Chem Soc,2002,124:5640-5641.
[5] Knudsen K R, Risgaard T, Nishiwaki N,etal. The first catalytic asymmetric aza-henry reaction of nitronates with imines:A novel approach to optically activeβ-nitro-α-amino acid- andα,β-diamino acid derivatives[J].J Am Chem Soc,2001,123:5843-5844.
[6] Nishiwaki N, Knudsen K R, Gothelf K V,etal. Catalytic enantioselective addition of nitro compounds to imines-A simple approach for the synthesis of optically activeβ-nitro-amino esters[J].Angew Chem,Int Ed Engl,2001,40:2992-2995.
[7] Ji J X, Au Yeung T T L, Wu J,etal. Efficient synthesis ofβ,γ-alkynylα-amino acid derivatives by Ag(Ⅰ)-catalyzed alkynylation ofα-imino esters[J].Adv Synth Catal,2004,346:42-46.
[8] Kopka I E, Fataftah Z A, Rathke M W. Preparation of a series of highly hindered secondary amines,including bis-(triethylcarbinyl)amine[J].J Org Chem,1980,45:4616-4622.
[9] Imada Y, Yuassa M, Nakamura I,etal. Copper(Ⅰ)-catalyzed amination of propargyl esters.Selective synthesis of propargylamines,l-alken-3-ylamines,and (Z)-allylamines[J].J Org Chem,1994,59:2282-2284.
[10] Tubery F, Grierson D S, Husson H P. Simple 4-acetoxy-5,6-dihydropyridinium salts:New synthons for the preparation of functionalized piperidine systems[J].Tetrahedron Lett,1987,28:6457-6460.
[11] List B, Pojarliev P, Biller W T,etal. The proline-catalyzed direct asymmetric three-component Mannich reaction:Scope,optimization,and application to the highly enantioselective synthesis of 1,2-amino alcohols[J].J Am Chem Soc,2002,124:827-833.
[12] Koradin C, Polborn K, Knochel P. Enantioselective synthesis of proargylamines by copper-catalyzed addition of alkynes to enamines[J].Angew Chem Int Ed,2002,41:2535-2538.
[13] Trost B M, Terrell L R. A direct catalytic asymmetric mannich-type reaction tosyn-amino alcohols[J].J Am Chem Soc,2003,125:338-339.
[14] Fischer C, Carreira E M. Direct addition of TMS(acetylene to aldimines catalyzed by a simple,commercially available Ir(Ⅰ) complex[J].Org Lett,2001,3:4319-4321.
[15] Fischer C, Carreira E M. Zn(alkynylide additions to acyl Iminiums[J].Org Lett,2004,6:1497-1499.
[16] Koradin C, Polborn K, Knochel P. Enantioselective synthesis of proargylamines by copper-catalyzed addition of alkynes to enamines[J].Angew Chem Int Ed,2002,41:2535-2538.
[17] Koradin C, Gommermann N, Polborn K,etal. Synthesis of enantiomerically enriched propargylamines by copper-catalyzed addition of alkynes to enamines[J].Chem Eur J,2003,9:2797-2811.
[18] Huffman M A, Yasuda N, Decamp A E,etal. Lithium alkoxides of cinchona alkaloids as chiral controllers for enantioselective acetylide addition to cyclicN-acyl ketimines[J].J Org Chem,1995,60:1590-1594.
[19] Jiang B, Si Y G. Highly enantioselective construction of a chiral tertiary carbon center by alkynylation of a cyclicN-acyl ketimine:An efficient preparation of HIV therapeutics[J].Angew Chem Int Ed,2004,116:218-220.
[20] Wei C M, Li Z G, Li C J. The first silver-catalyzed three-component coupling of aldehyde,alkyne,and amine[J].Org Lett,2003,5:4473-4475.
[21] Park S B, Alper H. An efficient synthesis of propargylamines via C-H activation catalyzed by copper(Ⅰ) in ionic liquids[J].Chem Commun,2005:1315-1317.
[22] Wei C M, Li C J. A highly efficient three-component coupling of aldehyde,alkyne,and amines via C-H activation catalyzed by gold in water[J].J Am Chem Soc,2003,125:9584-9585.
[23] Wei C M, Mague J T, Li C J. Asymmetric catalysis special feature part Ⅱ:Cu(Ⅰ)-catalyzed direct addition and asymmetric addition of terminal alkynes to imines[J]Proc Natl Acad Sci,2004,101:5749-5754.
[24] Li C J, Wei C M. Highly efficient Grignard-type imine additions via C-H activation in water and under solvent-free conditions[J].Chem Commun,2002:268-269.
[25] Ramu E, Varala R, Sreelathaa N,etal. Zn(OAc)2·2H2O:A versatile catalyst for the one-pot synthesis of propargylamines[J].Tetrahedron Lett,2007,48:7184-7190.
[26] Cao K, Zhang F M, Tu Y Q,etal. Iron(Ⅲ)-catalyzed and air-mediated tandem reaction of aldehydes,alkynes and amines:An efficient approach to substituted quinolines[J].Chem Eur J,2009,15:6332-6334.
[27] Liu X Y, Che C M. A highly efficient and selective AuI-catalyzed tandem synthesis of diversely substituted pyrrolo[1,2-a]quinolines in aqueous media[J].Angew Chem Int Ed,2008,47:3805-3810.
[28] Pereshivko O P, Peshkov V A, Van der Eycken E V. Unprecedented Cu(Ⅰ)-catalyzed microwave-assisted three-component coupling of a ketone,an alkyne,and a primary amine[J].Org Lett,2010,12:2638-2641.
[29] Aliaga M J, Ramón D J, Yus M. Impregnated copper on magnetite:An efficient and green catalyst for the multicomponent preparation of propargylamines under solvent free conditions[J].Org Biomol Chem,2010,8:43-46.
[30] Cheng M, Zhang Q, Hu X Y,etal. Gold-catalyzed direct intermolecular coupling of ketones,secondary amines,and alkynes:A facile and versatile access to propargylamines containing a quaternary carbon center[J].Adv Synth Catal,2011,353:1274-1278.

