阿爾茲海默病小鼠模型的磁共振影像學分析
朱 皓,高 凱,張連峰,2
(1.中國醫學科學院,北京協和醫學院,醫學實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,北京 100021;2.國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021)
阿爾茨海默病(Alzheimer's disease,AD)是一種在世界范圍內老年人高發病率的神經退行性變性疾病,其基本的病理學改變是腦組織中老年斑、神經原纖維纏結以及神經元的丟失[1]。AD病人臨床上主要表現為記憶力障礙、認知功能減退。由于目前阿爾茨海默病發現時多為中、晚期,此時缺乏根本有效的治療方法,治療將更為困難,因此對阿爾茨海默病的早期診斷、提高診斷的敏感性和準確性顯得尤為重要。但到目前為止,在AD病理發展過程中得到的研究結果也不是很一致[2-4]。轉基因動物模型的發展,使得人們可以短時間內在動物模型上縱向研究MRI標志物與病理發展的關系。
磁共振成像(magnetic resonance imaging,MRI)技術以其高組織對比度、可任意方向成像、無顱骨偽影干擾等特點,為提高AD診斷的敏感性和特異性提供了方法。特別是近年來高場強(≥7.0 T)MRI的出現以及飛速發展的磁共振功能成像技術,如擴散加權成像(diffusion-weighted imaging,DWI)、擴散張量成像(diffusion tensor imaging,DTI)等的應用,為阿爾茨海默病的早期診斷研究提供了條件[5,6]。
本研究利用7.0 T高場磁共振成像技術,分別對不同年齡的小鼠癡呆模型(APP/PS1轉基因小鼠)進行了磁共振常見參數T2弛豫時間、擴散加權成像中的表觀擴散系數(apparentdiffusion coefficient,ADC)值[5]以及擴(彌)散張量成像中的各向異性分數(fractional anisotropy,FA)值[6]等參數變化,為進一步利用磁共振技術來研究AD進行了探索。
1 材料和方法
1.1 實驗動物及設備
本實驗采用 1、3、5、7、9和 11個月齡的健康雄性AD轉基因小鼠模型APPswe/PSENldE9每個月齡各6只及同齡雄性野生型(wild type,WT)小鼠每個月齡各6只;實驗動物由本實驗室提供(SCXK(京)2009-0007)。
利用本實驗室的Varian 7.0 T磁共振成像設備(Varian,Palo Alto,CA)進行圖像掃描。本實驗方案已經得到中國醫學科學院醫學實驗動物研究所實驗動物使用與管理委員會的批準,批準號為ILAS-GC-2012-001。
1.2 MRI圖像掃描
掃描前采用1.5%~2%異氟烷和氧氣混合氣體對小鼠進行吸入麻醉(Visualsonics,Canada)。當小鼠完全麻醉后,將小鼠俯臥位固定于掃描床上。用Varian 7.0 T/160 mm磁共振儀,選用小鼠頭顱線圈接收,依次進行小鼠大腦橫斷位快速自旋回波(Fast Spin Echo,FSE)序列 T2加權成像(T2weighted imaging,T2WI)掃描,多回波自旋回波(multiple spin echo,MSE)序列掃描并進行后處理獲得 T2map,擴散加權成像(DWI)序列以及擴散張量成像(DTI)序列的掃描。
(1)FSE-T2WI掃描參數如下:TR=2 500 ms,TE=60 ms,ETL=8,FOV=20 mm ×20 mm,層厚/間距(Thk/Gap)=0.8mm/1.0mm,采樣矩陣(matrix)=256×512;重復次數 (NEX)=4。
(2)MSE-T2map 掃描參數:TR=2 000 ms,TE=10 ms、20 ms、30 ms、40 ms、50 ms、60 ms、70 ms、80 ms,FOV=20 mm ×20 mm,層厚(Thk)=0.8 mm,采樣矩陣(matrix)=256×256,重復次數(NEX)=2。
(3)DWI掃描參數:TR=2 000 ms,TE=37 ms,擴散梯度持續時間(δ)=5 ms,擴散梯度間隔(Δ)=15 ms,擴散敏感系數(b)值 ={13.242 6,120.043,398.604,848.925}/s/mm2,FOV=20 mm×20 mm,層厚(Thk)=0.8 mm,采樣矩陣(matrix)=256 ×256,重復次數(NEX)=4。
(4)DTI掃描參數:TR=2 000 ms,TE=36 ms,[Gx,Gy,Gz]=[1,1,0],[1,0,1],[0,1,1],[-1,1,0],[0,-1,1]和 [1,0,-1]。擴散敏感系數(b)值=1 000 s/mm2,FOV=20 mm ×20 mm,層厚(Thk)=0.8 mm,采樣矩陣(matrix)=192×192,重復次數(NEX)=4。
1.3 參數測量及統計
T2弛豫時間、ADC值以及FA值的測量是利用系統自帶的VnmrJ 3.1軟件對相應序列采集到的圖像進行擬合。在擬合圖像上手動畫出感興趣區(region of interest,ROI),本實驗選擇大腦皮層和海馬兩個部位,在每個部位分別取3個大小均等的ROI進行統計。數據采用SPSS 13.0統計軟件進行分析,各腦區的 T2弛豫時間、ADC值和FA值用平均數±標準差表示,組間比較采用 t檢驗。用 P<0.05表示差異的顯著性。
2 結果
2.1 AD轉基因小鼠模型的動態磁共振圖像分析
AD轉基因小鼠APP/PSl在4月齡出現行為學變化,5月齡開始出現老年斑[7]。用磁共振 T2WI圖像對不同月齡小鼠進行分析。結果顯示1、3、5和7月齡AD轉基因小鼠活體腦組織的T2WI成像未見明顯低信號區。9月齡AD轉基因小鼠頂葉皮層及海馬區可見少量點狀低信號區(圖1(a)),11月齡時點狀低信號增多(圖1(b))。對照組(WT)各月齡小鼠腦組織內均未見明顯點狀低信號區(圖1(c)和(d))。說明 T2WI圖像可顯示 APP/PS1轉基因小鼠模型后期變化,而不能顯示早期病理改變。
2.2 AD轉基因小鼠模型的T2弛豫時間對比分析
用MSE-T2map對不同月齡小鼠頂葉皮層和海馬區的T2弛豫時間進行分析,結果顯示,在1、3、5月齡APP/PSl轉基因小鼠和對照組皮層和海馬的T2弛豫時間無明顯差異。而從7月齡到9月齡,APP/PSl轉基因小鼠皮層和海馬的T2弛豫時間有減小的趨勢,但是隨著年齡增加反而有所上升,與對照組的差異并沒有統計學意義(圖2)。
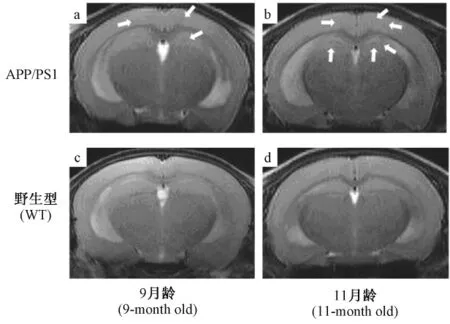
圖1 小鼠腦組織的T2加權圖像Fig.1 T2WI analysis of the mouse brains
2.3 AD轉基因小鼠模型的ADC值對比分析
利用DWI序列對不同月齡小鼠頂葉皮層和海馬區的ADC值進行了對比分析,圖4結果顯示在3~5月齡 APP/PSl轉基因小鼠頂葉皮層和海馬的ADC值開始出現下降趨勢;而從7月齡,APP/PSl轉基因小鼠頂葉皮層和海馬的ADC值明顯減小(圖3和圖4),并與對照組有顯著性差異(P≤0.05)。
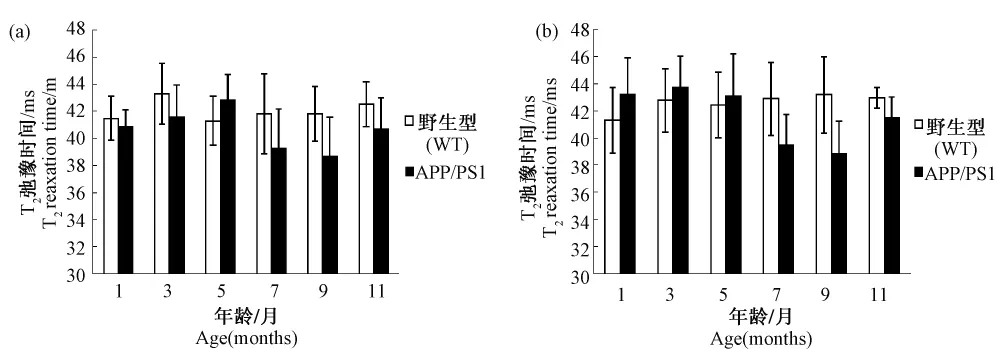
圖2 小鼠T2弛豫時間測定Fig.2 T2relaxation time determination of the mouse brains.
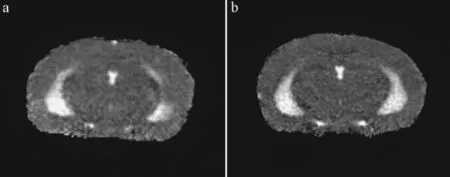
圖3 7月齡小鼠ADC圖像。Fig.3 ADC images of 7-month old mice.
2.4 AD轉基因小鼠模型的FA值對比分析
利用DTI序列對不同月齡小鼠頂葉皮層和海馬區的FA值的進行了對比分析,圖5為 DTI重建后的FA圖像,圖5和圖6結果顯示從5月齡開始APP/PSl轉基因小鼠頂葉皮層和海馬區的FA值明顯減小,并與對照組有顯著性差異(P≤0.05)。
3 討論
目前臨床對AD的研究主要集中在海馬容積等形態學測量上,而AD的病理學表現可能在形態學改變之前已經出現,因此對AD腦組織微觀變化的研究顯得尤為重要。
APP/PS1小鼠是本實驗室構建的雙轉基因AD小鼠模型,是目前能比較好的反映人類AD病理進程的一種模型,該模型的特點是在4月齡時開始出現行為學變化,5月齡開始出現老年斑,7月齡后出現大量老年斑的沉積[7]。利用該模型進行磁共振研究,可以反映不同病理發展時期的影像特點。
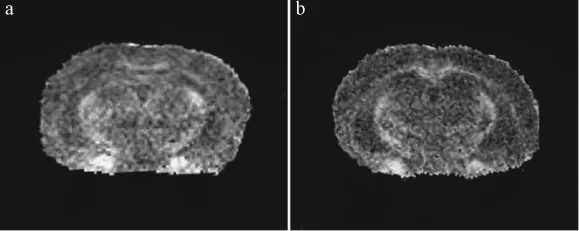
圖5 5月齡小鼠FA圖像。Fig.5 FA images of the 5-month old mice.
本實驗利用高場強(7.0 T)對 1、3、5、7、9 和 11個月齡的健康雄性AD轉基因小鼠(APP/PS1)進行磁共振掃描。在 T2WI圖像中,9和11月齡該模型小鼠的頂葉皮層和海馬區在發現有稀疏的點狀低信號影,這表示Aβ淀粉樣斑塊中富集鐵質,鐵質具有順磁性,它會造成局部磁場不均勻,這種不均勻的局部磁場將會導致磁共振信號降低,因而會在T2WI圖像上表現為黑色的低信號點。有研究表明FSE-T2WI和梯度回波序列(gradient echo,GRE)-WI都可以體現這種斑塊和周圍組織的對比[8,9],相比較而言FSE是在90°射頻激發脈沖后施加多次180°射頻反轉脈沖產生的多次自旋回波信號,并且對每個回波獨立地進行相位編碼,按一定規律排列于K空間。由于多個緊鄰的180°脈沖,從而使得磁化率不同所致的相位作用減少,所以FSE的磁化效應較低,對于早期鐵離子沉積較少的Aβ淀粉樣斑塊的敏感度較高。而WI受磁場不均勻的影響較大,因此對Aβ淀粉樣斑塊的敏感度相對較低[9]。
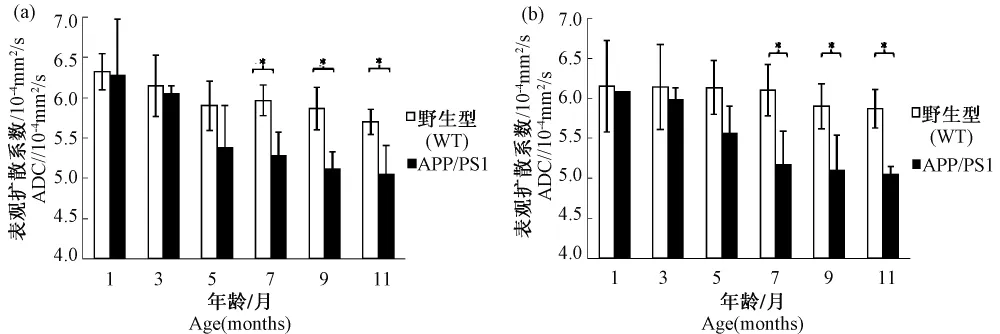
圖4 小鼠ADC值測定Fig.4 ADC value determination of the mouse brains
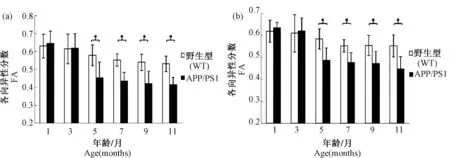
圖6 小鼠FA值測定Fig.6 FA value determination of the mouse brains.
對T2弛豫時間的測量結果進行分析,7~9月齡APP/PS1小鼠的T2弛豫時間逐漸減小的趨勢。可以推測的是在早期Aβ淀粉樣斑塊開始形成時期,老年斑中鐵的含量相對較少,還不會對T2弛豫時間產生一定的負性作用,隨著小鼠月齡的增加,腦組織中的Aβ的沉積越來越明顯,Aβ淀粉樣斑塊中的鐵含量也逐漸增多,理論上Aβ與鐵的共同作用會造成T2弛豫時間的縮短[11]。但還有其它因素會影響T2弛豫時間,如形態的改變、炎癥以及腦脊液(CSF)空間的擴張帶來的在MR圖像中的部分容積效應會使T2弛豫時間增大[12]。在本實驗中,9~11月齡APP/PS1小鼠的T2弛豫時間又有所增大,但依然小于對照組,驗證了對于 APP/PS1模型小鼠,T2弛豫時間受多重因素影響,并且與正常對照組無顯著性差異。并且在臨床研究中,AD患者的T2弛豫時間變化也沒有統一的結論[2,12]。因此頂葉皮層和海馬區的T2弛豫時間并不能作為該模型在這2個腦區出現病理改變的早期診斷參數。
擴散加權成像(DWI)反映的是水分子在腦組織中的擴散速率[5]。一般來說,水分子在腦組織中擴散行為的改變直接反映了腦組織微觀結構的改變,常用表面擴散系數(ADC)來刻畫水分子的擴散能力,即擴散速率越快,ADC值越大。本實驗中在3~5月齡APP/PSl轉基因小鼠頂葉皮層和海馬區的ADC值開始降低但和對照組無明顯差異。而7~11月齡,APP/PSl轉基因小鼠頂葉皮層和海馬區的ADC值明顯減小,并與對照組有顯著性差異(P≤0.05)。推測ADC值下降的原因是由于Aβ淀粉樣斑塊形成后,導致神經膠質增生,而活化的膠質細胞所分泌的一些大分子物質,導致了組織的粘度增加,水分子擴散能力下降。同時,星形膠質細胞和小膠質細胞的體積和數目的增多,對水分子的擴散也會造成阻礙。Mueggler等[13]分析 APP23小鼠腦組織ADC值在早期(5月齡)沒有明顯變化的原因是早期腦內的Aβ淀粉樣斑塊是以彌散型的斑塊為主,這種斑塊所導致的膠質增生還不是很明顯,所以ADC值變化不大。而到老齡(23月齡)APP23小鼠腦內的 Aβ淀粉樣斑塊是以致密型的斑塊為主,能導致明顯的膠質增生和神經膠質炎癥反應,這是該小鼠ADC值減少的主要原因。
擴(彌)散張量成像(DTI)對腦白質結構的微觀變化(比如脫髓鞘,軸突喪失,神經膠質過多)和神經纖維走向的變化十分敏感[6],因此可用來對AD腦白質病理變化的機制進行更深入的探討,各向異性分數(FA)體現水分子擴散的方向依賴程度,即水分子在沿著神經纖維的方向上擴散較快,而在垂直于神經纖維的方向上擴散較慢。當水分子以各向同性擴散(球形擴散)時,FA=0;擴散的各向異性程度越大,FA值越接近1。它是顯示白質纖維束是否損傷及損傷程度的敏感指標,其值越高提示組織具有更好的方向性和更好的纖維束的黏合程度[14]。本實驗中5~11月齡的APP/PSl轉基因小鼠頂葉皮層和海馬的FA值明顯減小,并與對照組有顯著性差異(P≤0.05)。推測原因可能是,發病早期的軸索膜或髓鞘破壞和脫失造成神經纖維密度降低,以及膠質增生,因而水分子的擴散更趨向于各向同性,因此FA值降低。
本實驗利用磁共振成像技術對 1、3、5、7、9 和11個月齡的健康雄性APPswe/PSENldE9小鼠腦組織頂葉皮層和海馬的微觀病變進行定量研究,發現T2WI能夠在9月齡發現呈點狀低信號的 Aβ淀粉樣斑塊,但與對照組相比T2弛豫時間在整個研究過程中無明顯差異,不能作為早期檢測AD病變的參數。利用功能磁共振成像技術中的擴散加權成像(DWI)和擴(彌)散張量成像(DTI)中的參數 ADC值和FA值,分別發現頂葉皮層和海馬從7月齡(ADC值),甚至5月齡(FA值)開始,與對照組有顯著性差異(P≤0.05)。本實驗結果表明7.0T高場強MRI能夠顯示病變出現早期(5月齡)AD轉基因小鼠APP/PS1頂葉皮層及海馬FA值的明顯改變,揭示了高場強MRI能夠顯示AD病變出現早期小鼠頂葉皮層及海馬FA值的明顯改變,FA值對早期癡呆病臨床診斷具有一定的參考價值。
[1] Alves L,Correia AS,Miguel R,et al.Alzheimer's disease:a clinical practice-oriented review [J]. FrontNeurol,2012,3:63.
[2] Haley AP, KnightSJ, FuchsKL, etal. Shortening of hippocampus spin-spin relaxation time in probable Alzheimer's disease:a1H magnetic resonance spectroscopy study[J].Neurosci Lett,2004,362(3):167 -170.
[3] Laakso MP,Partanen K,Soininen H,et al.MR T2relaxometry in Alzheimer's disease and age-associated memory impairment[J].Neurobiol Aging,1996,17(4):535 -540.
[4] Kirsch SJ,Jacobs RW,Butcher LL,et al.Prolongation of magnetic resonance T2time in hippocampus of human patients marks the presence and severity of Alzheimer's disease[J].Neurosci Lett,1992,134(2):187 -190.
[5] Yoon B,Shim YS,Hong YJ,et al.Comparison of diffusion tensor imaging and voxel-based morphometry to detect white matter damage in Alzheimer's disease[J].J Neurol Sci,2011,302(1-2):89-95.
[6] Kantarci K,Petersen RC,Boeve BF,et al.DWI predicts future progression to Alzheimer disease in amnestic mild cognitive impairment[J].Neurology,2005,64(5):902 - 904.
[7] 宗園媛,王曉映,王海林,等.APP/PS雙轉基因阿爾茨海默病小鼠模型的老年斑及行為學動態分析[J].中國比較醫學雜志,2008,9:8-12.
[8] Burgess BL,McIsaac SA,Naus KE,et al.Elevated plasma triglyceride levels precede amyloid deposition in Alzheimer's disease mouse models with abundant A beta in plasma[J].Neurobiol Dis,2006,24:114 -127.
[9] Wengenack TM, ReyesDA, CurranGL, etal. Regional differences in MRI detection of amyloid plaques in AD transgenic mouse brain[J].NeuroImage,2011,54:113 -122.
[10] Ryan C,Denise R,Geoffrey LC,et al.Comparison of amyloid plaque contrast generated by T2-, T*2-, and susceptibilityweighted imaging methodsin transgenic mouse models of Alzheimer's disease[J].Magn Reson Med,2009,61(5):1158-1164.
[11] Jack CR,Wengenack TM,Reyes DA,et al.In vivo magnetic resonance microimaging of individual amyloid plaques in Alzheimer's transgenic mice[J].J Neurosci,2005,25(43):10041-10048.
[12] Laakso MP,Partanen K,Soininen H,et al.MR T2relaxometry in Alzheimer's disease and age-associated memory impairment[J].Neurobiol Aging,1996,17(4):535 -540.
[13] Mueggler T,Meyer LM,Rausch M,et al.Restricted diffusion in the brain of transgenic mice with cerebral amyloidosis[J].Eur J Neurosci,2004,20(3):811 -817.
[14] Bozzali M,Falini A,Franceschi M,et al.White matter damage in Alzheimer's disease assessed in vivo using diffusion tensor magnetic resonance imaging[J].J Neurol Neurosurg Psychiatry,2002,72(6):742-746.

