萬年蒿總黃酮超聲波提取工藝的優(yōu)化*
黃靜,郝文芳
(西北農(nóng)林科技大學(xué)生命科學(xué)學(xué)院,陜西楊凌,712100)
萬年蒿總黃酮超聲波提取工藝的優(yōu)化*
黃靜,郝文芳
(西北農(nóng)林科技大學(xué)生命科學(xué)學(xué)院,陜西楊凌,712100)
以萬年蒿為原料,研究超聲波提取萬年蒿總黃酮的最佳工藝。通過單因素試驗(yàn)研究乙醇體積分?jǐn)?shù)、料液比、超聲波功率及超聲時(shí)間對(duì)總黃酮提取量的影響。以此為基礎(chǔ),采用L9(34)正交試驗(yàn)設(shè)計(jì),優(yōu)化超聲波提取萬年蒿總黃酮工藝條件;并將其與傳統(tǒng)的熱回流法和浸提法進(jìn)行了比較。超聲波提取萬年蒿總黃酮的最佳提取工藝參數(shù)為:乙醇體積分?jǐn)?shù)60%,料液比1∶20(g:mL),超聲波功率350 W,超聲時(shí)間60 min。在此工藝條件下,萬年蒿總黃酮提取量為69.55 mg/g。
萬年蒿,超聲波提取,總黃酮,提取工藝,正交試驗(yàn)設(shè)計(jì)
黃酮類化合物是植物體中普遍存在的次生代謝物,是許多傳統(tǒng)藥物的有效成分。研究證實(shí),黃酮類化合物具有抗細(xì)菌、抗真菌、抗病原體、抗癌、抗氧化和消炎等多種藥理作用[1-3],具有重要的研究價(jià)值。目前,有關(guān)萬年蒿(Artemisia sacrorum Ledeb.)化學(xué)成分的研究已有大量報(bào)道,而黃酮類化合物,如芹黃素、芫花黃素,則是其重要的化學(xué)成分[4-5]。萬年蒿,又名白蓮蒿、鐵桿蒿,為菊科(Compositae)蒿屬(Artemisia)草本植物[6],常作為民間藥用于治療急慢性肝炎、小兒驚風(fēng)、發(fā)熱、急慢性胃腸炎等疾病,并具有一定的抗腫瘤、保肝護(hù)肝之功效[7-11]。因此,對(duì)萬年蒿中黃酮類化合物的研究和開發(fā)具有重要意義。
傳統(tǒng)提取技術(shù),如熱回流提取或浸漬提取,常用于黃酮類化合物的提取,但存在著耗時(shí)耗能,溶劑和樣品需求量大,提取產(chǎn)物易損失等不足[12-14]。超聲波提取技術(shù)主要依靠超聲波在提取溶劑中的空化效應(yīng)進(jìn)行有效成分的提取。當(dāng)超聲波在溶液中傳播時(shí),負(fù)壓促使空化泡的不斷形成和破裂,引起細(xì)胞壁破碎,有效增強(qiáng)了溶劑的傳質(zhì)作用,進(jìn)而促進(jìn)有效成分從植物組織中快速釋放出來[15-16]。作為一門新興的提取技術(shù),超聲波提取展現(xiàn)出穿透力強(qiáng)、效率高、周期短、操作簡單等顯著特點(diǎn)[13,17-18],并已廣泛應(yīng)用于生物活性物質(zhì)的提取,且取得了較好的效果[19-20]。本研究以總黃酮提取量為評(píng)價(jià)指標(biāo),采用超聲波提取技術(shù)對(duì)萬年蒿總黃酮的最佳提取工藝進(jìn)行研究,并與傳統(tǒng)提取方法進(jìn)行比較,以期建立高效快速、操作簡便的提取萬年蒿總黃酮的工藝方法。
1 材料、試劑與儀器
萬年蒿于2010年9月下旬采自陜西省安塞地區(qū)(經(jīng)西北農(nóng)林科技大學(xué)生命科學(xué)學(xué)院吳振海高級(jí)實(shí)驗(yàn)師鑒定)。將材料地上部分自然陰干,粉碎,過40目篩,保存于干燥處備用。
蘆丁對(duì)照品(上海晶純?cè)噭┯邢薰?純度≥98%),亞硝酸鈉、硝酸鋁、氫氧化鈉、無水乙醇、石油醚(60~90℃)等,均為分析純。
KQ-500DE型超聲波清洗機(jī)(昆山市超聲儀器有限公司),RE-52AA型旋轉(zhuǎn)蒸發(fā)儀(上海亞榮生化儀器廠),SHZ-D(Ⅲ)真空泵(鞏義市予華儀器有限責(zé)任公司),752紫外-可見分光光度計(jì)(上海光譜儀器有限公司)。
2 試驗(yàn)方法
2.1 對(duì)照品溶液的制備
稱取干燥至恒重的蘆丁對(duì)照品20.00 mg,用體積分?jǐn)?shù)為30%的乙醇溶解并定容至100 mL,搖勻,即得0.20 mg/mL蘆丁對(duì)照品溶液。
2.2 標(biāo)準(zhǔn)曲線的建立[21]
吸取上述蘆丁對(duì)照品溶液 0、2.0、4.0、6.0、8.0、10.0 mL分別置于25 mL具塞試管中,30%乙醇補(bǔ)充至10.0 mL,加入5%NaNO2溶液0.7 mL,混勻后靜置6 min,再加入0.7 mL 10%Al(NO3)3溶液,搖勻后靜置6 min,然后加入4%NaOH溶液 5 mL,用30%乙醇稀釋至刻度,搖勻后靜置10 min,于波長510 nm下測(cè)定吸光度。以吸光度(Y)為縱坐標(biāo)、質(zhì)量濃度(X)為橫坐標(biāo)建立直線回歸,得回歸方程:Y=
11.927X﹢ 0.000 4,R2=1,線性范圍為 0.016~0.080 mg/mL。
2.3 總黃酮的超聲波提取及含量測(cè)定
稱取萬年蒿粗粉1.000 g置于50 mL塑料密封管中,按不同料液比加入一定濃度的乙醇溶液,密封,在一定功率和時(shí)間下,將溫度控制在(45±1)℃,進(jìn)行超聲波提取,冷卻、過濾并合并濾液,乙醇提取液經(jīng)旋轉(zhuǎn)蒸發(fā)儀減壓回收,蒸干,殘?jiān)?0 mL蒸餾水溶解,經(jīng)石油醚萃取脂溶性成分,棄去石油醚層,水層加無水乙醇配成30%乙醇溶液后轉(zhuǎn)入100 mL容量瓶中,用30%乙醇定容至刻度,搖勻即得供試品溶液,并按以下公式計(jì)算總黃酮提取量:
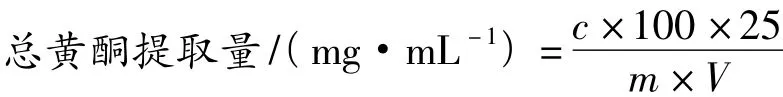
式中:c為線性方程計(jì)算出的總黃酮質(zhì)量濃度(mg/mL);V為檢測(cè)時(shí)所取溶液體積(mL);m為樣品質(zhì)量(g)。
2.4 精密度試驗(yàn)
精密量取相同量對(duì)照品溶液6份,按2.2節(jié)標(biāo)準(zhǔn)曲線的制備方法測(cè)定吸光度值,結(jié)果測(cè)得平均吸光度為0.387,相對(duì)標(biāo)準(zhǔn)偏差(RSD)為0.78%,表明精密度良好。
2.5 穩(wěn)定性試驗(yàn)
按2.3節(jié)操作,將同一份供試品溶液分別在0、10、20、30、40、50、60 min 內(nèi)進(jìn)行吸光度值測(cè)定。結(jié)果測(cè)得RSD為0.48%,表明供試液在60 min內(nèi)基本穩(wěn)定。
2.6 重復(fù)性試驗(yàn)
平行稱取萬年蒿樣品6份,制備供試品溶液,按2.3節(jié)測(cè)定吸光度值,結(jié)果測(cè)得平均吸光度為0.621,RSD為1.33%,表明重復(fù)性良好。
2.7 加標(biāo)回收率試驗(yàn)
稱取總黃酮含量已知的萬年蒿樣品6份,加入蘆丁對(duì)照液0.5 mL,按2.3節(jié)測(cè)定吸光度值,結(jié)果測(cè)得平均回收率為92.22%,RSD為1.61%。
2.8 單因素試驗(yàn)
2.8.1 乙醇體積分?jǐn)?shù)對(duì)總黃酮提取量的影響
在料液比1∶20(g:mL)、超聲波功率300 W的條件下,超聲提取30 min后,測(cè)定乙醇體積分?jǐn)?shù)為30%、45%、60%、75%、90%、100%時(shí)總黃酮提取量。
2.8.2 料液比對(duì)總黃酮提取量的影響
在乙醇體積分?jǐn)?shù)為60%、超聲波功率300 W的條件下,超聲提取30 min后,測(cè)定料液比為1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g:mL)時(shí)總黃酮提取量。
2.8.3 超聲波功率對(duì)總黃酮提取量的影響
在乙醇體積分?jǐn)?shù)為60%、料液比1∶20(g:mL)的條件下,超聲提取30 min后,測(cè)定超聲波功率為200、250、300、350、400、450 W 時(shí)總黃酮提取量。
2.8.4 超聲時(shí)間對(duì)總黃酮提取量的影響
在乙醇體積分?jǐn)?shù)為60%、料液比1∶20(g:mL)和超聲波功率300 W的條件下,測(cè)定超聲提取0、15、30、45、60、75 min 后總黃酮提取量。
2.9 正交試驗(yàn)設(shè)計(jì)
在單因素試驗(yàn)的基礎(chǔ)上,以乙醇體積分?jǐn)?shù)、料液比、超聲波功率和超聲時(shí)間為影響因素,按L9(34)正交試驗(yàn)設(shè)計(jì)優(yōu)化萬年蒿總黃酮超聲波提取工藝,每個(gè)因素設(shè)計(jì)3個(gè)水平(見表1)。
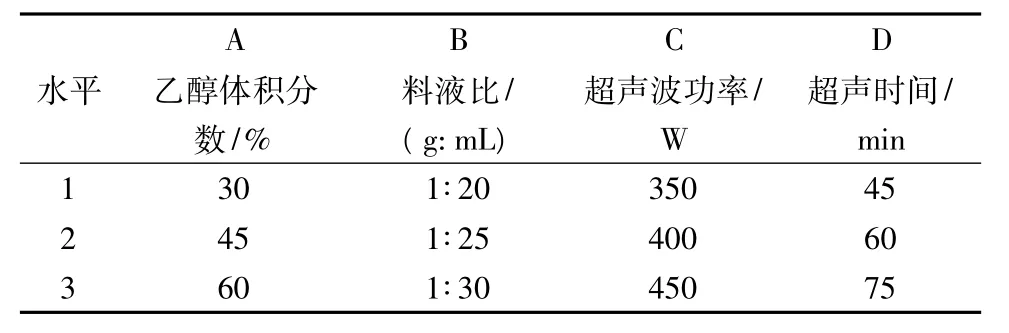
表1 正交試驗(yàn)因素水平
2.10 回流法和浸漬法提取萬年蒿總黃酮
浸漬法:稱取1.000 g萬年蒿樣品2份,按料液比1∶20(g:mL)置于60%的乙醇水溶液中,在常溫和45℃下分別浸泡24 h,冷卻、過濾并合并濾液,按2.3方法測(cè)定總黃酮的提取量。
回流法:稱取5.000 g萬年蒿樣品2份,按料液比1∶20(g:mL)加入60%乙醇水溶液,在45℃下分別回流提取60、120 min后,冷卻、過濾并合并濾液,按2.3方法進(jìn)行總黃酮提取量的測(cè)定。
3 結(jié)果與分析
3.1 單因素試驗(yàn)
3.1.1 乙醇體積分?jǐn)?shù)對(duì)總黃酮提取量的影響
如圖1所示,當(dāng)乙醇體積分?jǐn)?shù)由30%增加至60%時(shí),總黃酮提取量緩慢增加,當(dāng)體積分?jǐn)?shù)為60%時(shí),總黃酮提取量達(dá)到最大值,此后隨著乙醇體積分?jǐn)?shù)的增加總黃酮提取量迅速降低,無水乙醇時(shí)達(dá)到最小值。這主要與溶劑的極性相關(guān),依據(jù)“相似相溶”原理,目標(biāo)物的極性同溶劑的極性越相似,目標(biāo)物越容易被溶解。同時(shí),水的存在有助于干燥材料擴(kuò)散能力和滲透能力的恢復(fù)[19],促進(jìn)植物材料的膨脹,增加材料和提取溶劑之間的接觸面積[22]。相關(guān)研究證明[16],在相同的乙醇體積分?jǐn)?shù)下,超聲波法提取的有效成分含量明顯高于浸漬提取。這是由于超聲波在一定程度上加速了干樣的水化過程,促進(jìn)了有效成分從細(xì)胞內(nèi)釋放[23]。并且,提取溶劑表面張力的增加、黏度和蒸汽壓的降低也將引起超聲波的空化作用的增強(qiáng),進(jìn)而促使提取率升高[24]。提取過程中,隨著溶劑極性的不斷降低,提取溶液由紅棕色逐漸變化為深綠色,葉綠素等低極性雜質(zhì)在提取溶劑中的含量不斷增加,阻礙了黃酮類化合物的溶出,導(dǎo)致黃酮類物質(zhì)提取量降低。因此,本研究選擇體積分?jǐn)?shù)為30%、45%、60%的乙醇作為后續(xù)正交試驗(yàn)的因素水平。
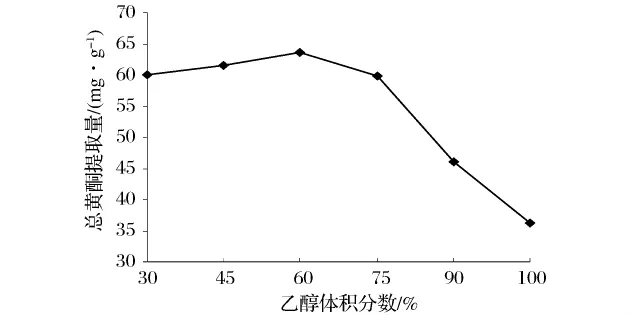
圖1 乙醇體積分?jǐn)?shù)對(duì)總黃酮提取量的影響
3.1.2 料液比對(duì)總黃酮提取量的影響
由圖2 可知,在料液比1∶10 ~1∶20(g∶mL)之間,萬年蒿總黃酮提取量隨著料液比的增加而提高,而當(dāng)料液由1∶20增加至1∶30時(shí),總黃酮提取量變化則相對(duì)穩(wěn)定,大于1∶30后提取量開始下降。一般情況下,提取溶劑量越大,細(xì)胞壁內(nèi)外濃度差越大,有效成分越容易從細(xì)胞內(nèi)滲出,提取率越高。但是溶劑用量過大,溶劑對(duì)超聲波能量的吸收增加,而空化泡對(duì)能量的吸收則相應(yīng)減少,細(xì)胞壁破裂不完全,目標(biāo)化合物不能從細(xì)胞中很好溶出,從而導(dǎo)致提取率降低[25-26]。實(shí)際生產(chǎn)過程中,溶劑用量太大不僅會(huì)增加后續(xù)濃縮工作的難度而且會(huì)造成溶劑和能源的嚴(yán)重浪費(fèi)。但是,料液比過小,材料中的有效成分則不能被充分提取,提取率將偏低。因此,若想以最低的成本獲得最高的效益,選擇合適的料液比至關(guān)重要。綜合考慮,本研究選擇料液比1∶20、1∶25、1∶30 作為后續(xù)正交試驗(yàn)的因素水平。
3.1.3 超聲波功率對(duì)總黃酮提取量的影響
如圖3所示,其他條件一定時(shí),隨著超聲波功率的增加,萬年蒿總黃酮提取量隨之增加,400 W時(shí)達(dá)到最高點(diǎn),當(dāng)功率大于400 W后總黃酮提取量開始下降。總黃酮提取量之所以隨著超聲波功率的增加而不斷提高是因?yàn)楣β实脑黾右鸪暡栈饔玫脑鰪?qiáng)[16]。當(dāng)超聲波在溶劑中傳播時(shí),形成的空化泡在材料表面周圍的破碎,產(chǎn)生強(qiáng)烈的剪切力,引起了植物組織細(xì)微裂縫的形成。由于共振態(tài)氣泡尺寸與聲波的振幅成比例,所以超聲波功率越大,超聲波在提取介質(zhì)中的振幅越大,空化泡的破碎越劇烈[27],有效成分的提取率越高。但當(dāng)功率過高時(shí),一些目標(biāo)化合物的結(jié)構(gòu)則會(huì)受到破壞,并且非有效成分也將隨著材料的劇烈破碎大量溶解于提取溶劑中,有效成分的溶解量相應(yīng)減少,因此萬年蒿總黃酮提取量不會(huì)隨著功率增加而持續(xù)升高。綜合考慮,選擇超聲波功率300、350、400 W作為后續(xù)正交試驗(yàn)的因素水平。

圖2 料液比對(duì)總黃酮提取量的影響
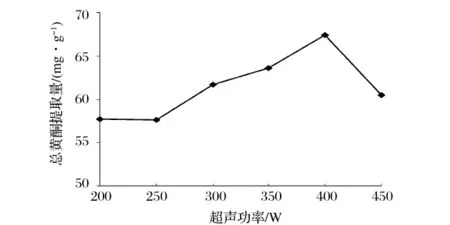
圖3 超聲功率對(duì)總黃酮提取量的影響
3.1.4 超聲時(shí)間對(duì)總黃酮提取量的影響
由圖4可知,當(dāng)以無超聲波處理(0 min)為對(duì)照時(shí),延長超聲波處理時(shí)間總黃酮提取量明顯提高,但超聲波僅在最初的30 min內(nèi)作用顯著,此后隨著提取時(shí)間的延長,總黃酮提取量緩慢增加。對(duì)于這種現(xiàn)象可從兩方面解釋[16],其一,提取溶劑中目標(biāo)化合物的濃度與其溶解性之間的差異性。初始階段,黃酮類化合物在60%乙醇溶液中濃度很低并具有較高的溶解度,故可在短時(shí)間內(nèi)迅速釋放到提取溶劑中;隨著提取時(shí)間的延長,溶劑中黃酮類化合物含量不斷升高,溶液趨于飽和,溶解度降低,總黃酮提取量變化緩慢。其二,由于材料顆粒的完整性,存在于顆粒表面的目標(biāo)物質(zhì)相比于顆粒內(nèi)部的更容易獲得。最初階段,提取溶劑主要溶解樣品顆粒外的黃酮類物質(zhì),故提取量在短時(shí)間內(nèi)迅速增加,此后則主要是存在于材料顆粒內(nèi)部的有效成分依靠濃度差緩慢釋放到溶劑中,所以隨著時(shí)間的延長總黃酮提取量增加并不明顯。綜合以上分析,選取45、60、75 min的超聲時(shí)間作為后續(xù)正交試驗(yàn)因素水平。
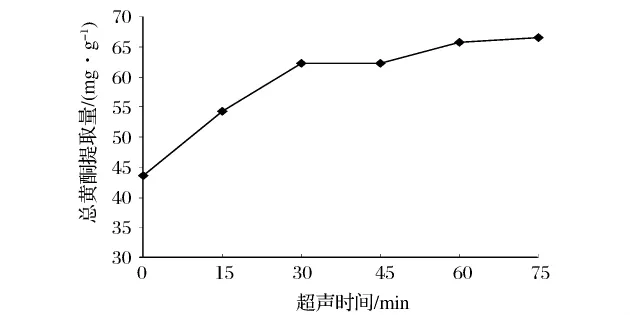
圖4 超聲時(shí)間對(duì)總黃酮提取量的影響
3.2 正交試驗(yàn)設(shè)計(jì)結(jié)果與分析
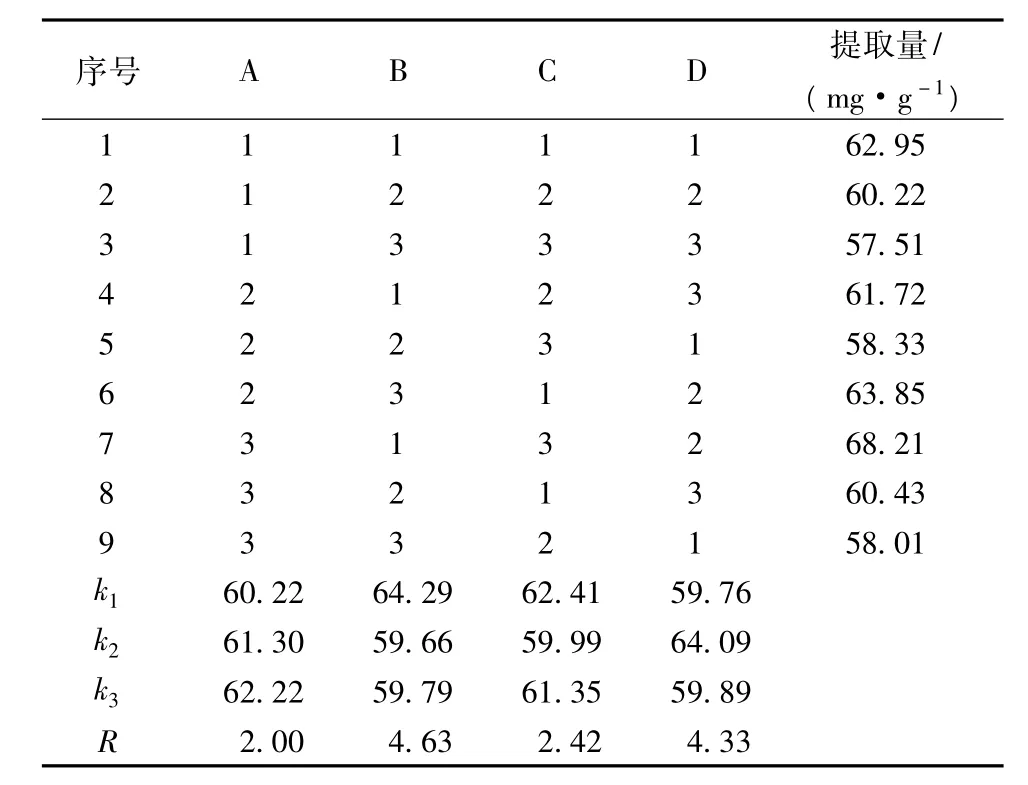
表2 L9(34)正交試驗(yàn)結(jié)果
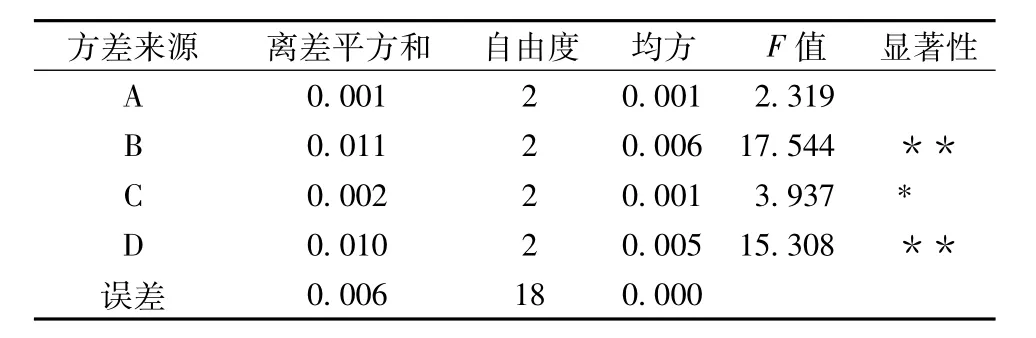
表3 方差分析
由表2分析,各因素對(duì)萬年蒿總黃酮提取量影響從大到小的順序依次為B>D>C>A,即料液比>超聲時(shí)間>超聲波功率>乙醇體積分?jǐn)?shù)。此順序同方差分析結(jié)果一致(見表3)。從方差分析結(jié)果可以看出,料液比和超聲時(shí)間對(duì)總黃酮提取量具有極顯著影響,超聲功率具有顯著影響,而乙醇體積分?jǐn)?shù)則對(duì)萬年蒿總黃酮提取量影響不顯著。由此得出,最佳工藝條件為A3B1C1D2,即乙醇體積分?jǐn)?shù)60%、料液比1∶20、超聲波功率350 W、超聲時(shí)間60 min。但是,最優(yōu)工藝條件不存在正交試驗(yàn)設(shè)計(jì)中,因此,需對(duì)最優(yōu)工藝進(jìn)行進(jìn)一步驗(yàn)證。
3.3 驗(yàn)證實(shí)驗(yàn)
按照上述最佳工藝A3B1C1D2制備3份供試樣液,進(jìn)行工藝驗(yàn)證。結(jié)果測(cè)得總黃酮提取量的平均值為69.55 mg/g,RSD為1.2%,由此證明該工藝穩(wěn)定可行。
3.4 超聲波提取法同傳統(tǒng)提取方法的比較研究
為了合理的評(píng)價(jià)超聲波提取總黃酮的效率,分別將熱回流法和浸漬法同超聲波最優(yōu)提取工藝進(jìn)行比較。如圖5所示,相對(duì)于浸漬提取和熱回流提取,超聲波法獲得的總黃酮提取量最高,達(dá)到69.55 mg/g;盡管常溫條件下浸漬提取最易操作,但是總黃酮提取量很低且耗費(fèi)時(shí)間較長;與常溫浸提相比較,45℃下浸提提取量增加了15.03%,提取率大幅度提高,但仍存在著耗時(shí)耗能等缺點(diǎn);回流時(shí)間由1 h延長到2 h,提取量增加了8.59%,但熱回流提取操作麻煩,耗時(shí)耗能。由此可以得出,超聲波提取優(yōu)于傳統(tǒng)提取的方法,提取時(shí)間短,得率高,操作簡便,是提取萬年蒿總黃酮有效可行的方法。
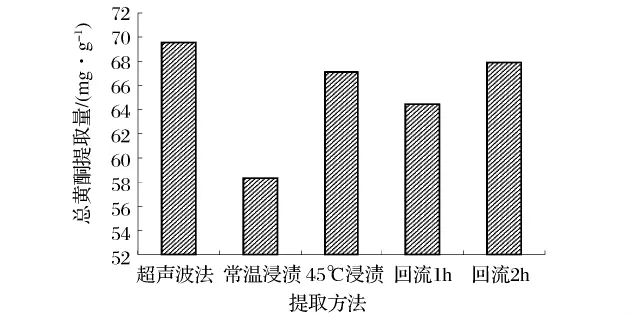
圖5 比較不同提取方法對(duì)總黃酮提取量的影響
4 討論
通過單因素試驗(yàn)和正交試驗(yàn)設(shè)計(jì),本研究確定了超聲波提取萬年蒿總黃酮的最佳工藝為:乙醇體積分?jǐn)?shù)60%、料液比1∶20(g:mL)、超聲波功率350 W、超聲時(shí)間60 min。在此最佳提取工藝條件下,總黃酮提取量達(dá)到69.55 mg/g。經(jīng)驗(yàn)證,該工藝合理有效,穩(wěn)定可行,適合于萬年蒿總黃酮的提取。
除了乙醇體積分?jǐn)?shù)、料液比、超聲功率和提取時(shí)間對(duì)萬年蒿總黃酮的提取有一定影響之外,溫度[18]同樣也是影響超聲波提取總黃酮的重要因素之一。提取過程中,隨著超聲波功率的增加和超聲時(shí)間的延長,提取溫度將不斷上升,因此本試驗(yàn)將超聲波清洗儀同自來水直接連接,通過循環(huán)水的流動(dòng)將溫度控制在(45±1)℃,以降低溫度對(duì)試驗(yàn)的影響。
傳統(tǒng)的浸漬提取和熱回流提取主要依靠一系列的滲透和溶解過程去提取植物材料組織內(nèi)的有效成分[16],故提取效率較低。相對(duì)而言,超聲波提取技術(shù)除了依賴超聲波空化效應(yīng)進(jìn)行有效成分提取外,其乳化、擴(kuò)散、破碎和震蕩等效應(yīng)也會(huì)促進(jìn)有效成分從原材料中快速釋放出來[28]。所以,相比較于熱回流提取和浸漬提取,超聲波提取工藝省時(shí)高效、操作更為簡便,值得進(jìn)一步深入研究。
[1] Merken H M,Beecher G R.Measurement of food flavonoids by high-performance liquid chromatography:a review[J].J Agric Food Chem,2000,48(3):577 -599.
[2] Robards K,Antolovich M.Analytical chemistry of fruit bioflavonoids.A Review[J].Analyst,1997,122(2):11R -34R.
[3] Velickovic D T,Nikolova M T,Ivancheva S V,et al.Extraction of flavonoids from garden(Salvia officinalis L.)and glutinous(Salvia glutinosa L.)sage by ultrasonic and classical maceration[J].J Serb Chem Soc,2007,72(1):73-80.
[4] 師彥平,李瑜,張會(huì)昌.鐵桿蒿化學(xué)成分研究[J].高等學(xué)校化學(xué)學(xué)報(bào),1992,13(10):1258 -1261.
[5] 王宗偉.萬年蒿中綠原酸對(duì)DPPH自由基的清除作用[J].國外醫(yī)學(xué)中醫(yī)中藥分冊(cè),1997,20(2):148-154.
[6] 林有潤.中國植物志[M].北京:科學(xué)出版社,1991:44-46.
[7] Yuan H D,Jin G Z,Piao G C.Hepatoprotective effects of an active part from Artemisia sacrorum Ledeb.against acetaminophen-induced toxicity in mice[J].J Ethnopharmacol,2010,127(2):528 -533.
[8] 戴小軍,劉延慶,梅全喜.蒿屬藥用植物藥理活性研究進(jìn)展[J].中藥材,2005,28(3):243-246.
[9] 李紅梅.萬年蒿抗肝損傷活性部位研究[D].延吉:延邊大學(xué),2008.
[10] 樸光春,權(quán)迎春.萬年蒿提取物對(duì)小鼠肝損傷的保護(hù)作用[J].時(shí)珍國醫(yī)國藥,2007,18(7):1 646-1 647.
[11] 王心喜,金光洙.中藥萬年蒿的化學(xué)成分與藥理作用研究進(jìn)展[J].中藥材,2010,33(5):831-833.
[12] Li H,Chen B,Yao S Z.Application of ultrasonic technique for extracting chlorogenic acid from Eucommia ulmodies Oliv(E.ulmodies)[J].Ultrason Sonochem,2005,12(4):295-300.
[13] Gao M,Liu C Z.Comparison of techniques for the extraction of avonoids from cultured cells of Saussurea medusa Maxim[J].World J Microb Biot,2005,21(8/9):1 461-1 463.
[14] Chen F,Sun Y Z,Zhao G H,et al.Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J].Ultrason Sonochem,2007,14(6):767 -778.
[15] Cravotto G,Boffa L,Mantegna S,et al.Improved extraction of vegetable oils under high-intensity ultrasound and/or microwaves[J].Ultrason Sonochem,2008,15(5):898-902.
[16] Hemwimol S,Pavasant P,Shotipruk A.Ultrasound-assisted extraction of anthraquinones from roots of Morinda citrifolia[J].Ultrason Sonochem,2006,13(6):543 -548.
[17] Mason T J,Paniwnyk L,Lorimer J P.The uses of ultrasound in food technology[J].Ultrason Sonochem,1996,3(3):S253-S260.
[18] Zhang H F,Yang X H,Zhao L D,et al.Ultrasonic-assisted extraction of epimedin C from fresh leaves of Epimedium and extraction mechanism[J].Innov Food Sci Emerg Technol,2009,10(1):54 - 60.
[19] Toma M,Vinatoru M,Paniwnyk L,et al.Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J].Ultrason Sonochem,2001,8(2):137 -142.
[20] Vinatoru M.An overview of the ultrasonically assisted extraction of bioactive principles from herbs[J].Ultrason sonochem,2001,8(3):303 -313.
[21] 王衛(wèi)東,陳復(fù)生.陳皮中黃酮類化合物抗氧化活性的研究[J].中國食品添加劑,2007,59(2):59-62.
[22] Li H Z,Pordesimo L,Weiss J.High intensity ultrasoundassisted extraction of oil from soybeans[J].Food Res Int,2004,37(7):731 -738.
[23] Hemwimon S,Pavasant P,Shotipruk A.Microwave-assisted extraction of antioxidative anthraquinones from roots of Morinda citrifolia[J].Sep Purif Technol,2007,54(1):44-50.
[24] Rostagno M A,Palma M,Barroso C G.Ultrasound-assisted extraction of soy isoyavones[J].J Chromatogr A,2003,1 012(2):119 -128.
[25] 林海祿,彭雪嬌,羅明標(biāo),等.八角茴香中莽草酸超聲提取工藝研究[J].食品科技,2007,32(4):76-78.
[26] 楊瀟,代娟,芮光偉,等.知母中芒果苷的超聲提取工藝研究[J].食品科技,2008,34(3):207-210.
[27] Suslick K S,Casadonte D J,Green M L H,et al.Effects of high intensity ultrasound on inorganic solids[J].Ultrasonics,1987,25(1):56 -59.
[28] Roldán-Gutiérrez J M,Ruiz-Jiménez J,Luque-de-Castro M D.Ultrasound-assisted dynamic extraction of valuable compounds from aromatic plants and flowers as compared with steam distillation and superheated liquid extraction[J].Talanta,2008,75(5):1 369 -1 375.
Optimization of Ultrasonic Extraction Processes of Total Flavonoids from Artemisia sacrorum Ledeb.
Huang Jing,Hao Wen-fang
(College of Life Science,Northwest A&F University,Yangling 712100,China)
Artemisia sacrorum Ledeb.was extracted by ultrasound and the processing was optimized.The influence of four extraction variables on extraction yields of total flavonoids was investigated,including ethanol concentration,the ratio of material to solvent,ultrasonic power and time.Based on the results of our investigations,orthogonal test design L9(34)was used to optimize the extraction yields.In addition,heat reflux and maceration were also employed to compare with ultrasonic extraction processes.The results indicated that the optimum ultrasonic extraction conditions were as follows:ethanol concentration 60%(v/v),the ratio of material to solvent 1∶20(w/v),ultrasonic power 350 W,time 60 min.Under the above conditions,the total?avonoids yields could arrive 69.55 mg·g-1.Meanwhile,the optimized ultrasonic extraction processes was stable and feasible.In addition,it had several remarkable advantages,including time saving,high efficiency and easier-operation.
Artemisia sacrorum Ledeb.,ultrasonic extraction,total avonoids,extraction processes,orthogonal test design
碩士研究生(郝文芳教授為通訊作者,E-mail:haowenfang@nwsuaf.edu.com)。
*中國科學(xué)院“西部之光”人才培養(yǎng)項(xiàng)目(2008DF02)
2011-09-09,改回日期:2011-11-22

