比色法測定不同產地黑豆皮中花青素含量
張澤生,林紀偉,2,王志平,於洪建,劉岱琳
(1.天津科技大學食品工程與生物技術學院,天津 300457;2.中國人民武裝警察部隊醫學院生藥教研室,天津 300162;3.鄭州人民醫院藥劑科,河南 鄭州 450012;4.天津市尖峰天然產物研究開發有限公司,天津 300457)
黑豆是我國一種傳統種植的農作物,其具有悠久的食用和藥用歷史,自古以來民間就有用黑大豆補血、活血和烏發養顏的記載。黑豆皮,又稱烏衣,富含大量花青素,主要以飛燕草素、矢車菊素為主[1],具有抗氧化活性[2]、抑制誘變[3-4]、抗炎[5]、預防癌癥以及延緩衰老等多種保健功效[6],一直是天然食用添加劑和健康保健食品的原料。
我國是農業大國,從南到北很多省份都種植黑豆,資源豐富,可謂世界各國之首[6]。在我國的北方,如天津市、河北省、山東省都有豐富的黑豆產量,但是由于產地不同,黑豆皮中的功效成分差異較大,因此本文在文獻工作基礎上,利用比色法測定不同產地黑豆皮中花青素的含量,從而進一步控制黑豆皮的質量,為其在食品添加劑和保健食品中的應用提供參考。
1 材料與方法
1.1 材料、試劑和儀器設備
1.1.1 材料
黑豆皮原料:黃仁黑豆皮,產自湖北;青仁黑豆皮,產至東北,青扁黑豆皮,產自安徽;市售黑豆皮,產自山東濱州;內蒙黑豆皮,產自內蒙古。所有試驗黑豆皮原料由天津市尖峰天然產物研究開發有限公司提供。
1.1.2 試劑
飛燕草素標準品:挪威Polyphenols公司;無水乙醇、甲醇:均為分析純,天津康科德化工有限公司;鹽酸:天津大茂化工有限公司。
1.1.3 儀器設備
UV-2401PC:日本島津公司;HZQ-QX型電動振蕩機:東聯電子技術開發有限公司。
1.2 方法
1.2.1 檢測波長的確定
用1%鹽酸甲醇溶液配制少量黑豆皮提取液,用UV-2401PC紫外可見分光光度計200 nm~600 nm的范圍內對色素進行掃描,得黑豆皮提取液的吸附光譜圖。同時對標準品溶液在200 nm~600 nm的范圍內進行掃描,得到飛燕草素標準品溶液的吸附光譜圖。
1.2.2 標準曲線的測定
1.2.2.1 標準溶液的配制
精密稱取飛燕草素對照品適量,用1%鹽酸甲醇溶液溶解,定容在100 mL容量瓶中,配制成85.211μg/mL的標準品儲備液,備用。
1.2.2.2 標準曲線的測定
分別精密吸取 2、4、6、8、10 mL 標準品儲備液轉移至100 mL容量瓶中,用1%鹽酸甲醇溶液稀釋并且定容至刻度。在520 nm下測定吸光度,測定標準曲線。
1.2.3 黑豆皮提取物樣品溶液的配制
準確稱取黑豆皮原料5 g加入浸提液浸泡過夜,過濾,測定其體積為V。精密吸取1 mL樣品浸提液,置1000 mL棕色容量瓶中,用1%的鹽酸甲醇定容到刻度,以同批1%鹽酸甲醇溶液作空白,置520 nm處測定其吸收度。花青素含量利用1.2.2.2中的標準曲線進行測定。
1.2.4 黑豆皮中花青素提取條件優化
1.2.4.1 提取溶劑的選擇
準確稱取黑豆皮5 g,共4份,分別置于100 mL三角瓶中,分別加入甲醇、95%乙醇,1%鹽酸甲醇50 mL和1%鹽酸乙醇各50 mL,浸提8 h。按照1.2.3項下配制方法進行樣品制備,測量其吸光度。通過對甲醇、95%乙醇、含有體積比例為1%鹽酸的甲醇溶液和95%乙醇溶液進行考察,確定最佳提取溶劑。
1.2.4.2 提取溶液鹽酸用量的選擇
準確稱取黑豆皮5 g,共5份,分別置于100 mL三角瓶中。分別加入甲醇50 mL、0.5%鹽酸甲醇溶液(體積分數)50 mL、1%鹽酸甲醇溶液(體積分數)50 mL、1.5%鹽酸甲醇溶液(體積分數)50 mL、2%鹽酸甲醇溶液(體積分數)50 mL,浸提8 h。按照1.2.3項下配制方法進行樣品制備測量其吸光度。
1.2.4.3 提取時間的選擇
準確稱取黑豆皮5 g,共6份,分別置于100 mL三角瓶中,精密加入1%鹽酸甲醇50 mL。6份樣品,密封狀態下進行提取,提取時間分別為 1、2、4、6、8、10 h。然后按照1.2.3項下配制方法進行樣品制備,測量其吸光度。
1.2.4.4 料液比的選擇
準確稱取黑豆皮5 g,共5份,分別置于100 mL三角瓶中。分別加入 1%鹽酸甲醇 10、25、50、75、100 mL。密閉狀態下進行浸提8 h。然后按照1.2.3項下配制方法進行樣品制備,測量其吸光度。
1.2.5 加樣回收率的測定
精密稱取已知含量的供試品原料5 g,準確加入與供試品中花青素含量相同的飛燕草素對照品,按照1.2.4中確定的提取方法進行提取,按1.2.3項下確定的方法準確測定,計算平均回收率。
1.3 樣品的含量測定
分別準確稱取不同產地的黑豆皮5 g,按照1.2項下確定的最優提取方法進行提取,按照1.2項下的含量測定方法進行含量測定。每個產地的黑豆皮平行測定3次。
2 試驗結果
2.1 檢測波長的確定
圖1a是黑豆皮提取物在1%鹽酸甲醇溶液中的吸收光譜,從光譜中可以看出黑豆皮提取物分別在520、362、279、205 nm 處有吸收峰,而 520 nm 為花青素類色素的特征吸收峰。圖1b是標準品飛燕草素在1%鹽酸甲醇溶液中的吸收光譜,從光譜中可以發現其在520、360、280 nm處有吸收峰,綜合分析后,選擇520 nm作為黑豆皮提取物中花青素吸收度的檢測波長。
2.2 標準曲線的測定及方法學考察
2.2.1 標準曲線的測定
按照1.2.2.2項下方法進行測定,結果如圖2所示。
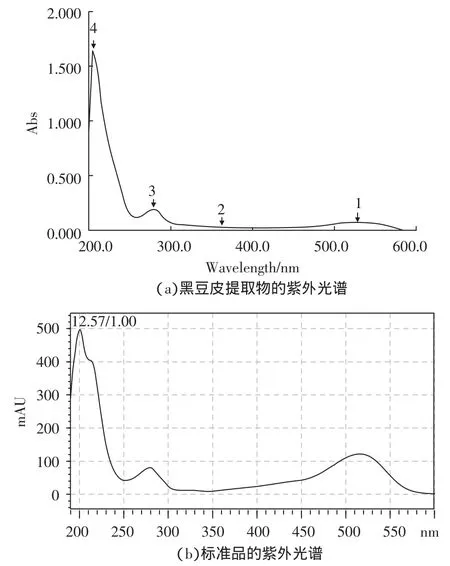
圖1 黑豆皮提取物和標準品的紫外吸收圖譜Fig.1 The UV spectrum of Black Soya Bean Extract and delphinidin
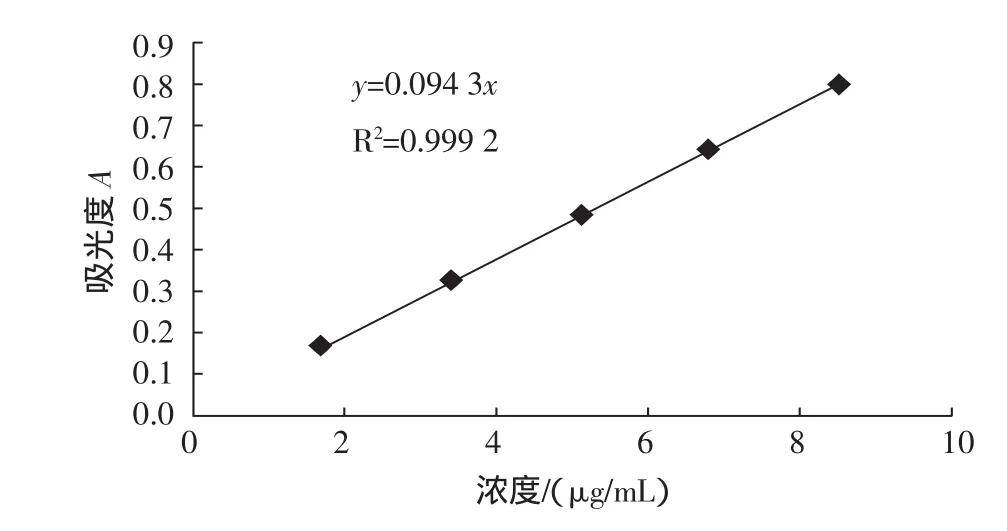
圖2 標準曲線的測定Fig.2 Detection of linear curve
標準曲線為A=0.0943x,(x表示為測試溶液的濃度,單位為 μg/mL),r=0.9996(n=5),該標準曲線在濃度為1.7μg/mL~8.5μg/mL的范圍內線性良好。
2.2.2 精密度的測定
吸取標準品溶液1 mL,按1.2.2.2項下的方法進行精密度測定,RSD=0.21%(n=6),本方法的精密度良好。
2.2.3 穩定性的測定
吸取供試品溶液 1 mL,分別在 2、4、6、8、10 h 后測定吸光度值。試驗結果表明:在0~10 h內穩定性良好,RSD=0.23%。
2.2.4 重現性試驗
準確稱取同一產地的黑豆皮5份,每份5 g。按1.2.4項下確定的方法進行提取,再按1.2.3項下方法進測定,實驗結果顯示,該方法重現性良好,RSD為0.74%(n=5)。
2.3 黑豆皮中花青素提取條件優化
2.3.1 提取溶劑的選擇
不同溶劑的浸提結果見表1。

表1 不同溶劑的浸提結果Table 1 Extraction using different solution
表1測試結果顯示采用1%的鹽酸甲醇溶液作為提取溶劑時,吸光度最高,說明具有很好的提取效果。因此本試驗采用1%的鹽酸甲醇作為提取溶劑。
2.3.2 提取溶劑酸度選擇
不同鹽酸濃度的浸提結果見表2。
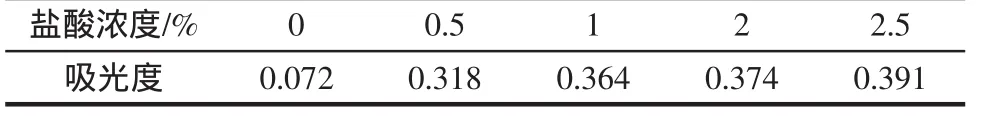
表2 不同鹽酸濃度的浸提結果Table 2 Extraction using different content HCl
測試結果如表2,在相同提取時間條件下,隨著鹽酸濃度的增加,測試溶液的吸光度值也在增高。說明酸度的增加會提高提取收率。但是從1%~2.5%的酸度變化,提取溶液的吸光度值增加并不明顯,因此確定提取溶液鹽酸濃度為1%。
2.3.3 提取時間的選擇
不同時間的浸提結果見表3。

表3 不同時間的浸提結果Table 3 Extraction using different time
如表3所示,浸提時間達到8 h時,吸光度值達到最高,而且隨著提取時間的增加,吸光度值達到穩定。因而確定浸提時間為8 h。
2.3.4 料液比的選擇
不同料液比的浸提結果見表4。

表4 不同料液比的浸提結果Table 4 Extraction using different volume solution
通過對不同料液比的考察,結果如表4所示,料液比為1∶10時,吸光度值達到最高,因而確定最佳料液比為 1∶10。
2.4 加樣回收率的測定
按照1.2.5項下確定的方法準確測定,平均回收率為 98.34%,RSD=2.32%(n=5)。
2.5 不同產地黑豆皮中花青素的含量
按照1.2.4項下確定的提取方法進行含量測定,結果如表5所示。分析結果如表5所示,市售的黑豆皮其花青素含量相對較低,而安徽產的青扁黑豆皮花青素含量相對較高。

表5 不同產地黑豆皮中花青素的含量測定Table 5 Detection of anthocyanidin of black soybean from different varied area
3 小結與結論
1)對國內不同產地的黑豆皮原料進行了花青素含量測定,測試結果顯示不同產地的黑豆皮原料中花青素的含量差異較大,品種之間以安徽產的青扁黑豆皮花青素含量相對較高,雖然市售黑豆皮的含量相對較低。
2)本文利用紫外分光光度法測定不同區域的黑豆皮中花青素的含量,該方法簡便,快速,結果準確,可靠,適于黑豆皮中花青素成分的質量控制。
[1]JINHL,KANGNS,SHINSO,et al.Characterisation of anthocyanins in the black soybean (Glycine max L.)by HPLC-DAD-ESI/MS analysis[J].Food Chemistry,2009,112:226-231
[2]ASTADI I R,ASTUTI M,SANTOSO U,et al.In vitro antioxidant activity of anthocyanins of black soybean seed coat in human low density lipoprotein(LDL)[J].Food chemistry,2009,112:659-663
[3]WANG Yen-ju,SHEEN Leen-yan,CHOU Cheng-chun,et al.Storage effects on the content of anthocyanin,mutagenicity and antimu-tagenicity of black soybean koji[J].LWT-Food science and technology,2010,43:702-707
[4]HUANG Yu-hsiang,HUANG Hui-yu,CHOU Cheng-chun,et al.Mutagenic and antimutagenic effects of methanol extracts of unfermented and fermented black soybeans[J].International journal of food microbiology,2007,118:62-68
[5]Nizamutdinwa I T,Kim Y M,Chung I,et al.Anthocyanins from black soybean seed coats stimulate wound healing in fibroblasts and keratinocytes and prevent inflammation in endothelial cells[J].Food and chemical toxicology,2009,47:2806-2812
[6]李瑩,張亮,劉志玲,等.黑豆種植與加工利用[M].北京:金盾出版社,2006:5-8

