酸解玉米芯制備木糖及其提純工藝的研究
郭仁杰,孫婉,趙靈希,熊海容
(中南民族大學生命科學學院,湖北 武漢 430074)
酸解玉米芯制備木糖及其提純工藝的研究
郭仁杰,孫婉,趙靈希,熊海容*
(中南民族大學生命科學學院,湖北 武漢 430074)
探討玉米芯的酸解工藝及木糖的純化過程。玉米芯經1%NaOH 60℃預處理24 h后,最優酸解條件為硫酸濃度1.5%,料水比1∶13(g/mL),反應時間3 h。溶液經活性炭脫色和樹脂去離子,由釀酒酵母As2.541去除木糖母液中的葡萄糖,純化后的糖液經薄層層析(TLC)鑒定其單糖種類,3-5二硝基水楊酸法(DNS)測定還原糖總量,高效液相法(HPLC)做糖液的定量分析,最后將糖液濃縮醇沉,制備木糖結晶率為1.5%,純度為90%。
玉米芯;木糖;酸解;純化
木糖為白色細針狀結晶或結晶性粉末。它常被用作無熱量的甜味劑,以滿足糖尿病患者和愛吃甜食卻又擔心發胖者的需求。木糖不會被口腔內的細菌利用,可以防齲齒。除此之外,木糖還具備膳食纖維的部分生理功能,有降血脂、降低糖固醇及預防腸癌等作用[1]。
自然界中的木糖通常以大分子的木聚糖形式廣泛存在于植物半纖維素中,目前,工業上通常采用酸解法制備木糖。在各種原料中,玉米芯的多縮戊糖含量最高,而且在我國,玉米芯來源廣泛、產量大、易集中。所以,綜合各種因素利用玉米芯酸解法制備木糖有顯著的社會效益和經濟價值[2-4]。
玉米芯水解的過程中會有多種雜質產生,去除雜質,不但可以加快水解的反應速率,同時可以純化木糖結晶[2]。
釀酒酵母屬于兼性厭氧菌,在有氧的情況下,它把葡萄糖分解成二氧化碳和水;在缺氧的情況下,釀酒酵母把葡萄糖分解成酒精和二氧化碳。釀酒酵母代謝過程消耗葡萄糖,但不利用木糖。而玉米芯酸解的木糖母液中,含有少量葡萄糖。利用釀酒酵母的特性,通過酵母發酵法,消耗掉木糖母液中的葡萄糖,可以提高木糖的純度[5]。
TLC法是快速分離和定性分析少量物質的一種實驗技術,利用不同的糖其分子量、羥基數目及其醛基、酮基性質存在的差異,可以將不同種類的糖分離開來。DNS法可用于檢測木糖母液中總還原糖含量。HPLC是一種快速準確的含量測定方法,根據不同糖的保留時間、峰面積等,可準確測得木糖母液中各組分糖的含量,是目前普遍應用的檢測方法之一。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與主要試劑
釀酒酵母Saccharomyces cerevisiae As2.541:從湖北工業大學生物工程學院張華山教授實驗室獲得;玉米芯粉:購于湖北武漢,去雜后烘干粉碎,過80目篩,粉末備用。
YPD液體培養基:葡萄糖2 g,酵母浸粉1 g,蛋白胨2 g,H2O 100 mL。
3-5二硝基水楊酸(DNS):6.3 g DNS,加262 mL 2 mol/LNaOH,加入500 mL含有182 g酒石酸鉀鈉熱水溶液再加入5 g重蒸酚和5 g亞硫酸鈉,攪拌溶解,冷卻后加水定容至1 L,避光備用[4]。
甲基紅和亞甲基藍混合指示劑:將甲基紅乙醇溶液(1 g/L)與亞甲基藍乙醇溶液(1 g/L)按2∶1的體積比混合。
HPLC所用乙腈為sigma色譜純,水為去離子水,其余藥品均為國藥準字分析純。
1.1.2 儀器
高效液相色譜儀:日本島津;真空冷凍干燥機:北京博醫康;AVANTI J-E高速離心機:BECK MAN COULTER;臥式滅菌器:上海華線醫用核子;PGF-4AB型立式電熱鼓風干燥箱:天津市泰斯特;752型紫外可見分光光度計:上海光譜儀器,等。
1.2 方法
1.2.1 玉米芯預處理
玉米芯中含有的少量蛋白質,在木糖制備過程中會影響木糖的產率,使用2種方法對玉米芯進行預處理,在清洗原材料的同時,可以降低蛋白質的含量,再檢測處理后玉米芯中蛋白的含量變化,選擇蛋白含量低的作為玉米芯的預處理方法。
取玉米芯粉2 g,加硫酸鉀6 g,硫酸銅0.2 g,濃硫酸20 mL于500 mL定氮瓶中,瓶口加漏斗,傾斜置于電爐上,微火加熱約4 h,待溶液呈藍綠色且完全澄清后,再加熱1 h,加熱后的溶液冷卻至室溫,移至100 mL容量瓶中定容,用0.05 mol/L鹽酸標準液滴定,甲基紅和亞甲基藍混合指示劑檢測,同時做試劑空白試驗[6]。
1)向玉米芯粉中加入蒸餾水[料水比1∶15(g/mL)],攪拌均勻,100℃煮沸30 min,紗布過濾,烘干,取2 g,同上,凱氏定氮法檢測其蛋白質含量。
2)向玉米芯粉中加入1%NaOH[料水比1∶15(g/mL)]60℃水浴24 h,紗布過濾,蒸餾水洗至中性,烘干,取2 g,同上,凱氏定氮法檢測其蛋白質含量。
1.2.2 優化玉米芯酸解條件[7-8]
1.2.2.1 標準曲線的測定
精確稱取20 mg木糖到100 mL容量瓶中,充分溶解后定容至100 mL,制成木糖標準溶液。取8支干凈具塞試管,分別從1至8標記,管中依次加入木糖標準液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,相應加水2、1.8、1.6、1.4、1.2、1、0.8、0.6 mL。再加入3 mL DNS,混勻后煮沸5 min。冷卻至室溫,以1號試管為參比,測定在540 nm時各試管中溶液吸光度。以木糖為X(mL)軸,對吸光度Y作圖,得出木糖與吸光值之間關聯的標準曲線[2-3]。
1.2.2.2 最適料水比的測定
取玉米芯40 g,將玉米芯粉與1.5%的稀硫酸按1∶7,1∶9,1∶11,1∶13,1∶15比例(g/mL),加到錐形瓶中,121℃,處理3 h。冷卻至室溫,抽濾,取上清液,碳酸鈣中和后,再抽濾,活性炭脫色,DNS法檢測還原糖含量,每個樣品做3個平行。
1.2.2.3 最適反應時間的測定
取40g玉米芯粉,加入1.5%的稀硫酸520mL,121℃,分別加熱2、3、4、5 h。冷卻至室溫,抽濾,取上清液,碳酸鈣中和后,再抽濾,活性炭脫色,DNS法檢測還原糖含量[9],每個樣品做3個平行。
1.2.2.4 最適硫酸濃度的測定
取玉米芯40 g,分別加1.5%、2.0%、3.0%、4.0%硫酸520 mL,121 ℃,加熱3 h,冷卻至室溫,抽濾,取上清液,碳酸鈣中和后,再抽濾,活性炭脫色,DNS法檢測還原糖含量,每個樣品做3個平行。
1.2.3 木糖母液的脫色及離子交換
1.2.3.1 活性炭脫色
在中和后的玉米芯酸解液中加入活性炭適量,加好后攪拌混勻,將混合液加熱至80℃,真空抽濾[10]。
1.2.3.2 離子交換樹脂對離子的去除
在玉米芯酸解的制備過程中,有部分離子雜質殘留,離子交換樹脂可以去除木糖母液中部分離子。采用001×12(強酸性苯乙烯樹脂磺酸鈉陽離子交換樹脂)為陽離子樹脂,AH-1(三聚氰胺-胍-甲醛樹脂縮合弱堿性陰離子交換樹脂)為陰離子樹脂。去離子水膨脹24 h后,再水洗呈中性,分別裝入100 mL層析柱,再生(陽柱用100 mL,2.5%H2SO4沖洗2 h,陰離子柱用100 mL,4.5%Na2CO3沖洗2 h),用恒流泵控制流速穩定,再生完成后將樹脂水洗至中性,將活性炭脫色后的木糖母液與樹脂進行置換反應,先過陽柱再過陰柱,控制木糖母液通過樹脂柱流速為1 mL/min。用氯化鋇,草酸,亞鐵氰化鉀做指示劑檢測過柱前后溶液中Ca2+,Fe3+,SO42-離子含量的變化[2,11]。
1.2.4 木糖母液分析方法的比較
1.1.4.1 DNS法檢測樣品中還原糖含量[12]
先將樣品做梯度稀釋,選擇樣品最佳稀釋倍數。取1 mL稀釋后樣品,加入1 mL水,3 mL DNS,混勻后沸水中加熱5 min,冷卻至室溫,測波長為540 nm時的吸光度。取2 mL水,加3 mL DNS同上操作,作為參比。
1.2.4.2 TLC法檢測樣品中單糖的種類[13]
配制葡萄糖,木糖,蔗糖標準品溶液1 mL,濃度為10 mg/mL,取制備好的木糖母液1 mL,備用。
將G254硅膠板置于烘箱中烘干,備用。配制顯色劑為苯胺(2 mL)-二苯胺(2 g)-磷酸(10 mL,85%)-濃鹽酸(1 mL)-丙酮(100 mL);展開劑為正丁醇∶乙酸∶水=4∶1∶5(體積比)。將糖液標準品和木糖母液用毛細管點樣2 μL于硅膠板上,放入展缸中,待展開劑前沿距板頂1 cm時取出,烘干,再用噴霧器將顯色劑均勻噴于板上,烘干后,顯色。
1.2.4.3 HPLC對樣品的檢測
色譜條件的確定:色譜柱為Agilent ZORBAX Carbohydrate 4.6×250 mm 5Micron,檢測器為示差檢測器,流動相為乙腈∶水=65∶35(體積比),流速設定為1 mL/min,柱溫20℃。乙腈為色譜純,水為去離子水。
木糖,葡萄糖標準曲線的制備:將木糖,葡萄糖分別配置成100 mg/mL的標準品溶液,在分別稀釋成濃度1、10、20、30、40 mg/mL的木糖,葡萄糖標準溶液,每種濃度的標準品溶液取20 μL進樣檢測,以糖濃度為X軸,峰面積為Y軸,作標準曲線。
木糖母液檢測:木糖母液10000 r,離心5 min,取上清,用0.22μm的水系濾膜過濾,濾液在同上的色譜條件下,取20 μL,進樣檢測,記錄保留時間和峰面積。
1.2.5 釀酒酵母去除葡萄糖[14-15]
釀酒酵母的擴大培養:制備YPD液體培養基400mL,滅菌后,在無菌操作臺上將釀酒酵母接入YPD液體培養基,28℃,搖床培養3 d。
1.2.5.1 釀酒酵母對標準品混合液中葡萄糖的消耗
精確稱取木糖4 g,葡萄糖2 g,與100 mL容量瓶中,加水混勻后,定溶至刻度。為葡萄糖,木糖標準品的混合溶液,葡萄糖濃度2%,木糖濃度4%。再將活化好的釀酒酵母,加入離心管,12000 r,離心10 min,取釀酒酵母沉淀2 g,加入葡萄糖和木糖的標準品混合液100 mL,28℃,分別培養1、6、12、24 h,每時間段取混合液10 mL,高效液相檢測溶液中各種糖含量的變化。
1.2.5.2 釀酒酵母對木糖母液中葡萄糖的消耗
取木糖母液100 mL,同上將酵母離心后,加釀酒酵母沉淀1 g,28 ℃,分別培養1、2、3 h,每時間段取混合液10 mL,高效液相檢測溶液中各種糖含量變化。
1.2.6 木糖的結晶制備[16]
將處理后的木糖母液置于烘箱中,70℃制備成濃縮糖液,0.22μm濾膜抽濾,濾液按1∶10(體積比)的比例加入乙醇,靜置沉淀,再次抽濾,沉淀物冷凍干燥。將冷凍干燥后的木糖溶水,重結晶[17]。晶體烘干至恒重,取樣品配制成20 mg/mL的溶液,高效液相法檢測其峰面積,通過標準品的線性方程,算得木糖結晶的純度。
2 結果與討論
2.1 玉米芯預處理
用蒸餾水、堿對玉米芯預處理后,玉米芯中蛋白質含量的變化,見表1。

表 1 玉米芯中蛋白質含量Table 1 Protein content of corncob %
在酸水解條件下,蛋白質通常會發生水解生成氨基酸。這些游離氨基酸將會與酸解玉米芯后產生的單糖發生顏色反應,導致單糖產量的降低并增加了木糖提純的困難程度。為了避免蛋白質對后續工藝的影響,探討了不同的預處理方法,在玉米芯粉中加入蒸餾水,100℃下處理30 min。或將玉米芯粉用稀NaOH溶液60℃下處理24 h。預處理完成后,檢測并比較2種方法對蛋白去除的影響。
由表1可知,玉米芯中原蛋白質的含量為2.255%,蒸餾水處理以后,蛋白質含量有所下降,但蛋白去除效果不明顯,相比之下用NaOH處理后,玉米芯中的蛋白質含量降至0.988%,所以,堿處理作為玉米芯預處理的較好方法。
2.2 玉米芯酸解條件的優化
用DNS法檢測,以木糖濃度為X軸(mL),吸光度為Y軸,得線性回歸方程 y=0.7907x-0.3175(R2=0.9995)。在不同玉米芯與硫酸的料水比、反應時間、硫酸濃度條件下,觀察還原糖產量的變化,見圖1。注:A為料水比與還原糖產量間的關系;B為加熱時間與還原糖產量間的關系;C為酸濃度與還原糖產量間的關系。

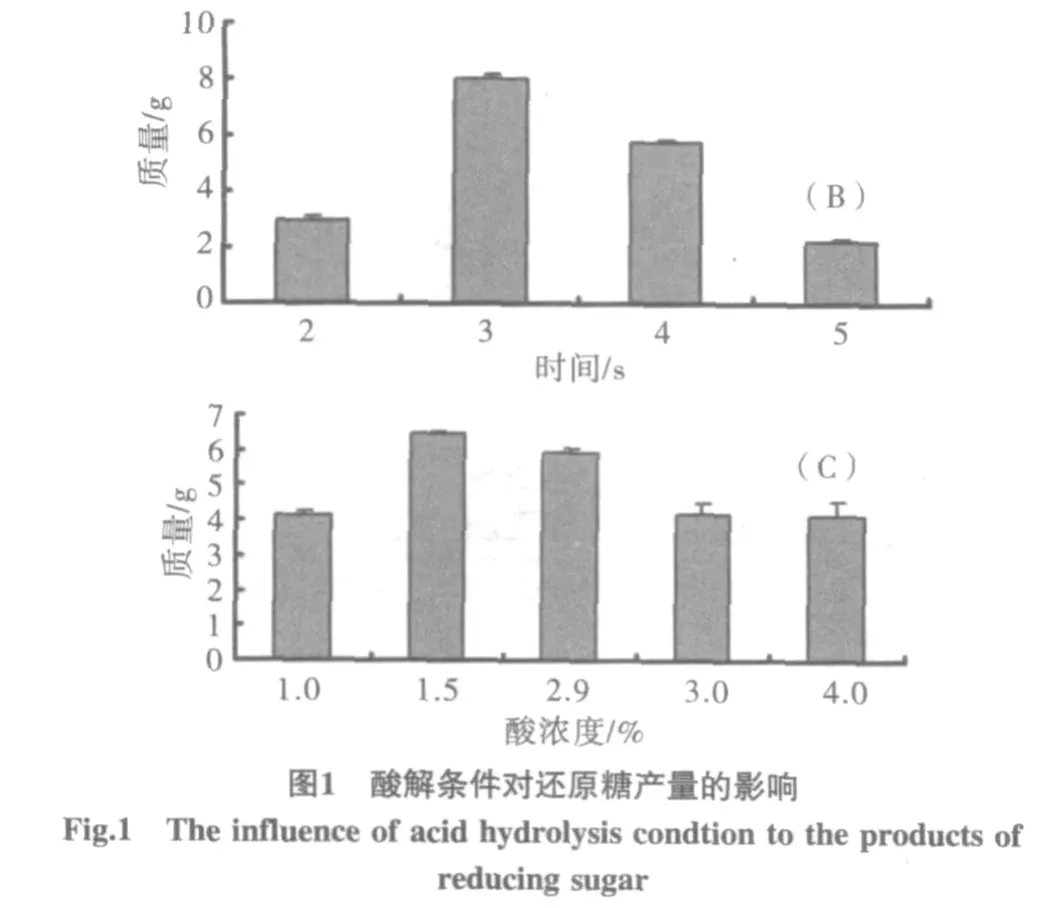
玉米芯中含有的多聚戊糖,在硫酸的作用下可降解得到木糖溶液,而木糖的產率與加熱時間,酸濃度及玉米芯與硫酸的料水比都呈一定的線性關系。由圖1的結果可得出,隨著反應條件改變,木糖的產率起初隨之增加,在反應時間3h,硫酸濃度1.5%,料水比1∶13(g/mL)時,木糖產率為最高。而隨后產率所出現的回落,可能是由于玉米芯酸解時間的加長,硫酸濃度和體積的增加,使木糖在高溫下與溶液中的雜質發生反應,從而降低了木糖的產率。
2.3 木糖母液的脫色及離子交換
活性炭脫色:選用分析純活性炭脫色,每100 mL木糖母液加入活性炭約5 g,80℃下活性炭將樣品由深褐色脫為無色,效果顯著。
離子交換樹脂去離子:選擇001×12陽離子樹脂去除Ca2+、Fe3+,AH-1陰離子樹脂去除SO42-。木糖母液過柱前,分別加草酸、氯化鋇結果均有沉淀生成,加入亞鐵氰化鉀后有淺藍色沉淀生成。過柱后,加入草酸無沉淀生成,表明溶液中Ca2+已去除,加入氯化鋇無沉淀生成,表明溶液中不含SO42-,加入亞鐵氰化鉀后無沉淀,表明Fe3+被去除。檢測結果顯示100 mL陽離子柱對于木糖母液的工作容量為60 mL,100 mL陰離子柱對木糖母液工作容量為45 mL。
2.4 木糖產率的分析方法比較
2.4.1 DNS檢測
經試驗證明,用DNS檢測木糖母液中還原糖含量,100倍為最佳稀釋倍數,稀釋后的木糖母液在540 nm處吸光度為0.745,代入DNS法木糖的線性方程得母液中還原糖濃度為26.87 mg/mL。
2.4.2 TLC檢測
木糖母液和標準糖的薄層層析圖譜見圖2。
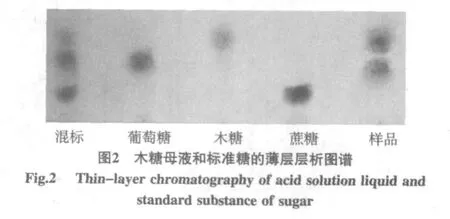
由圖2可知,使用苯胺(2 mL)-二苯胺(2 g)-磷酸(10 mL,85%)-濃鹽酸(1 mL)-丙酮(100 mL)為顯色劑后,葡萄糖顯淺藍色,木糖顯黃色,蔗糖顯深藍色,樣品經展開劑正丁醇∶乙酸∶水=4∶1∶5(體積比)展開分為2層,且上層為黃色,下層為淺藍色,再結合標準品和樣品在硅膠板上的分離距離,可以確定木糖母液中所含的糖為葡萄糖和木糖。
2.4.3 HPLC檢測[8]
在最佳反應條件下酸解玉米芯,木糖母液經HPLC檢測后各組分及含量見圖4(A),圖4(A)中木糖峰面積為2530393.9,葡萄糖的峰面積為758528.9,代入木糖和葡萄糖的線性方程得到,木糖母液中木糖濃度為20.34 mg/mL,葡萄糖濃度為5.69 mg/mL。
綜合3種檢測方法結果可知,薄層層析可以快速方便的檢測出樣品中所含糖的種類,但不能準確的檢測出各種糖的含量,所以只能對樣品做定性的分析。DNS法是利用還原糖對特定波長光的吸收來測定樣品的含糖量,但樣品中還原糖除了木糖還有葡萄糖,所以檢測結果會比木糖母液中木糖的實際含量要多。高效液相是比較常用也是最為精確的檢測樣品的方法,根據出峰時間和峰面積的大小可以準確的得到樣品中糖的種類及各種糖的含量。
2.5 釀酒酵母去除葡萄糖
2.5.1 釀酒酵母對混合液標準品中葡萄糖的消耗
由于木糖和葡萄糖的物理、化學性質相近,采用一般方法從木糖葡萄糖混合物中分離獲得木糖的大生產工藝操作難度較大。相比之下,利用一些只代謝葡萄糖不代謝木糖的特定微生物預先消耗掉葡萄糖,不但去除效果明顯,而且操作簡便,適用于工業生產。將釀酒酵母加入木糖和葡萄糖標準品混合液后,標準品中2種糖含量的變化見圖3。
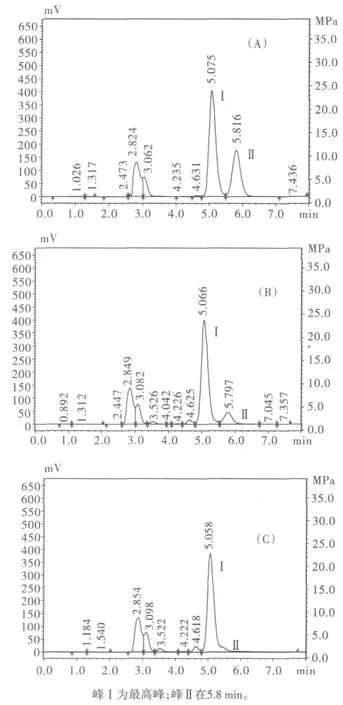
圖3 釀酒酵母對木糖葡萄糖標準品混合物中葡萄糖的消耗Fig.3 Glucose consumption in the mixture of standard xyloseand glucose
由圖3的實驗結果可得出,木糖保留時間約為5.0min,葡萄糖的保留時間約為5.8 min。當標準糖液中葡萄糖的濃度為20 mg/mL,體積100 mL時,2 g釀酒酵母在12 h內可以將標準液中的2 g葡萄糖完全消耗,同時不影響標準液中木糖的含量。
2.5.2 釀酒酵母對樣品中葡萄糖的消耗
將釀酒酵母加入木糖母液后,隨著代謝時間的增加,木糖母液中葡萄糖,木糖含量的變化見圖4。

圖4 釀酒酵母對樣品中葡萄糖的消耗趨勢Fig.4 The consumption trend of glucose in sample bySaccharomyces cerevisiae
由圖4的實驗結果可看出,當木糖母液中葡萄糖含量約為5 mg/mL時,每100 mL母液,加釀酒酵母1 g,3 h后溶液中葡萄糖消耗完全,且木糖無損失。說明活化后的釀酒酵母在不消耗木糖的情況下,可有效去除木糖母液中的葡萄糖,提高木糖純度。
2.6 木糖結晶的制備
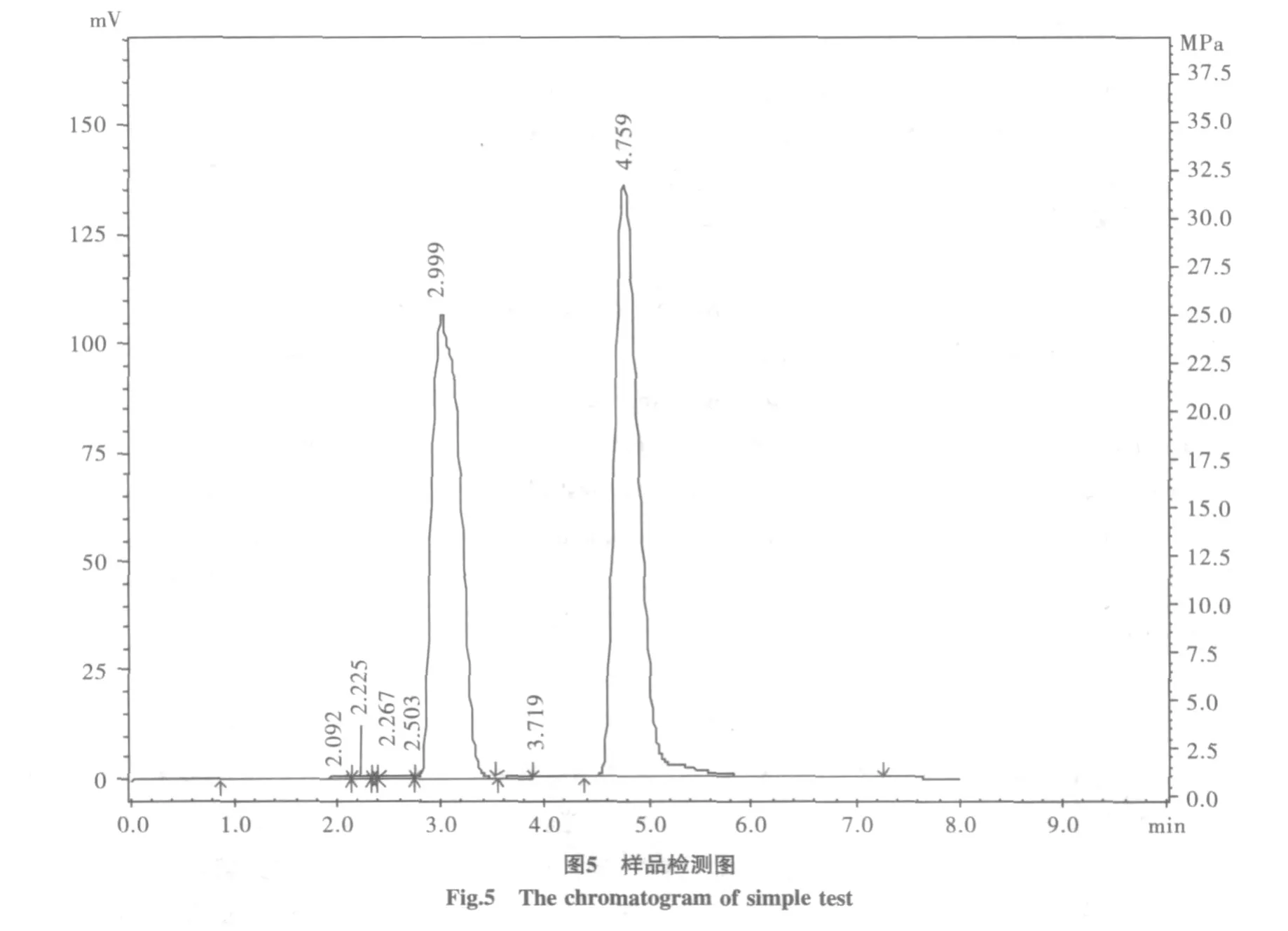
糖液濃縮過程會有少量雜質析出,木糖常溫下不溶于乙醇,用乙醇沖洗結晶,可以將某些溶于乙醇的有機雜質去除,最終制備的木糖結晶產率為每100克玉米芯粉產木糖1.5 g。高效液相檢測,結晶溶解為20 mg/mL的木糖溶液,峰面積為2263928.0,結晶純度90%(圖5)。
3 結論
根據以上研究結果表明,堿處理玉米芯,可將玉米芯中的蛋白含量降至0.988%,玉米芯最佳酸解條件為1.5%硫酸,作用時間3 h,料水比1∶13(g/mL),在最適反應條件下木糖母液經高效液相檢測,木糖含量為20.34 mg/mL,葡萄糖含量為5.69 mg/mL。活性炭可將木糖母液由褐色褪為無色,離子交換樹脂001×12,AH-1能有效去除母液中的部分離子。1 g釀酒酵母3 h內可將100 mL木糖母液中葡萄糖完全去除。最佳工藝條件下,100 g玉米芯產木糖結晶1.5 g,純度為90%。
[1]李士雨,李響,齊向娟,等.乙醇溶析結晶法由棉籽殼制備木糖[J].化工學報 ,2006,61(6):1483-1485
[2]尤新,李明杰.木糖與木糖醇的生產技術及其應用[M].北京:中國輕工業出版社,2006:56-78
[3]孟昭寧.玉米芯生產木糖的工藝技術[J].杭州食品科技,2009(2):30-31
[4]農旭華,張繼泰,王玉瑛,等.嗜熱真菌DSM10635生產耐熱木聚糖酶的小試研究[J].工業微生物,2009,39(3):62-66
[5]陳玉梅.釀酒酵母工程菌研究的進展[J].生物工程進展,1998,13(1):11-16
[6]高鳳嶺.食品中蛋白質的測定原理及操作中的注意事項[J].應用技術,2007,6:74
[7]李雪雁,王丹,胡朝霞,等.玉米芯酸法提取木糖的工藝改進[J],食品工業科技,2009,30(6):263-264
[8]Elina Sj?man,Mika M覿ntt?ri,Marianne Nystr?m,et al.Separation ofxylose from glucose by nanofiltration from concentrated monosaccharide solutions[J].Journal of membrane science,2007,292(1):106-115
[9]毛忠貴,朱利丹,鄧紹榮.用薄層層析法分析海藻糖[J].無錫輕工業大學報,1997,16(4):42-44
[10]蔣琦霞,楊瑞金,孫中國,等.低聚木糖液脫色工藝研究[J],食品工業科技,2008,29(3):229-230
[11]王立東,唐偉,隋明,等.利用樹脂D392進行低聚木糖提取液脫色的研究[J].糧油食品科技,2010,18(3):36-39
[12]張永勤,王哲平,宋雨梅,等.還原糖測定方法的比較研究[J].食品工業科技,2010,31(6):321-323
[13]王文嶺,黃雪松.DNS法測定木糖含量時最佳測定波長的選擇[J].食品科學,2006,27(4):196-197
[14]王秀娟,王成福,秦慶陽,等.酵母發酵法去除木糖母液中葡萄糖[J].食品研究與開發,2010,31(3):154-156
[15]劉建偉,劉志華,劉智勇.HPLC法測定木糖母液的組成[J].安徽農業科學,2009,37(5):1881-1882
[16]Gabas N,Garillon T,Hiquily N.Solubilities of d-xylose and dmanmose in water-ethanol mixtures at 25℃[J].Journal of chemical and engineering data,1988,33(2):128-130
[17]Gabas N,laguerie c.Batch crystallization of d-xylose by programmed cooling or by programmed adding of ethanol[J].Chemical engineering science,1992,47(12):3148-3152
Study on Production and Purfication of Xylose from Corncob by Acid Hydrolysis
GUO Ren-jie,SUN Wan,ZHAO Ling-xi,XIONG Hai-rong*
(College of Life Science,South Central University for Nationalities,Wuhan 430074,Hubei,China)
This research was to explore the acid hydrolysis process of corn cob to produce xylose and its purification procedure.After the corn cob was pretreated by 1%NaOH at 60 ℃ for 24 h,the optimal acid solution is to use sulfuric acid concentration at 1.5%for 3 h reaction with the feed/water ratio of 1∶13(g/mL).After decoloration by activated carbon and desalination by resin,the glucose in hydrolysis solution was then removed by Saccharomyces cerevisiae stain As 2.541 consumption.The result of thin layer chromatography(TLC)assay showed the monosaccharide type in the purified sugar solution was mainly xylose.The total reduction sugar content was monitored and quantified by 3,5-dinitrosalicylic acid (DNS)method and high performance liquid chromatography(HPLC).In the end,the sugar was concentrated by alcohol precipitation.In this research,the crystallization rate and purity of the xylose prepared was reached to 1.5%and 90% ,respectively.
corn-cob;xylose;acidolysis;purification
武漢市重點科技攻關計劃項目(201060623267)
郭仁杰(1985—),女(漢),碩士研究生,研究方向:酶工程。
*通信作者:熊海容(1966—),男,博士,教授。
2011-07-04

