碳源對β-葡萄糖苷酶合成的影響研究
宋京城,金小花,蔡健
(蘇州農業職業技術學院食品系,江蘇 蘇州 215008)
碳源對β-葡萄糖苷酶合成的影響研究
宋京城,金小花,蔡健
(蘇州農業職業技術學院食品系,江蘇 蘇州 215008)
以黑曲霉(AspergiLLus niger NL-1)為產酶菌種,采用搖瓶發酵法,研究不同碳源對β-葡萄糖苷酶合成的影響。以水楊素為底物,以單位時間內催化水解水楊素產生葡萄糖的量表示酶活單位,測定酶活力。結果表明,麩皮為最佳的碳源,適宜的使用量為4%(質量分數)。以純淀粉、微晶纖維素、葡萄糖、蔗糖、纖維二糖等為碳源酶活力很低,或不產酶。以麩皮為底物的最佳產酶時間為5 d,β-葡萄糖苷酶活力達到98.02 nkat/mL。纖維二糖對麩皮為碳源產β-葡萄糖苷酶無誘導作用。
β-葡萄糖苷酶;碳源;黑曲霉NL-1
纖維素酶酶系的3個組分分別為內切-β-1,4-葡聚糖酶(Endoglucanase,EC 3.2.1.4),即C1酶;外切-β-1,4-葡聚糖酶(Cellobiohydrolase,EC 3.2.1.91),即Cx酶;β-葡萄糖苷酶(β-Glueosidase,EC3.2.1.21)。3種組分協同作用能催化水解芳基或烴基與糖基原子團之間的糖苷鍵生成葡萄糖。其中β-葡萄糖苷酶可以降解纖維素(如秸稈中)的纖維二糖生成葡萄糖,缺乏β-葡萄糖苷酶將導致酶水解得率下降,并嚴重影響C1和Cx酶的酶促反應[1]。β-葡萄糖苷酶在飼料、酒精、紡織品和保健食品等領域具有巨大的市場潛力,是酶制劑工業中的一個新的增長點。目前用于生產纖維素酶類的微生物大多屬于絲狀真菌,研究較多的有木霉屬、曲霉屬、根霉屬和漆斑霉屬,其中曲霉是公認產纖維素酶類最高的菌種之一[2-4]。本實驗以不同碳源為培養基,對黑曲霉NL-1產生β-葡萄糖苷酶進行研究,為生產利用纖維素酶提供參考。
1 材料與方法
1.1 材料
1.1.1 供試菌種和主要試劑、儀器
黑曲霉NL-1:由南京林業大學生物工程系菌種保藏室提供。
水楊素0.1%:國藥集團北京化學試劑公司;考馬斯亮藍G-250:上海科端生物科技有限公司;其他試劑均為國產分析純或其配制,722s型可見分光光度計、SHZ-C型搖床:上海機密科學儀器有限公司;電熱恒溫水浴鍋:DK-98-1型,天津泰斯特儀器有限公司。
1.1.2 培養基
斜面培養基:馬鈴薯蔗糖瓊脂培養基,供保存和活化菌種用。
產酶發酵基礎培養基:(NH4)2SO40.4%,KH2PO40.3%,CaCl20.05%,MgSO40.05%,FeSO40.005%,ZnCl20.00014%,吐溫-802滴,pH4.8,分裝于容積為250 mL的三角瓶中(每瓶100 mL),121℃滅菌30 min。在此培養基中分別加入不同碳源時則為實驗用的不同碳源的“發酵產酶培養基”。
1.2 方法
1.2.1 菌種制作
以無菌操作將供試菌種移入斜面培養基中,置28℃恒溫培養,待斜面長滿孢子后用無菌水制成含量為4×106個/mL孢子懸液。
1.2.2 搖瓶發酵
將制備好的孢子懸液接種于制備好的“產酶發酵培養基”中,接種量為2%(體積分數)。置(35±1)℃恒溫振蕩發酵,轉速150 r/min。
1.2.3 β-葡萄糖苷酶活力測定
以水楊素為底物,定義在最適反應條件下每分鐘催化水解水楊素產生1μmol葡萄糖的酶量為1個酶活單位(U)。1 U=16.67×10-9kat=16.67 nkat。
空白管中加1.5 mL 1 mol/L檸檬酸緩沖液,0.5 mL 1%水楊素。其他樣品管中加1.3 mL 1 mol/L檸檬酸緩沖液,0.5 mL 1%水楊素,0.2 mL酶液。在60℃水浴保溫30 min。取出,加5 mL DNS(3,5-二硝基水楊酸溶液),煮沸5 min,定容至25 mL,用分光光度計在540 nm下進行比色測定。
1.2.4 總還原糖濃度的測定
采用DNS(3,5-二硝基水楊酸溶液)法[5]。
1.2.5 可溶性蛋白質的測定
采用改良的Bradford法測定[5]。
1.2.6 碳源的優化試驗
分別選用麩皮、純淀粉、微晶纖維素、葡萄糖、蔗糖、纖維二糖等6種物質作為碳源,加入到“產酶發酵基礎培養基”中,添加量均分別為4%(質量分數),制備成為“產酶發酵培養基”。按“1.2.2”接種發酵,分別在第2、3天取樣,測其pH、蛋白含量、還原糖以及β-葡萄糖苷酶酶活。
1.2.7 培養時間對產酶的影響試驗
“產酶發酵基礎培養基”中以5%(質量分數)麩皮作為碳源,按“1.2.2”接種發酵,分別于發酵的第2、3、4、5、6天取樣測其pH、蛋白質含量、還原糖及β-葡萄糖苷酶酶活。
1.2.8 不同濃度碳源對產酶的影響試驗
1.2.8.1 不同濃度的麩皮對產酶的影響
在“產酶發酵基礎培養基”中分別加入1%、2%、3%、4%、5%(質量分數)麩皮作為碳源進行發酵產酶比較試驗,按“1.2.2”接種發酵,分別在第2、3、4天取樣,測定其蛋白質含量、還原糖量、酶活力。
1.2.8.2 不同濃度的淀粉對產酶的影響
在“產酶發酵基礎培養基”中分別加入1%、2%、3%、4%、5%(質量分數)純淀粉作為碳源進行發酵產酶比較試驗,按“1.2.2”接種發酵,分別在第1、2、4天取樣,測定其有酶無底和有酶有底的C值。
1.2.8.3 纖維二糖對β-葡萄糖苷酶合成的影響
在“產酶發酵基礎培養基”中以4%的麩皮作為碳源,同時分別加入0%、0.2%、0.4%、0.6%、0.8%(質量分數)的纖維二糖進行發酵產酶比較試驗,按“1.2.2”接種發酵,分別在第3、4天取樣,測定其pH、蛋白質含量、酶活力。
2 結果與分析
2.1 碳源的優化試驗結果
碳源的優化試驗結果如表1、表2所示。
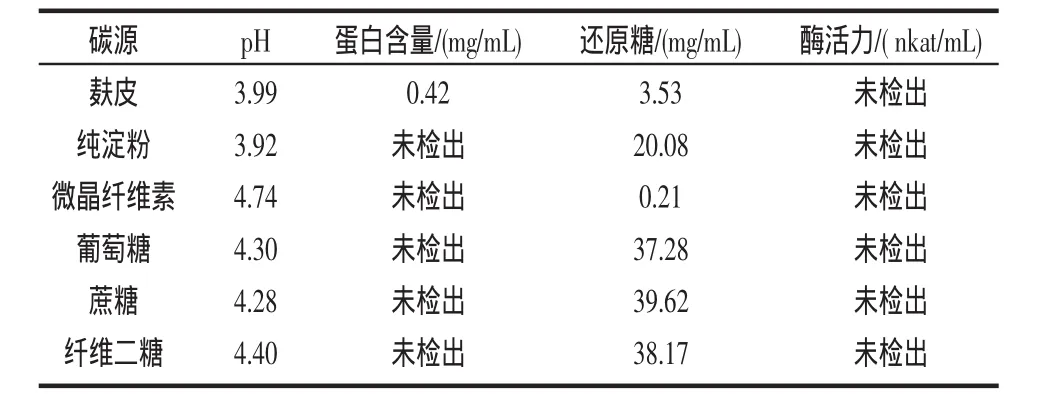
表 1 第2天幾種不同碳源的產酶效果Table 1 The effect of several different carbon sources 2nd days
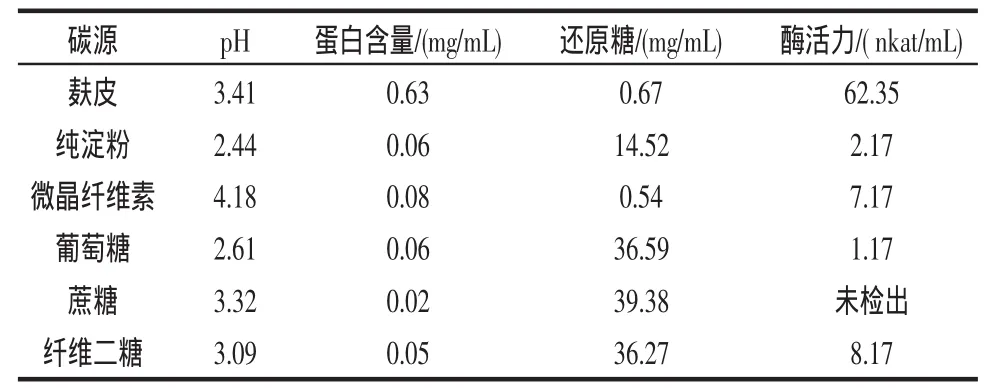
表 2 第3天幾種不同碳源產酶效果Table 2 The effect of several different carbon sources 3th days
從表1、2可以看出,以麩皮作碳源時產酶的濾紙酶活最高,達到62.35 nkat/mL,而其他以純淀粉、微晶纖維素、葡萄糖、蔗糖、纖維二糖作為碳源的基本上不產酶或酶活很低。麩皮為碳源時還原糖的利用率較高,第2天為3.53 mg/mL,第3天則迅速下降到0.67 mg/mL。
在培養的第2天,由于菌絲體的快速繁殖使得麩皮培養基已經變得很黏稠,并可見直徑約為1 mm左右的菌絲體小球;分別添加其它不同碳源的培養基也有同樣的現象:培養基的顏色均與接種前基本相同。培養至第3天時麩皮培養基更加黏稠,菌絲體小球已溶解不能見;微晶纖維素培養基的菌絲體球少且很小,培養基顏色變為黃綠色;其他培養基中的菌絲體小球均變大達3 mm~4 mm。
2.2 培養時間對產酶的影響試驗結果
培養時間對產酶的影響試驗結果如圖1所示。
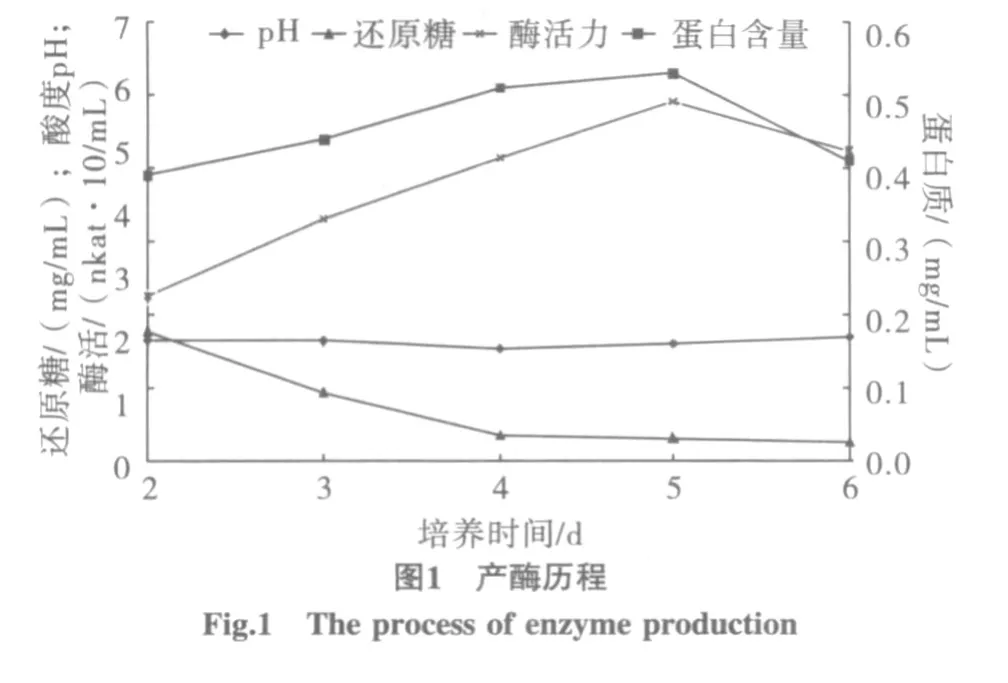
由圖1可知,從培養的第2天開始酶活不斷增加,到第5天時達到最高值98.02 nkat/mL,第6天酶活出現下降。同時可以直觀地看出蛋白質的消長曲線和酶活曲線的走向大致相同;pH的變化隨著培養時間的增加而緩慢減小,但在第5天后略有增加,這便成了第6天酶活下降的原因之一。
培養基中還原糖從第2天的3.57 mg/mL降到第3天的1.87 mg/mL,此階段消耗的碳源主要用于菌絲體的增殖;第3、4天是黑曲霉合成β-葡萄糖苷酶的主要階段,在這一階段,黑曲霉僅需少量葡萄糖滿足自身的新陳代謝,在產酶末期幾乎不再消耗葡萄糖[6]。
2.3 不同濃度碳源對產酶的影響試驗結果
2.3.1 不同濃度的麩皮對產酶的影響結果
不同濃度的麩皮對產酶的影響結果如圖2所示。
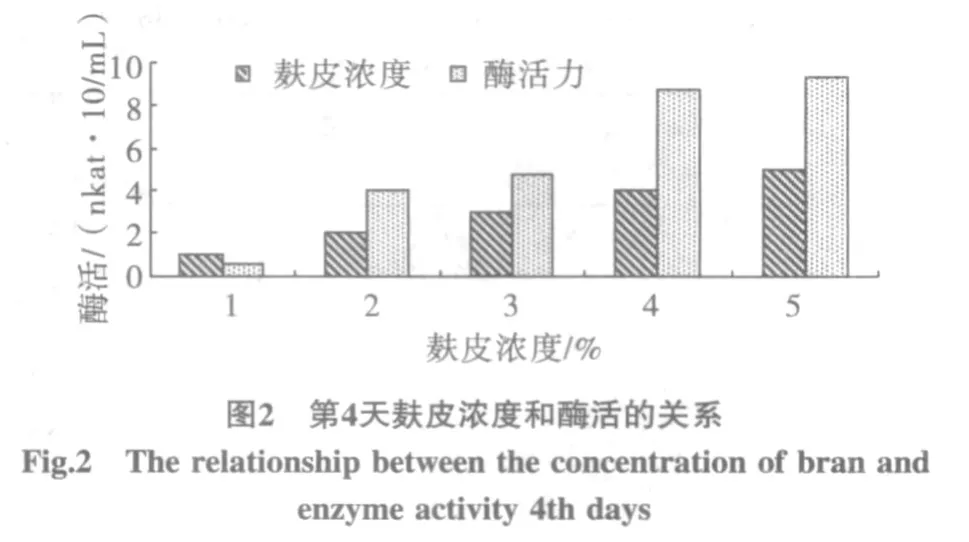
從圖2可看出,第4天,培養基中麩皮濃度為5%時,酶活最高達92.85 nkat/mL。但與麩皮濃度為4%的87.68 nkat/mL比較相差甚小。麩皮濃度為1%、2%、3%時第4天酶活仍都很低,最高值為47.68 nkat/mL,最小為5.67 nkat/mL,這說明碳源濃度過低對產酶非常不利[7]。
麩皮濃度為1%、2%、3%時培養基中還原糖濃度始終維持在較低的水平;而麩皮濃度為4%、5%時還原糖的濃度則相對較高,在第2天分別為3.59 mg/mL和4.86 mg/mL。
2.3.2 不同濃度的淀粉對產酶的影響結果
不同濃度的淀粉對產酶的影響結果如表3所示。
由表3中第1、2、4天的有酶無底和有酶有底的C值的比較可以看出,不同淀粉濃度下有酶無底和有酶有底的值非常接近,這表明純淀粉做碳源時,發酵結果并不產酶或者產酶量很少。從第1天到第4天pH下降非常劇烈,也許會導致所產酶失活[8]。所以純淀粉不適宜作本實驗菌株產β-葡萄糖苷酶的碳源。
2.3.3 纖維二糖對β-葡萄糖苷酶合成的影響結果
纖維二糖對β-葡萄糖苷酶合成的影響結果如表4所示。
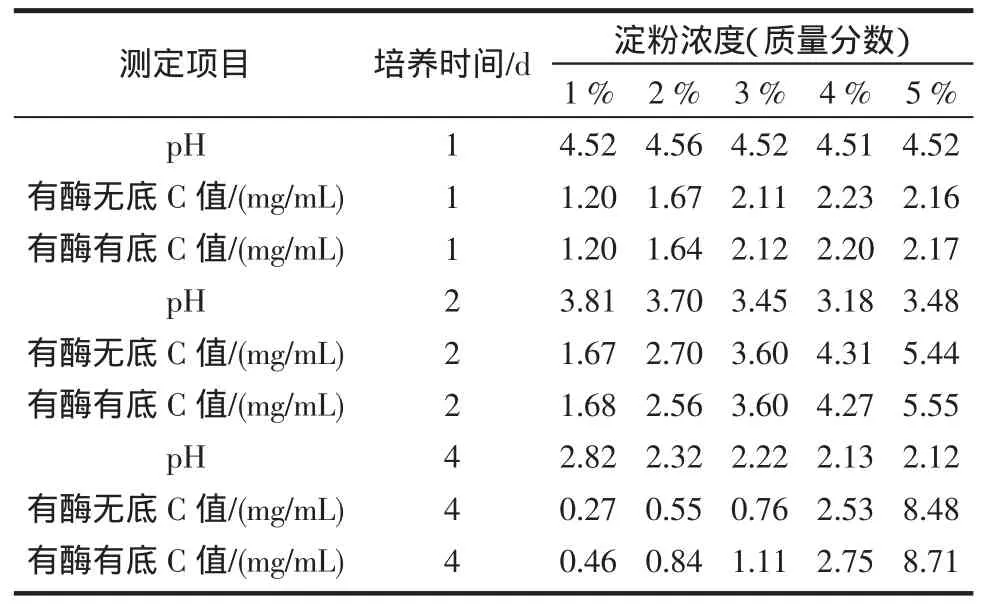
表 3 淀粉濃度對產酶的影響Table 3 The comparison of different concentration starch on enzyme production
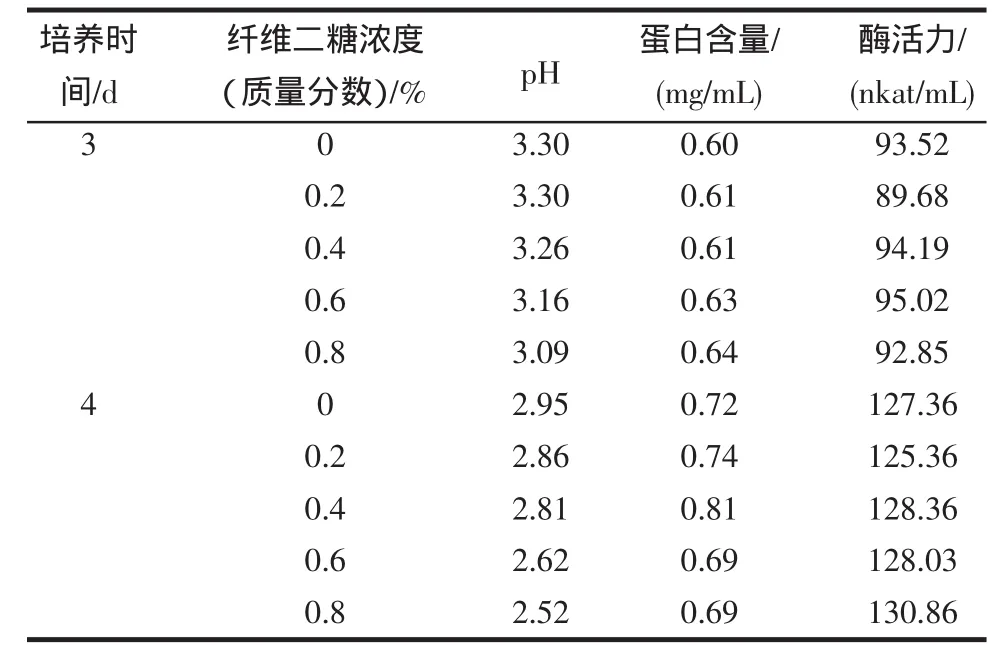
表 4 不同濃度纖維二糖對產酶的影響Table 4 The effect of different cellobiose concentration on the enzyme production
由表4中可知,第3天的酶活的變化均在93.52 nkat/mL左右,第4天的酶活的變化均在128.03 nkat/mL左右;可見有無纖維二糖及其添加量多少對酶活的大小并無影響,pH則隨著纖維二糖濃度的增加逐步下降,蛋白質的變化不明顯。
3 結論
碳源的種類對被試黑曲霉菌株產酶酶活的高低有著非常重要的影響,以麩皮作碳源時酶活最高,而以純淀粉、微晶纖維素、葡萄糖、蔗糖、纖維二糖作為碳源時的基本上不產酶或酶活很低。以5%的麩皮作為碳源,第5天時酶活達到最高(98.02 nkat/mL)。麩皮濃度為5%和4%是產酶比較相差甚小,從經濟效益上來講應選用4%麩皮,碳源濃度過低不利于產酶。以麩皮作培養基加入不同濃度的纖維二糖作為誘導物,發現纖維二糖或者添加纖維二糖的多少對酶活的大小并無影響,而純的纖維二糖基本上不產酶。
[1]梁敏,鄒東恢,王少艷.纖維素酶的研究進展與前景展望[J].食品研究與開發,2004,25(1):14-15
[2]趙林果,周潭澈,孟鵬.β-葡萄糖苷酶產生菌的篩選及其所產纖維素酶酶系組成分析[J].工業微生物,2007,37(5):47-50
[3]Gueguen Y,Chemardin P,Janbon G,et al.A very efficient βglucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices[J].Journal of agricultural and food chemistry,1996,44(8):2336-2340
[4]吳丹,鄧澤元,范亞葦,等.粗壯脈紋孢菌液體發酵產纖維素酶的條件優化[J].食品與機械,2007,23(3):25-27
[5]張龍翔,張庭芳,李令媛.生化實驗方法和技術[M].北京:高等教育出版社,1997:1-3
[6]戴四發,賀淹才,謝德鑣,等.黑曲霉液體發酵分泌纖維素酶系特性的研究[J].糧油食品科技,2004(2):36-39
[7]趙林果,王平,宗雅冬,等.黑曲霉分泌β-葡萄糖苷酶過程中pH值的調控[J].化學與生物工程,2008(12):48-51
[8]董博,連之娜,勇強,等.碳源對里氏木霉β-聚糖酶合成的影響[J].南京林業大學學報:自然科學版,2005,29(6):88-90
Study on Carbon Source of β-Glucosidase by AspergiLLus niger
SONG Jing-cheng, JIN Xiao-hua,CAI Jian
(Department of Food,Suzhou Polytechnic Institute of Agriculture,Suzhou 215008,Jiangsu,China)
Effects of carbon sources on the biosynthesis of β-Glucosidase by AspergiLLus niger NL-1.We investigated Salicin as the substrate was used to indicate activity in unit time.The results showed that bran was the best carbon source for β-Glucosidase production among the studied carbon sources,and it's preferable concentration was 4%.Starch,microcrystalline cellulose,glucose,sucrose,cellobiose,etc.were not carbon sources for β-Glucosidase production.The best time for fermentation is 5 days,in the case,the highest activity of β-Glucosidase 98.02 nkat was obtained.Cellobiose as bran carbonsource hadn't been inducing effect.
β-Glucosidase;carbonsource;Aspergillus niger NL-1
江蘇省高校自然科學研究計劃項目(05KJD150195)
宋京城(1980—),男(漢),講師,碩士,研究方向:食品與生物技術。
2011-08-13

