DhHP-6延長秀麗線蟲壽命的作用機制
王麗萍, 金 鑫, 黃 磊, 李鵬飛, 王立成
(1. 吉林大學 生命科學學院, 長春 130012; 2. 吉林大學 化學學院, 長春 130012)
DAF-16(abnormal dauer formation-16)是叉頭轉錄因子FOXO在秀麗線蟲體內的同源蛋白, 可調節秀麗線蟲壽命[1-2]. DAF-16蛋白在正常情況下位于細胞質中, 可在不同脅迫條件下被信號蛋白激活, 從細胞質轉移至細胞核中, 提高秀麗線蟲的應激能力, 延長秀麗線蟲在脅迫環境下的壽命[3]. DAF-16下游的sod-3以活性氧自由基(reactive oxygen species, ROS)為底物, 將對細胞產生損傷的物質轉化為更安全的化合物, 其活性與秀麗線蟲過氧化損傷引起的衰老情況相關[4].sod-3轉錄受DAF-16調控, 因此可將SOD-3表達量作為DAF-16轉錄活性的檢測指標.
次血紅素六肽(deuterohaemin-Ala-His-Thr-Val-Glu-Lys, DhHP-6)為吉林大學生物大分子研究室設計合成的一種抗壞血酸過氧化物酶(APX)的新型模擬酶[5]. DhHP-6可延長野生型秀麗隱桿線蟲平均壽命, 提高秀麗線蟲的耐熱和抗氧化損傷等應激能力[6-7]. 本文通過上調秀麗線蟲體內某些信號通路中一系列抗脅迫基因的表達量, 清除了自由基, 從而延長了秀麗線蟲壽命.
1 實驗材料與方法
野生型秀麗線蟲(N2)、 TJ356(DAF-16∷GFP)突變體秀麗線蟲、 CF1038(daf-16缺失)突變體秀麗線蟲、 CF1553(SOD-3∷GFP)突變體秀麗線蟲和大腸桿菌OP50.
DhHP-6由吉林大學生物大分子研究室自主固相肽合成; DCFH-DA為美國SIGMA公司產品; 胰蛋白胨、 瓊脂和粉酵母抽提物均為北京鼎國生物工程公司產品; 膽固醇、 氯化鈉、 硫酸鎂、 氯化鈣、 無水乙醇和氫氧化鈉等試劑均為國產分析純.
1.1 秀麗線蟲的培養方法 秀麗線蟲以一種特殊的尿嘧啶缺陷型大腸桿菌OP50(E.coliOP50)為食, 該菌株在秀麗線蟲NGM培養基上生長緩慢, 可保證秀麗線蟲有穩定的食物供給.
在細菌培養板(LB)上挑取單菌落至5 mL的LB液體培養基中, 于37 ℃ 170 r/min振蕩培養8~12 h, OD600=0.4~0.6. 吸取適量的菌液(350 μL/90 mm平板)滴于NGM培養基上, 用滅菌的涂布棒均勻涂抹于NGM培養基的中間部位. 涂抹面積約占總表面積的20%~50%, 以防止秀麗線蟲爬到器壁邊緣而不易操作和觀察. 涂抹完畢后室溫放置至菌液被NGM完全吸收, 轉到20 ℃的無菌培養箱中培養48 h, 使菌長成薄薄的一層, 供秀麗線蟲食用.
1.2 秀麗線蟲壽命的測定方法 使用固體培養基培養秀麗線蟲. 挑取單個同期化培養至L4期雌雄同體的秀麗線蟲至涂有OP50菌液的NGM培養基上, 20 ℃培養. 在產卵期內, 需每日將秀麗線蟲挑取到新的培養基以防止幼蟲過多影響成蟲的生長; 產卵期過后改為每2~3 d換一次. 以秀麗線蟲卵孵化為起始, 以末端刺激無生命活動記為秀麗線蟲死亡, 秀麗線蟲壽命期記為從起始到死亡的時間, 分別記錄各實驗組秀麗線蟲壽命情況.
1.3 DAF-16的GFP熒光顯微檢測及SOD-3的熒光定量檢測 分別挑取30只產卵期的TJ356和CF1553秀麗線蟲至直徑90 mm涂有OP50的NGM平板上, 產卵3 h, 將成蟲移走, 完成秀麗線蟲的同期化. 產完卵的平板于20 ℃培養4 d. 分別挑取TJ356和CF1553秀麗線蟲成蟲(表現為扭曲或滾筒性爬動)進行分組, 并用DhHP-6進行給藥處理, 將處理生長時間為6 d的秀麗線蟲進行壓片觀察.
先分別將DAF-16∷GFP和SOD-3∷GFP秀麗線蟲模型用左旋咪唑麻醉, 再分別用質量分數為1%的瓊脂制片, 挑到載片上, 每片15~20只, 滴加M9緩沖溶液20~50 μL, 加蓋玻片, 壓片. 用共聚焦激光掃描熒光顯微鏡檢測TJ356秀麗線蟲DAF-16的GFP熒光; 用熒光酶標儀檢測CF1553秀麗線蟲的GFP綠色熒光強度.
1.4 DCF法檢測ROS 同期培養至L4期的野生型N2秀麗線蟲, 挑取單個雌雄同體的秀麗線蟲至涂有OP50菌液的NGM培養基上, 于20 ℃培養4 d, 進行分組, 并用DhHP-6進行給藥處理, 將處理培養時間分別為4,6,8 d的秀麗線蟲進行熒光強度檢測.
將5 mg DCFH-DA用DMSO配置為1 mmol/L的儲液, 并于-20 ℃分裝避光儲存, 備用. 向96孔酶標板每孔加入200 μL的M9緩沖溶液, 將成年秀麗線蟲挑入96孔酶標板, 每孔30只, 每組平行3孔, 加入DCF使其濃度為10 μmol/L, 在室溫避光條件下培養30 min后, 使用熒光酶標法測定DCF的熒光強度, 進而確定ROS的濃度.
1.5 數據分析 使用Graphpad Prism 5.0及Origin 6.0數據處理軟件對實驗數據進行分析處理.
2 結果與討論
2.1 DhHP-6對秀麗線蟲壽命的影響 挑取單個同期培養至L4期雌雄同體的秀麗線蟲至涂有OP50菌液的NGM培養基上, 于20 ℃培養4 d, 將秀麗線蟲分為對照組和100 μmol/L濃度DhHP-6給藥組繼續培養. 以秀麗線蟲卵孵化為起始, 以末端刺激無生命活動記為秀麗線蟲死亡, 秀麗線蟲壽命期為起始到死亡的時間. 選擇N2野生型秀麗線蟲及CF1038缺陷型秀麗線蟲進行研究.
表1列出了20 ℃下DhHP-6對秀麗線蟲壽命的影響. 由表1可見, 100 μmol/L DhHP-6可延長野生型秀麗線蟲壽命, 野生型平均壽命為(16.2±0.53)d, 最大壽命為26 d. 給藥后, 秀麗線蟲平均壽命為(19.7±0.26)d, 最大壽命為27 d, 延長秀麗線蟲平均壽命為21%. DAF-16缺陷的CF1038型秀麗線蟲平均壽命為(12.8±0.51)d, 給藥后, CF1038秀麗線蟲平均壽命為(11.2±0.49)d.

表1 20 ℃下DhHP-6對秀麗線蟲壽命的影響
*與對照組相比存在顯著差異,p<0.001; **與對照組相比存在顯著差異,p<0.01.
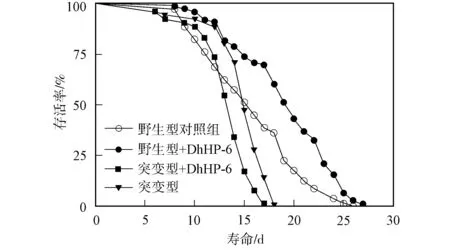
圖1 DhHP-6對秀麗線蟲壽命的影響Fig.1 Effect of DhHP-6 on C.elegans lifespan
DhHP-6對秀麗線蟲壽命的影響如圖1所示. 由圖1可見, 野生型秀麗線蟲給藥前后的生存曲線不同, 表明100 μmol/L的DhHP-6可延長野生型秀麗線蟲的壽命, 但未影響CF1038缺陷性秀麗線蟲的壽命, 即DhHP-6延長秀麗線蟲壽命的機制與DAF-16有關.
2.2 DAF-16細胞核定位 DAF-16正常情況下位于細胞質中, 在脅迫環境下被不同的蛋白激活, 進入細胞核行使轉錄因子功能, 啟動下游基因表達, 從而提高秀麗線蟲應激能力, 延長秀麗線蟲在脅迫環境下的壽命. 綠色熒光蛋白(GFP)在特定波長激發下可產生綠色熒光, 本文通過DAF-16與GFP融合表達的TJ356缺陷性秀麗線蟲進行DAF-16細胞核定位實驗, 研究DhHP-6調節DAF-16延長秀麗線蟲壽命的分子機制. DAF-16細胞核定位實驗結果如圖2所示. 由圖2可見, DhHP-6給藥組秀麗線蟲體內出現了明顯的DAF-16入核現象, 對照組并無明顯入核現象. 表明DHhP-6可促進DAF-16入核, 即DhHP-6延長秀麗線蟲壽命的作用機制與DAF-16密切相關.
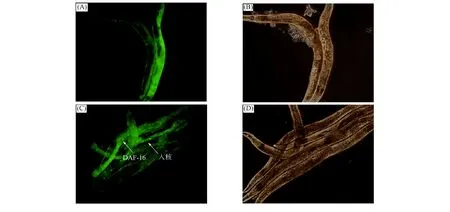
(A) 對照組秀麗線蟲暗場熒光; (B) 對照組秀麗線蟲明場熒光;(C) DhHP-6給藥組秀麗線蟲暗場熒光; (D) DhHP-6給藥組秀麗線蟲明場熒光.圖2 DAF-16細胞核定位Fig.2 DAF-16 nucleic translocation
2.3 DAF-16的轉錄活性測定 通過SOD-3與GFP綠色熒光蛋白融合表達的突變體秀麗線蟲CF1553對SOD-3表達熒光強度進行測定.sod-3作為daf-16下游基因, 其轉錄受DAF-16調控, 可以用sod-3表達量作為DAF-16轉錄活性檢測指標, 確定DhHP-6對DAF-16轉錄活性的影響, 如圖3所示. 由圖3可見, DhHP-6給藥組CF1553秀麗線蟲體內綠色熒光強度顯著增高, SOD-3表達量顯著上調. 表明DhHP-6通過激活DAF-16入核, 提高了DAF-16轉錄活性, 促進了DAF-16下游基因sod-3表達, 提高了SOD-3表達量, 從而引發秀麗線蟲體內一系列的生理生化反應, 延長了秀麗線蟲壽命.
2.4 秀麗線蟲體內ROS的測定 使用DCF法測定秀麗線蟲體內ROS濃度的變化情況, 結果如圖4所示. 由圖4可見, 秀麗線蟲體內的ROS隨培養時間的增加而增加; 與對照組秀麗線蟲相比, DhHP-6給藥組秀麗線蟲ROS上升幅度明顯減慢; DhHP-6給藥喂食培養6,10,14 d的秀麗線蟲與對照組相比體內ROS水平明顯降低. DhHP-6通過啟動DAF-16, 促進了SOD-3表達, 有效清除了秀麗線蟲體內ROS, 從而延長了秀麗線蟲壽命.
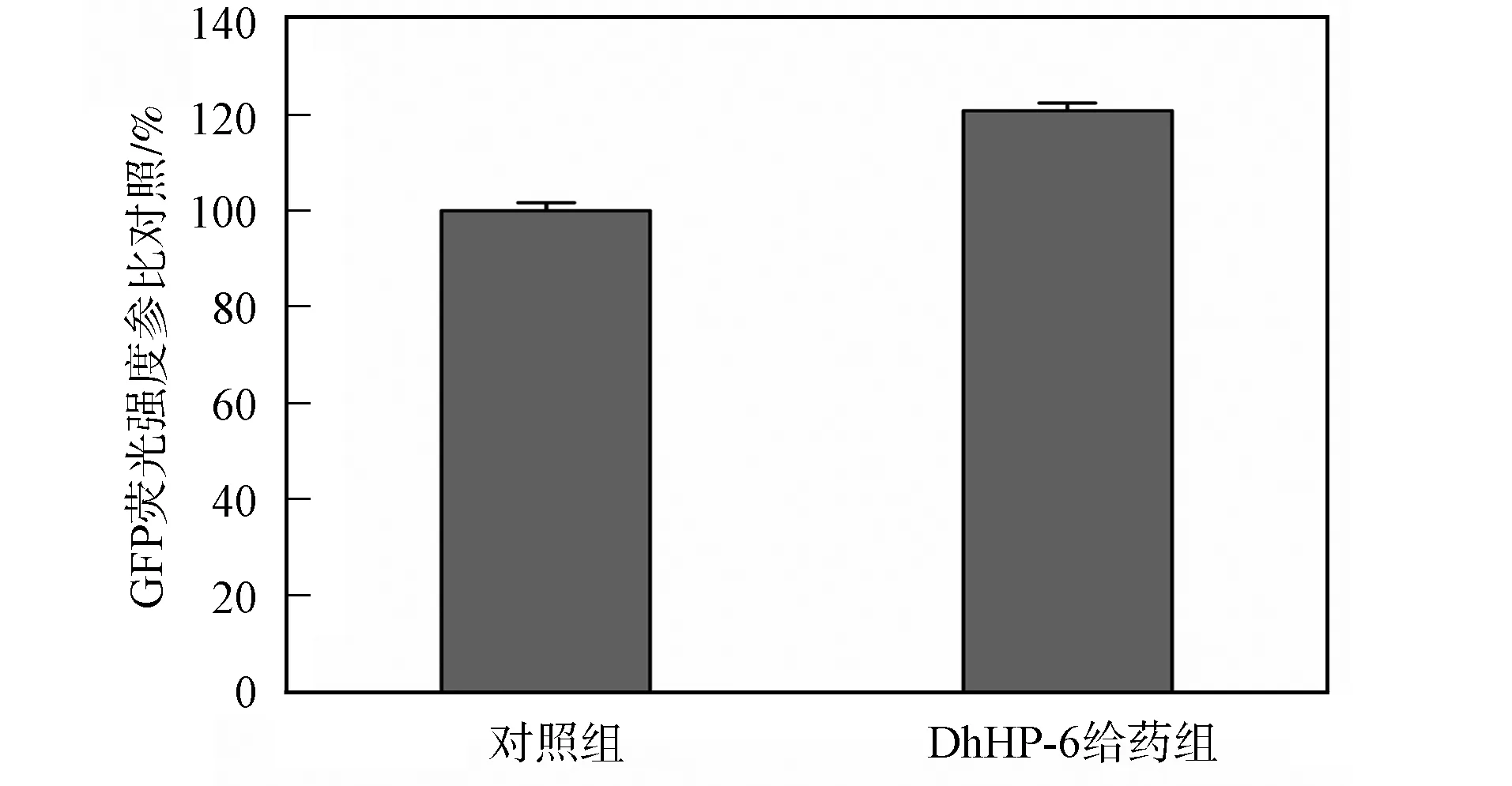
圖3 SOD-3表達熒光強度測定Fig.3 Fluorescence measurement of SOD-3 fused with GFP
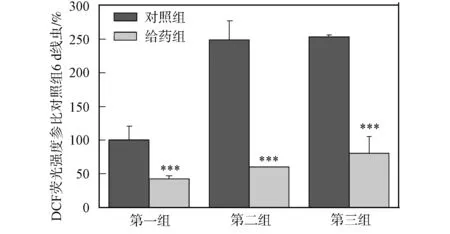
第一組培養6 d; 第二組培養10 d; 第三組培養14 d.圖4 秀麗線蟲體內ROS水平測定Fig.4 Measurement of ROS level in vivo of C.elegans
綜上所述, 本文以秀麗線蟲為模型生物, 考察了DhHP-6給藥前后對秀麗線蟲壽命的影響及相關機制, 并測定了DAF-16相關的生理生化指標. 結果表明: DhHP-6給藥可延長秀麗線蟲壽命, 平均可延長壽命21%, 該壽命延長作用機制與DAF-16因子相關, DhHP-6不影響daf-16缺失型秀麗線蟲壽命; DhHP-6可促進DAF-16進入細胞核, 發揮轉錄活性; DhHP-6給藥可提高DAF-16轉錄活性, 促進下游基因sod-3表達量增加; DhHP-6給藥組秀麗線蟲體內ROS水平顯著降低且ROS積累速度減慢.
[1] Berdichevsky A, Guarente L. A Stress Response Pathway Involving Sirtuins, Forkheads and 14-3-3 Proteins [J]. Cell Cycle, 2006, 5(22): 2588-2591.
[2] Berdichevsky A, Viswanathan M, Horvitz H, et al.C.elegansSIR-2.1 Interacts with 14-3-3 Proteins to Activate DAF-16 and Extend Lifespan [J]. Cell, 2006, 125(6): 1165-1177.
[3] Murphy C T. The Search for DAF-16/FOXO Transcriptional Targets: Approaches and Discoveries [J]. Experimental Gerontology, 2006, 41(10): 910-921.
[4] Honda Y, Honda S. Thedaf-2 Gene Network for Longevity Regulates Oxidative Stress Resistance and Mn-Superoxide Dismutase Gene Expression inCaenorhabditiselegans[J]. The FASEB Journal, 1999, 13(11): 1385-1393.
[5] GUAN Shu-wen, LI Peng-fei, LUO Jing, et al. A Deuterohemin Peptide Extends Lifespan and Increases Stress Resistance inCaenorhabditiselegans[J]. Free Radic Res, 2010, 44(7): 813-820.
[6] GUAN Shu-wen. Study on the Molecular Mechanisms of Peroxidase Mimetic DhHP-6 on Extending Lifespan inCaenorhabditiselegans[D]: [Ph D Thesis]. Changchun: Jilin University, 2007. (關樹文. 過氧化物酶模擬物DhHP-6在秀麗線蟲中的抗衰老作用機制的研究 [D]: [博士學位論文]. 長春: 吉林大學, 2007.)
[7] WANG Li-ping, LIU Ya-li, YANG Hui, et al. Synthesis and Anti-cataract Activity of a Novel Peroxidase Mimetics [J]. Chemical Journal of Chinese Universities, 2004, 25(11): 2171-2173. (王麗萍, 劉亞麗, 楊卉, 等. 一個新的過氧化物酶模擬物的合成及抗白內障活性研究 [J]. 高等學校化學學報, 2004, 25(11): 2171-2173.)

