固定化銅綠假單胞菌生物降解對硝基苯酚
黃強,張明強
1.廈門大學嘉庚學院,福建 漳州 363105
2.漳州師范學院化學與環境科學系,福建 漳州 363000
硝基芳香族化合物作為重要的化工原料,廣泛用于醫藥、染料、農藥、塑料等行業,其在生產和使用過程中被釋放到環境中,會對生態系統造成危害[1],目前對含該類化合物的廢水處理成為國內外學者的研究熱點之一。對硝基苯酚(p-nitrophenol,PNP)是一種重要的環境污染物,已被我國列入水中優先控制污染物黑名單[2],治理該類化合物對保證人類健康具有重要意義。對硝基苯酚類廢水的處理方法有氧化還原法[3-4]、吸附法[5-6]和生化法[7-10]。利用生化法處理PNP廢水具有效率高、成本低的優勢。國外對其生物降解的研究已有較長的時間[11],但是不同微生物的降解速度各不相同,分離不同的PNP降解菌株對研究PNP的生物降解機制具有重要的意義,其能為PNP污染的生物修復提供優良的材料。
固定化細胞技術作為現代化生物工程技術,是利用物理或化學手段將游離細胞定位于限定的空間領域,并使其保持活性,反復利用。與游離細胞方法相比,固定化技術克服了細胞太小,與水溶液分離較難,易造成二次污染等弊端,具有菌體密度高、反應迅速、菌體流失少、產物易分離、反應過程易控制等優點,是一種很有前途的污染物處理技術[12]。細胞被固定化后,細胞內酶系保存完整,相當于一個多酶生物反應器,可使反應更加充分徹底,所以固定化細胞技術被廣泛應用[13-14]。
筆者采用海藻酸鈉作細胞固定化的載體,以漳州某污水處理廠活性污泥中分離的銅綠假單胞菌(Pseudomonas aeruginosa)為固定化對象,研究了pH、溫度、PDP初始濃度等對固定化細胞生物降解PNP效果的影響,并比較了游離細胞與固定化細胞在生物降解PNP過程中的活性。
1 材料與方法
1.1 試劑
試驗所用PNP為化學純試劑,其他各種藥劑均為分析純試劑。
無機鹽培養液:(NH4)2SO4,1.0 g/L;K2HPO4,0.7 g/L;KH2PO4,0.3 g/L;MgSO4,0.2 g/L;NaCl,0.5 g/L;加入適量的PNP作為唯一碳源。
無碳無氮培養液:K2HPO4,0.7 g/L;KH2PO4,0.3 g/L;MgSO4,0.2 g/L;NaCl,0.5 g/L;加入適量的PNP作為唯一碳源和氮源。
富集培養基:蛋白胨,5 g/L;牛肉膏,3 g/L;NaCl,5 g/L。pH 為 7.4,121 ℃高壓滅菌 20 min,該培養基用于菌株的擴大培養。
1.2 儀器與設備
UV-2102PC紫外可見分光光度計(上海精密科學儀器廠);SHA-B恒溫振蕩器(常州國華科技儀器有限公司);TGL-16G臺式離心機(上海浦東物理光學儀器廠);Sartorius電子天平(德國賽多利斯集團);AIR TECH超凈工作臺(北京格瑞恩科技發展有限公司);LDZX-40BI型立式自動電熱壓力蒸汽滅菌器(上海中安醫療器械廠);PYX-250s-B生化培養箱(海口博艾森科技開發有限公司);Sartorius PB-10酸度計(德國賽多利斯集團);ML-902定時恒溫磁力攪拌器(上海五相儀器儀表有限公司)。
1.3 菌種
P.aeruginosa從漳州某污水處理廠的活性污泥中分離獲得,并鑒定保存。
1.4 分析項目
PNP濃度:取生物降解后的PNP培養液4 mL,12000 r/min離心10 min,取上清稀釋一定倍數,用1 mol/L的HCl調pH為4.0,用紫外分光光度計掃描(200~400 nm),觀察特征峰(317 nm)的消失,并用標準曲線法計算PNP濃度及降解率(η):
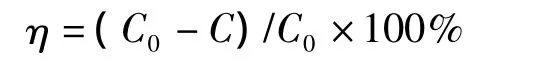
式中,C0和C分別為降解前后PNP濃度,mg/L。
吸光度(A):采用紫外分光光度計在波長為600 nm下進行檢測,以初始培養液(未接菌懸液時)為空白參比。
亞硝酸根采用對氨基苯磺酸-鹽酸萘乙二胺比色法[15]測定。
以上各試驗均做3組平行試驗,數值為3組平行試驗結果的平均值。
1.5 試驗方法
1.5.1 菌懸液的制備
將P.aeruginosa菌株活化并擴大培養,收集對數生長期[16]的濕菌體,8‰生理鹽水洗滌后,以8000 r/min速度離心10 min,收集菌泥,將其制備成濃度為80%的菌懸液。
1.5.2 固定化細胞的制備
以海藻酸鈉為載體,采用包埋法[17]制備固定化細胞,并通過正交試驗優化固定化細胞的制備條件。按1 g菌懸液加入10 mL海藻酸鈉膠液的比例充分混合均勻制成菌膠混合液,用直徑為1.5 mm針頭將菌膠混合液滴入4℃連續攪拌的30 mL CaCl2溶液中,形成凝膠顆粒,在4℃交聯鈣化一定時間后,得到直徑為3~4 mm的固定化小球,該小球用8‰生理鹽水洗滌2次,即可以使用。
1.5.3 固定化細胞的PNP生物降解試驗
研究了pH、溫度、PNP初始濃度對PNP生物降解效果的影響,并通過菌株生長曲線、降解時間動力學曲線及降解產物的測定,分析P.aeruginosa菌株的固定化細胞降解PNP的能力及活性。
2 結果與討論
2.1 菌種生長周期測定
菌種的生長周期對菌株的固定化非常重要。圖1為P.aeruginosa菌株的生長曲線。由圖1可知,菌株在培養9 h后開始進入對數生長期,約22 h進入生長平衡期。因此,對該菌種進行固定化時,應選擇其對數生長期(9~22 h)的種液,以保持其最高活性。
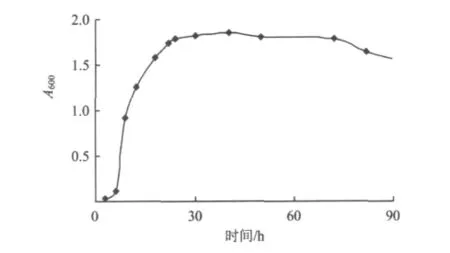
圖1 P.aeruginosa菌株生長曲線Fig.1 The growth curve of bacterium Pseudomonas aeruginosa
2.2 正交法優化細胞固定化的最佳條件
影響固定化細胞降解效果的因素主要有包埋的菌體量、海藻酸鈉膠液濃度、CaCl2濃度以及交聯鈣化時間。采用正交試驗法,進行四因素三水平L9(34)正交試驗[18](表 1),以 PNP 的降解率為指標進行最佳制備條件的確定。
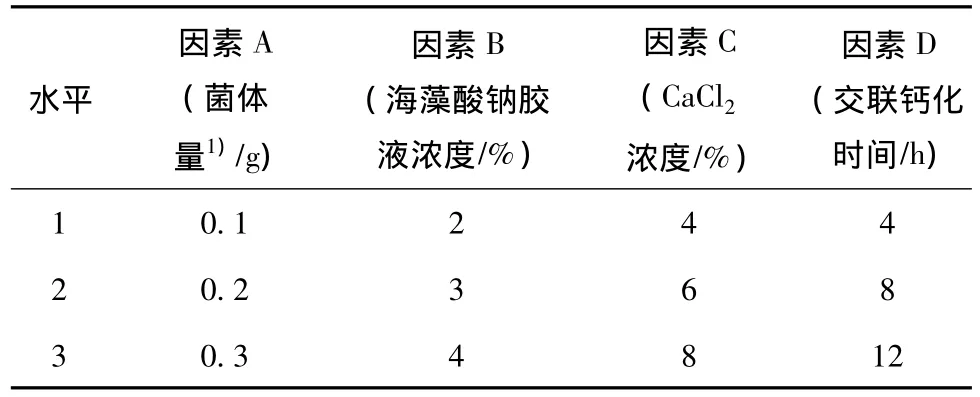
表1 固定化細胞正交試驗設計Table 1 Factors and levels of the cross-test experiments
按表1的因素和水平,采用1.5節方法制得9組固定化細胞(各組海藻酸鈉膠液均為10 mL),分別加入初始濃度為50 mg/L的PNP培養液25 mL,調節pH為8.0,培養溫度30℃,120 r/min旋轉搖床振蕩42 h,測定PNP的降解率,結果如表2和表3所示。
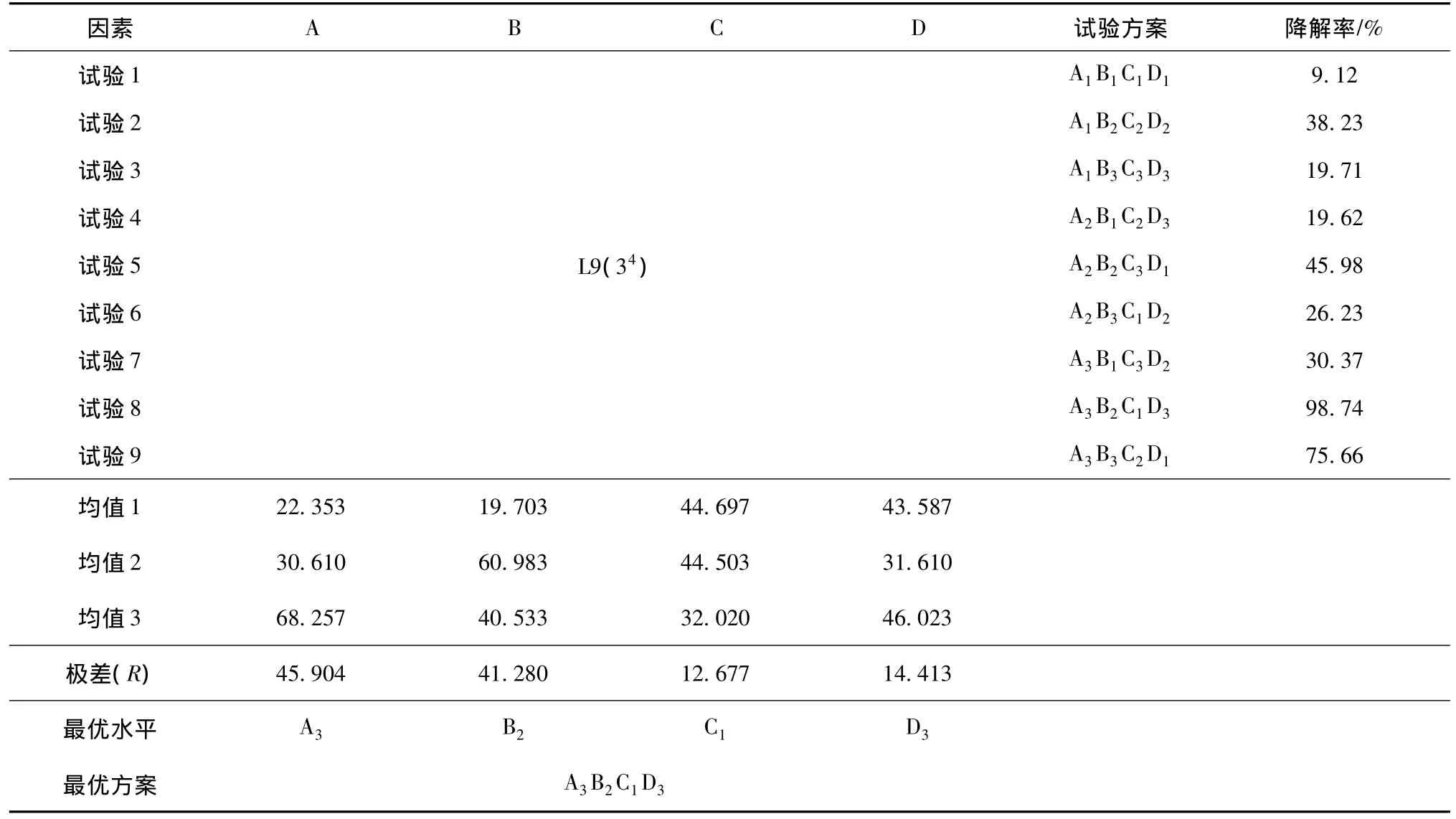
表2 試驗數據分析Table 2 Analysis of the experimental data
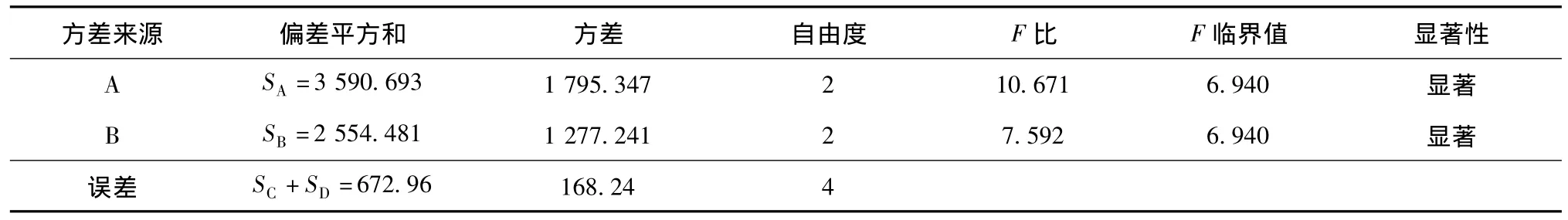
表3 方差分析Table 3 Analysis of variance
從表2和表3可以看出,各因素水平的最優組合為A3B2C1D3。即每mL海藻酸鈉包埋的菌體量為0.3 g,海藻酸鈉膠液濃度為3%,CaCl2濃度為4%,交聯鈣化時間為12 h。
2.3 pH的影響
將P.aeruginosa菌株的固定化細胞和與之菌量相等的濕菌體(游離細胞)分別接種于25 mL初始濃度為100 mg/L的PNP無機鹽培養液中,調節pH 分別為5.0、6.0、7.0、8.0、9.0 和10.0,培養溫度30℃,120 r/min旋轉搖床振蕩40 h,測定 PNP濃度,結果如圖2所示。
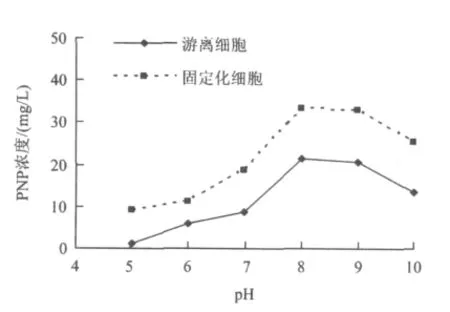
圖2 pH對PNP生物降解性能的影響Fig.2 Effect of pH on the performance of degrading PNP
考察pH對固定化細胞降解PNP效果影響的同時,還應考慮pH對固定化載體牢固程度的影響。當培養液pH調至10.0以上時,固定化載體的牢固程度下降,載體部分溶解。由圖2可知,與游離細胞相似,固定化細胞降解PNP的最適pH為8.0~9.0。在各pH范圍內,固定化細胞對PNP的降解能力均好于游離細胞。
2.4 溫度的影響
將P.aeruginosa菌株的固定化細胞和與之菌量相等的濕菌體(游離細胞)分別接種于25 mL初始濃度為50 mg/L的PNP無機鹽培養液中,調節pH為8.0,培養溫度分別為 20、25、30、35、40 ℃,120 r/min旋轉搖床振蕩40 h,測定PNP濃度,結果如圖3所示。
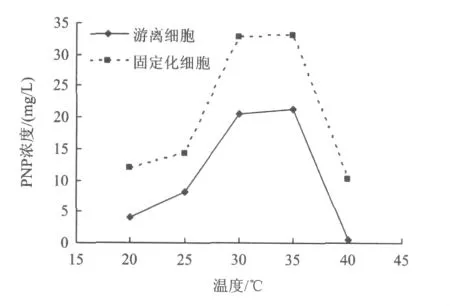
圖3 溫度對PNP生物降解性能的影響Fig.3 Effect of temperature on the performance of degrading PNP
考察溫度對PNP生物降解活性的影響,對探討該方法在不同環境溫度的應用具有重要意義。由圖3可知,在不同的溫度下,固定化細胞對PNP的生物降解能力均好于游離細胞。與游離細胞相似,固定化細胞降解PNP的最適溫度為30~35℃。
2.5 PNP初始濃度的影響
將P.aeruginosa菌株的固定化細胞和與之菌量相等的濕菌體分別接種于PNP初始濃度為25、50、100、150、200、250、300 和 350 mg/L 的 25 mL 無機鹽培養液中,調節pH為8.0,培養溫度為30℃,120 r/min旋轉搖床振蕩40 h,測定PNP濃度,結果如圖4所示。
由圖4可知,當PNP初始濃度為350 mg/L時,游離細胞的降解率接近于0,而固定化細胞的降解率為4.35%。與游離細胞相比,固定化細胞降解PNP耐受濃度有一定幅度的提高,這是由于在固定化系統中,PNP需擴散進入載體內部,才能被包埋在載體內的微生物細胞分解[19]。擴散作用使PNP濃度從載體外部到內部由高到低,形成濃度梯度[15],減輕了PNP對載體內菌株的毒性,利于菌株對PNP的降解,并可加強其對PNP毒性的耐受力。
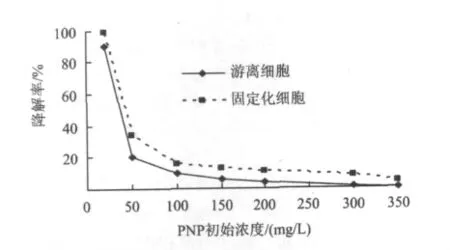
圖4 PNP初始濃度對生物降解性能的影響Fig.4 Effect of different initial PNP concentration on PNP degradation
2.6 固定化細胞降解PNP的動力學曲線
將P.aeruginosa菌株的固定化細胞接種于初始濃度為50 mg/L的PNP無機鹽培養液中,調節pH為8.0,培養溫度為30℃,120 r/min旋轉搖床振蕩培養,進行固定化細胞降解PNP的時間動力學觀察,結果如圖5所示。
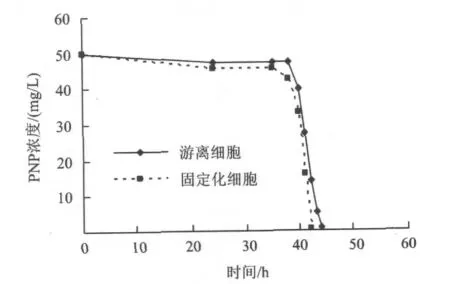
圖5 固定化細胞降解PNP的時間動力學曲線Fig.5 Kinetic curve of degradation of PNP by immobilized cells
由圖5可知,游離細胞與固定化細胞在PNP降解初期均有一段延滯期,游離細胞的延滯期約為38 h,固定化細胞的延滯期約為35 h。這是因為PNP對菌株的生長有抑制作用,即使是馴化后的菌株放入反應體系,也有一段適應期,所以在開始的一段時間PNP的降解速率很慢。而載體對于提高菌株的抗沖擊能力具有一定的作用,所以固定化細胞的延滯期縮短。
固定化細胞的降解曲線分為0~35和35~42 h兩段。隨著菌株生長的開始(35~42 h),PNP迅速被生物降解,約7 h生物降解完全結束。
將上述固定化細胞再次利用,在同樣條件下生物降解PNP,其時間動力學曲線如圖6所示。由圖6可知,再次利用的固定化細胞,延滯期縮短為2 h,且生物降解速度明顯升高,約6 h生物降解完全結束。
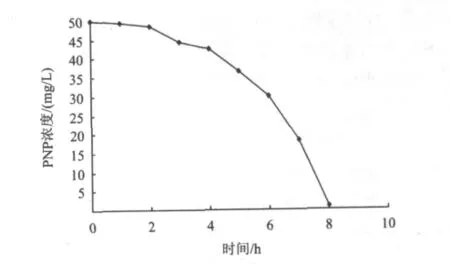
圖6 再次利用固定化細胞降解PNP的時間動力學曲線Fig.6 Kinetic curve of degradation of PNP by reused immobilized cells
試驗表明,固定化細胞連續使用3次效果穩定。當固定化細胞第4次利用時,載體的機械強度變差,固定化小球破裂。這可能是由于固定的菌株產生能分解海藻酸鈉的酶,有待進一步探討。
2.7 生物降解產物鑒定
采用對氨基苯磺酸-鹽酸萘乙二胺比色法鑒定PNP生物降解后的產物,結果表明,經生物降解后的溶液中存在中間代謝產物NO2-。當在無氮無碳培養基中加入PNP進行培養時,P.aeruginosa菌株的固定化細胞可利用釋放的NO2-作為氮源進行生長。
3 結論
(1)采用正交法制備P.aeruginosa菌株固定化細胞,其最佳操作條件:每mL海藻酸鈉包埋菌懸液量為0.3 g;海藻酸鈉膠液濃度為3%;CaCl2濃度為4%;交聯鈣化時間為12 h。
(2)P.aeruginosa菌株固定化細胞對PNP的降解速度大于游離細胞,固定化細胞對PNP的耐受濃度比游離細胞高,這可能是由于在固定化系統中,擴散作用使PNP濃度從載體外部到內部由高到低,形成濃度梯度,減輕了PNP對載體內菌株的毒性,有利于菌株對PNP的生物降解,并可以加強其對PNP的耐受能力。
(3)P.aeruginosa菌株的固定化細胞隨著外界pH的增加,對PNP的降解率逐漸增大,但當pH大于10.0,固定化載體會出現部分溶解,因此其生物降解的最適pH為8.0~9.0。此外,與游離細胞相似,固定化細胞降解PNP的最適溫度為30~35℃。
(4)游離細胞與固定化細胞在生物降解初期均有一段延滯期,游離細胞的延滯期約為38 h,固定化細胞的延滯期約為35 h。這是因為載體對于提高菌株的抗沖擊能力具有一定的作用,所以固定化細胞的延滯期縮短。
(5)采用對氨基苯磺酸-鹽酸萘乙二胺比色法鑒定PNP生物降解后的產物,結果表明,經生物降解后的溶液中存在中間代謝產物NO2-,這說明在無添加氮的情況下,P.aeruginosa菌株的固定化細胞可利用釋放的NO2-作為氮源進行生長。
[1]沈標,李順鵬,趙碩偉,等.氯酚、對硝基酚對土壤生物活性的影響[J].土壤學報,1997,34(3):309-314.
[2]周文敏,傅得黔,孫宗光.水中優先控制污染物黑名單[J].中國環境監測,1990,6(4):1-3.
[3]LI S X,ZHENG F Y,LIU X L,et al.Photocatalytic degradation of p-nitrophenolon nanometersize titanium dioxide surface modified with 5-sulfosalicylic acid[J].Chemosphere,2005,61:589-594.
[4]梁宇寧,黃智,覃思晗,等.Cu2O光催化降解水中對硝基苯酚的研究[J].環境污染治理技術與設備,2003,4(10):36-39.
[5]郭坌梅,馬毅杰,韓和平.有機膨潤土吸附對硝基苯酚的性能及其主要影響因素的探討[J].山西大學學報:自然科學版,2001,24(1):89-92.
[6]郝存江,馮青琴,元炯亮.改性蜂窩煤渣吸附水中對硝基苯酚研究[J].化學世界,2004(4):320-323.
[7]高士祥,王燦,孔德洋,等.β環糊精對對硝基苯酚微生物降解的影響[J].環境化學,2003,22(5):445-449.
[8]崔中利,張瑞福,何健,等.對硝基苯酚降解菌P3的分離、降解特性及基因工程菌的構建[J].微生物學報,2002,42(1):19-26.
[9]劉智,張曉舟,何健,等.營養物質及金屬離子對DLL-E4菌降解對硝基苯酚的影響[J].土壤學報,2004,41(2):292-297.
[10]王燦,高士祥,楊光俊,等.環糊精對硝基化合物混合體系微生物降解影響[J].中國環境科學,2004,24(4):429-432.
[11]SPONZA D T,KUSCU O S.p-Nitrophenol removal in a sequential anaerobic migrating blank reactor(AMBR)/aerobic completely stirred tank reactor(CSTR)system[J].Process Biochemistry,2005,40:1679-1691.
[12]黃霞,俞毓馨,王蕾.固定化細胞技術在廢水處理中的應用[J].環境科學,1983,4(1):41.
[13]沈耀梁,黃勇,趙丹,等.固定化微生物污水處理技術[M].北京:化學工業出版社,2002:166.
[14]馬子駿,陸志號.固定化細胞技術及其應用[M].銀川:寧夏人民出版社,1989:100-101.
[15]李彥秋.固定化微生物處理低濃度含氮廢水的研究[D].南京:南京理工大學,2009.
[16]馬艷玲.固定化假單胞菌降解油煙廢氣的研究[J].環境工程學報,2009,3(10):1856-1860.
[17]王秀,張小平.固定化藻菌小球流化床光生物反應處理高濃度有機廢水研究[J].凈水技術,2009,28(1):54-57.
[18]李春喜,王志和,王文林.生物統計學[M].2版.北京:科學出版社,2000:277.
[19]MENKE B, REHM H-J.Degradation of mixtures of monochlorophenols and phenolas substrate for free and immobilized cells of Acaligenes sp.A7-2[J].Appl Microbiol Biotechnol,1992,37:655-661. ○

