ELPs-PDOR融合基因表達條件的優化
王文研,張光亞
(華僑大學 化工學院,福建 廈門 361021)
ELPs-PDOR融合基因表達條件的優化
王文研,張光亞
(華僑大學 化工學院,福建 廈門 361021)
利用均勻設計法和二次多項式逐步回歸,對重組大腸桿菌生產類彈性蛋白多肽-1,3-丙二醇氧化還原酶(ELPs-PDOR)重組蛋白的培養條件進行優化 .結果表明:在裝液量為30%,誘導劑濃度為6.3mmol·L-1,誘導溫度為30℃,誘導時間為2h的優化條件下進行培養,重組菌融合蛋白表達量是原始表達量的3.3倍,酶活力提高到10.84mkat·L-1,提高2.1倍.
類彈性蛋白多肽;1,3-丙二醇氧化還原酶;大腸桿菌;重組蛋白;均勻設計
類彈性蛋白多肽(ELPs)是由五肽重復序列單元構成,其中第4位為除Pro以外的任一氨基酸[1].ELPs具有依賴于自身的序列、鹽度、溫度敏感的可逆相變過程[2],并利用可逆相變過程純化重組蛋白的純化方法是一種新型、發展潛力大、應用前景廣泛的非色譜純化技術,具有操作簡單、回收率高、可對目標蛋白進行濃縮富集等優勢,可作為新純化方法代替傳統的色譜等傳統的蛋白純化方法[3].1,3-丙二醇氧化還原酶(PDOR,EC 1.1.1.202)是生產1,3-丙二醇(1,3-PD)的關鍵酶之一 ,具有廣闊的應用前景,但目前仍未實現商品化.3-羥基丙醛(3-HPA)是甘油代謝中的一種中間產物 .由甘油經脫水酶作用后形成高濃度的3-羥基丙醛對菌體自身有很大的傷害.快速把產生的3-羥基丙醛轉化為1,3-丙二醇是提高1,3-丙二醇產量和避免3-羥基丙醛大量積累的有效手段,與該轉化密切相關的就是PDOR,因此PDOR的產出與純化至關重要.ELPs標簽的純化方法為純化重組蛋白提供了新方法[4].但由于ELPs自身結構的特點,其具備高度重復的序列,在基因表達過程中頻繁使用某些特定的密碼子而導致密碼子疲勞,從而使得基因表達效率較低 .當連接到待分離的重組蛋白后,其基因序列進一步增長,轉化到表達載體中表達往往效率不高,成為生產酶制劑的重要制約因素.本文利用均勻設計方法,對導入到大腸桿菌中ELPs-PDOR的基因表達條件進行優化,找出其最適的培養條件.
1 材料與方法
1.1 菌種
表達宿主菌Escherichia coli BLR (DE3),本實驗室保存;質粒pUC19-ELPs-dhaT,pET22b(+)-ELPs-dhaT,由本實驗室構建合成[5].
1.2 培養基及培養條件
1)TB培養基.蛋白胨12.0g·L-1,酵母提取物24.0g·L-1,NH4Cl 3g·L-1,甘油4.5mL·L-1,KH2PO41.7mmol·L-1,K2HPO47.2mmol·L-1,pH=7.0.
2)LB培養基.蛋白胨10.0g·L-1,酵母浸膏5.0g·L-1,NaCl 10g·L-1,pH=7.0.
1.3 培養條件優化
將含有pET-22b-ELPs-dhaT重組質粒的BLR(DE3)工程菌按1%的接種量接種到的5mL含100μmol·L-1氨芐青霉素的LB種子培養基中,于37℃,200r·min-1下過夜培養;然后,按1∶100的量將種子菌接種到含100μmol·L-1氨芐青霉素的TB培養基,于35℃,200r·min-1下培養至D(600)為0.8時,加入IPTG誘導劑,低溫誘導.將發酵培養液于4℃,4 000r·min-1條件下離心15min,收獲菌體;然后用預冷的磷酸鹽(PBS)緩沖液(137mmol·L-1NaCl,2.7mmol·L-1KCl,4.2mmol·L-1NaH2PO4,1.4mmol·L-1KH2PO4,pH=7.3)重懸菌體,置冰浴中;最后用300W 超聲破碎菌體4 min,其上清為無細胞抽提液 .通過測定可得到酶活力的變化.
1.4 PDOR 酶活力測定[6-7]
在含30mmol·L-1硫酸銨,1μmol·L-1的硫酸亞鐵銨,0.1mol·L-1的1,3-PD,2.0mmol·L-1的 NAD+和0.1mol·L-1的碳酸鉀緩沖液(pH=9.5)的1.5mL酶反應體系中,在45℃,340nm下連續測定并跟蹤酶反應過程中的吸光值變化;然后,通過酶活計算式可得到PDOR的酶活(z).對于PDOR還原3-HPA為1,3-PD的正反應而言,一個酶活單位(kat)定義為1s內催化1mol底物3-HPA所需要的酶量.
2 結果與討論
2.1 優化條件的選擇
重組目的蛋白ELPs-PDOR在大腸桿菌中的表達受眾多因素的影響,如接種量、培養溫度、溶氧量、誘導劑IPTG濃度、誘導溫度、誘導時間等.其中,氧是影響大腸桿菌生長和代謝的重要因素之一,大腸桿菌只能利用溶解在培養基中的氧氣生長.當培養基中氧氣不足時,大腸桿菌的呼吸鏈和三羧酸循環(TCA)就會被抑制,轉而通過糖酵解途徑來獲取能量,同時大量積累乙酸;而乙酸的積累會抑制菌體的生長以及目的重組蛋白的合成.溫度是影響重組菌生長和產物合成的又一重要因素,重組菌的生長速度和溫度密切相關,隨著溫度的降低,重組菌的代謝速度明顯下降,對氧和營養物質的消耗明顯下降.
IPTG作為誘導劑,對于大腸桿菌的生長密度及代謝速度有明顯的影響[8],加入IPTG后,菌體生長速度降低,降低生長壓力,同時增加表達重要蛋白產物的速度.誘導溫度對基因的調控機制影響很復雜,涉及DNA的復制、轉錄、翻譯及低分子量調節分子合成等方面,以及菌體生長密度、代謝物的產生是不可或缺的考察因素,ELPs重組蛋白在大腸桿菌中表達已有文獻報道,其誘導溫度多在25℃.
基于上述原因,選取對重組蛋白蛋白表達產物有重要影響的4個因素:誘導劑濃度(異丙基-β-D-硫代半乳糖苷,IPTG)(X1)、誘導溫度(X2)、誘導時間(X3)和裝液量(X4)為自變量,以PDOR酶活力為因變量Y,采用U(144)不等水平均勻設計表設計實驗[9],對重組菌產生重組蛋白酶的進行優化.
2.2 培養最優條件確定
考察培養基成分對ELPs-PDOR蛋白酶活力的影響,其均勻設計方案及實驗結果如表1所示.通過二次多項式逐步回歸分析,以調整相關數R最大為原則,對該模型進行顯著性檢驗,建立回歸方程為
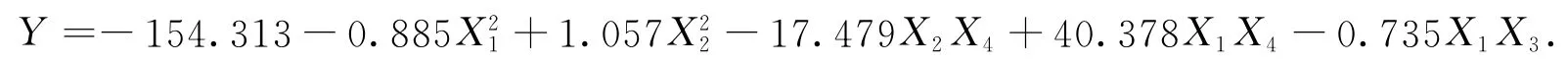
其中:相關系數R為0.996,F值為186.958,顯著性水平小于0.001,回歸極顯著,表明該方程能很好地擬合各考察參數對于目標蛋白酶活力的影響過程.
通過規劃求解,目標蛋白酶活力Y 的最大值為11.40mkat·L-1,此時各因素值:X1=6.3,X2=30,X3=2,X4=0.3.表明,當誘導劑量為6.3mmol·L-1,誘導溫度為30℃,誘導時間為2h,裝液量為30%時,目標蛋白酶活力理論酶活力可達11.40mkat·L-1.

表1 培養條件優化均勻設計表Tab.1 Uniform design table of cultivation parameters optimization
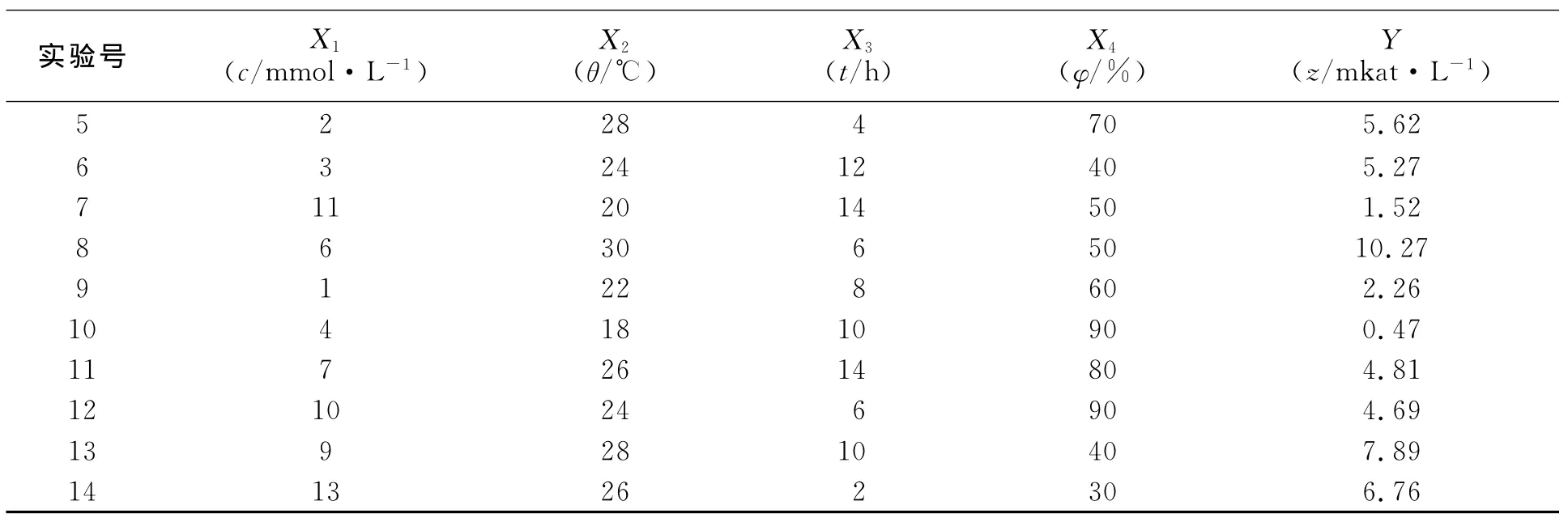
續表Continue table
2.3 培養條件對產酶量的影響
由表1可知:第8組實驗組得到酶活力為10.27mkat·L-1,是14組中產酶量最高的一組;第4組實驗得到的酶活力為9.16mkat·L-1,僅次于第8組 .這兩組培養條件的誘導溫度(X2)均為各水平中最大值30℃,在此溫度下的培養中,菌體生長,代謝處于活躍狀態,對于目標蛋白的產生具有優勢.初步得到X2對產酶量有較大影響.另由回歸方程得到X22系數的t值為26.21,此因素對Y值影響最大,故誘導溫度對于E.coli產生重組蛋白影響顯著.第10組實驗組得到的酶活力僅為4.69mkat·L-1,由于其培養時誘導溫度為18℃,溫度較低,菌體生長受抑制,表達蛋白的速度減緩,因此造成酶活力較低.同時,此實驗組的培養基裝液量為90%,菌體培養時,由于溶氧量缺乏,使得菌體代謝速度緩慢.上述兩種因素是造成第10組實驗組產生目標蛋白的基因表達效率降低,PDOR酶活力較低的主要原因.
誘導劑量也是影響重組菌產生目標蛋白的關鍵因素,加入IPTG誘導劑后,隨著誘導時間的增加,產生蛋白酶活力有所下降.這主要是由于IPTG對菌體有一定毒性,甚至過量表達的蛋白也會使細胞致死;同時,長時間存在且不能被分解的IPTG會引起酶活力和穩定性的下降及酶蛋白的分解[10].由于優化后菌株表達了更大量的外源蛋白,因此菌體受到的毒性更大,酶活力也就受到了更大的影響.因此,誘導劑劑量及誘導時間也是對酶活力影響的重要因素.經過均勻設計得到的最佳誘導劑量為6.3 mmol,且誘導時間為2h,相較于傳統的原始的培養條件(誘導劑量為1.0mmol,誘導時間為10h),增加了誘導劑量,減少了誘導時間,對目標蛋白的酶活力抑制降低.
2.4 優化條件的驗證
通過上述均勻設計實驗和二次多項式逐步回歸,得到重組菌發酵產生目標蛋白最優培養條件,以及在此優化條件下ELPs-PDOR酶活力預測值為11.40mkat·L-1.在原始培養條件(誘導劑量為1.0 mmol·L-1,誘導溫度為18℃,誘導時間為10h,裝液量為60%)培養得到的ELPs-PDOR重組蛋白,其酶活力為5.15mkat·L-1;而在優化條件下,ELPs-PDOR的酶活力達到10.84mkat·L-1,與預測值的相對誤差僅為5%.相較于優化前培養條件,優化后目標蛋白酶活力提高了110.21%.
大腸桿菌優化后,對其培養液的無細胞抽提液進行SDS-PAGE分析,結果如圖1所示.由圖1可知:優化培養條件前的ELPs-PDOR蛋白表達量為7.4%,而優化后的ELPs-PDOR蛋白表達量增加為24.1%,表達量是優化前的3.3倍,優化的培養條件對產生重組的ELPs-PDOR有明顯的促進作用.驗證實驗表明:在優化條件下,培養的重組菌對于序列較長,含高度重復序列的重組基因的表達,以及對其酶活力性能等方面有顯著的提高.
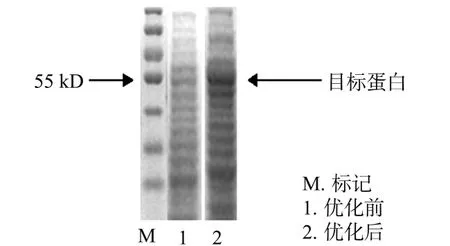
圖1 優化前后大腸桿菌表達ELPs-PDOR的SDS-PAGE分析Fig.1 SDS-PAGE analysis of ELPs-PDOR before and after optimization
3 結束語
利用均勻設計實驗和二次多項式逐步回歸的方法,優化了菌種發酵產ELPs-PDOR重組蛋白培養條件:誘導劑為6.3mmol·L-1,誘導溫度為30℃,誘導時間為2h,裝液量為30%.此條件得到的酶活力可達到1.84mkat·L-1,為優化前的2.1倍,且ELPs-PDOR產量明顯優于原始培養條件產生的重組蛋白量,具有較大的優勢.
[1]URRY D W.Physical chemistry of biological free energy transduction as demonstrated by elastic protein-based polymers[J].J Phys Chem,1997,101(51):11007-11028.
[2]URRY D W.Free energy transduction in polypeptides and proteins based on inverse temperature transitions[J].Prog Biophys Mol Biol,1992,57(1):23-57.
[3]LIM D W,KIMBERLY T C,MACKAY J A,et al.Improved non-chromatographic purification of a recombinant protein by cationic elastin-like polypeptides[J].Biomacromolecules.2007,8(5):1417-1424.
[4]黃凱宗,李晶晶,李巍,等.類彈性蛋白多肽的從頭設計、非色譜純化及鹽效應[J].生物工程學報,2011,27(4):553-658.
[5]LI Wei,FANG Bai-shan,ZHANG Guang-ya,et al.Codon optimization of 1,3-propanediol oxidoreductase expression in Escherichia coli and enzymatic properties[J].Electronic Journal of Biotechnology(in press).
[6]AHRENS K,MENZEL K,ZENG A,et al.Kinetic,dynamic,and pathway studies of glycerol metabolism by Klebsiella pneumoniae in anaerobic continuous culture(Ⅲ):Enzymes and fluxes of glycerol dissimilation and 1,3-propanediol formation[J].Biotechnol Bioeng,1998,59(5):544-552.
[7]陳宏文,聶金峰,方柏山.克雷伯桿菌1,3-丙二醇氧化還原酶的分離純化及其酶學性質[J].華僑大學報:自然科學版,2009,30(1):62-66.
[8]MIROUX B,WALKER J E.Over-production of proteins in Escherichia coli:Mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels[J].J Mol Biol,1996,260(3):289-298.
[9]李志西.試驗優化設計與統計分析[M].北京:科學出版社,1994.
[10]KWEON D H,HAN N S,PARK K M,et al.Overproduction of phytolacca insularis protein in batch and fed-batch culture of recombinant Escherichia coli[J].Process Biochem,2001,36(6):537-542.
Optimization of Cultivation Conditions of ELPs-PDOR Fusion Gene
WANG Wen-yan,ZHANG Guang-ya
(College of Chemical Engineering,Huaqiao University,Xiamen 361021,China)
The optimal parameters of cultivation condition of eastin-like polypeptides-1,3-propanediol oxidoreductase(ELPs-PDOR)by recombinant Escherichia coli were obtained through uniform-design and two polynomial stepwise regression.The optimal conditions of experiment were as follows:the medium volume was 30%,the induction concentration was 6.3mmol·L-1,the cultural temperature was 30℃and the induction temperature was 2h.On the basis of this,the yield of ELPs-PDOR is 3.3times higher than the primitive expression,and the enzymatic activity of PDOR is 10.84mkat·L-1which is 2.1times of the enzymatic activity of primitive expression.
eastin-like polypeptides;1,3-propanediol oxidoreductase;Escherichia coli;recombinant protein;uniformdesign
TQ 923;Q 554
A
1000-5013(2012)03-0296-04
2011-11-22
張光亞(1975-),男,教授,主要從事酶學與酶工程的研究.E-mail:zhgyghh@hqu.edu.cn.
國家自然科學基金資助項目(20806031);福建省自然科學基金資助項目(2009J01030);福建省高校新世紀優秀人才支持項目(07176C02)
(責任編輯:錢筠 英文審校:劉源崗)

