多元醇通路導致糖尿病視網膜病變的研究
孫丹
糖尿病視網膜病變(DR)已逐漸成為導致成人失明的主要原因,它也是糖尿病最常見的并發癥。據一些報道,患糖尿病15~20年的患者有75%會發展為DR,而幾乎所有的1型糖尿病患者和超過半數的2型糖尿病患者最終會發展為DR[1]。
1 糖尿病視網膜病變的發病機制
糖尿病視網膜病變(DR)主要是視網膜微血管的改變。糖尿病微血管病變的典型改變有微循環障礙、微血管瘤形成和微血管基底膜增厚[2]。山梨醇旁路代謝增強,血液流變學改變,凝血機制失調,血小板功能異常,紅細胞2,3-二磷酸甘油酸(2,3-DPG)、糖化血紅蛋白含量增高導致組織缺氧等,可能與微血管病變的發生、發展有關。DR的基本病理改變包括以下5點:(1)周細胞選擇性的丟失。(2)基底膜增厚。(3)微血管瘤的形成。(4)內皮細胞增生。(5)新生血管形成。其中周細胞選擇性的丟失是最早的病理改變[3]。DR按眼底病理改變分為兩大類:(1) 非增殖型(又稱背景性或純型),病變局限于視網膜內,表現為視網膜微血管瘤、出血斑、軟性或硬性滲出物、視網膜動脈或靜脈病變。(2)增殖型(PDR)病變至少有部分向內延伸超過內界膜,新生血管出現是其主要標志,PDR以視網膜新生血管形成及纖維化為特征[4]。總之,DR發生的關鍵因素是視網膜組織缺氧,視網膜微循環異常。早期的病理改變有毛細血管內皮細胞的基底膜增厚、周細胞喪失、毛細血管自動調節功能失代償,隨后內皮細胞屏障功能損害,血-視網膜屏障破壞,血液成分滲出、毛細血管閉塞,視網膜水腫,晚期可見新生血管、異常血管形成及纖維化增生,導致視網膜脫離。
2 多元醇通路激活與DR發病的關系
多元醇通路,由醛糖還原酶(aldose reductase,AR)及山梨醇脫氫酶(sorbitol dehydrogenase,SDH)共同構成。多元醇通路激活的損傷機制目前有以下3種假說:(1)葡萄糖高滲假說,認為人患有糖尿病時,當血糖持續升高超過了糖原合成和葡萄糖氧化能力時,己糖激酶趨于飽和,醛糖還原酶(AR)活力升高使山梨醇生成增多,山梨醇在山梨醇脫氧酶(SDH)作用下轉變為果糖(如圖1),細胞內山梨醇和果糖積聚,滲透壓顯著升高,損傷組織及細胞,產生DR。(2)肌醇代謝異常假說,山梨醇在細胞中的大量聚集可造成肌醇的丟失。而肌醇與細胞膜的結構和功能密切相關,組織中肌醇含量減少,使磷脂酰肌醇的代謝減弱,一方面代謝產物三磷酸肌醇和甘油二脂釋放減少;另一方面蛋白激酶C活性下降,進而使Na+、K+、三磷酸腺苷(ATP)酶的活性下降。(3)NADPH/NADP+比例失調假說,多元醇通路活性增加,導致NADPH的消耗增加,以其為輔酶的還原型GSH生成減少,組織的抗氧化能力降低,自由基的清除減少,引起細胞損傷;另一方面,NADH/NAD+比值增加又阻止了糖酵解途徑中3-磷酸甘油醛向1,3-磷酸甘油酸的轉化,影響組織能量代謝,造成細胞相對缺氧,從而更易損傷[5]。
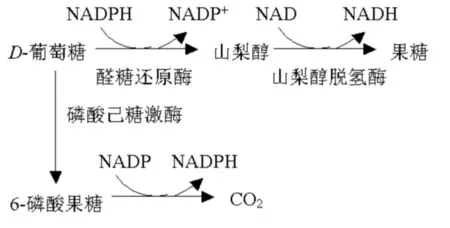
圖1
機體正常環境下,葡萄糖經過三羧酸循環,為細胞代謝提供能量,也可經糖酵解或戊糖旁路代謝。在血糖正常時,因己糖激酶對葡萄糖的親和力遠高于醛糖還原酶(AR),醛糖還原酶對葡萄糖的親和力較低,通過這一途徑代謝的葡萄糖占總葡萄糖量的百分比很小,葡萄糖主要經糖酵解通路代謝,AR活性抑制,山梨醇生成很少[6]。而在糖尿病人中,血糖濃度升高時,己糖激酶被葡萄糖飽和,AR活性表達增強,并被激活,多余的葡萄糖通過多元醇醛糖還原酶途徑代謝,轉化成山梨醇,山梨醇再在山梨醇脫氫酶與輔酶Ⅰ(NAD+)的作用下氧化成果糖。在高糖狀態下,人體內許多組織包括視網膜、腎臟、神經、動脈、晶狀體、紅細胞等的多元醇代謝活躍,葡萄糖在醛糖還原酶作用下,生成多元醇。這些多元醇本身并沒毒性,但因其不易通過細胞膜,致使細胞內山梨醇、果糖過度堆積,從而引起細胞內滲透壓升高,細胞內水腫,同時多元醇通路的激活可抑制磷酸已糖旁路,改變膜的功能,引起肌醇代謝異常,使細胞DNA合成障礙,最后導致細胞增殖活力下降[7]。另一方面可致細胞攝取磷酸肌醇能力障礙,細胞內Na+-K+-ATP酶活性下降。葡萄糖在細胞內轉化為山梨醇的過程中消耗大量的還原性NADPH,機體抗氧化能力降低。此外,AR的激活還引起內皮源性一氧化氮(NO)合成減少,使內皮依賴性血管舒張功能受損。細胞、組織缺氧,營養缺乏,內皮細胞受損,細胞功能低下,這些改變促使糖尿病視網膜微血管并發癥的發生和發展[8]。
在人視網膜中,AR僅存在于視網膜毛細血管周細胞(P)。當血糖濃度升高時,一方面,山梨醇在周細胞內蓄積,形成滲透梯度,D-葡萄糖競爭性與肌醇載體結合,使細胞內肌醇耗竭,從而使周細胞膜Na+-K+-ATP酶活性降低,導致周細胞死亡;另一方面,多元醇通路的激活可抑制磷酸已糖旁路,改變膜的功能,致細胞攝取磷酸肌醇能力障礙,進而DNA活性下降,導致周細胞死亡。周細胞的選擇性丟失,視網膜毛細血管內皮細胞受損,出現無結構毛細血管,最后視網膜毛細血管閉塞,發展成DR[9]。
2.1 醛糖還原酶(AR)與DR的關系
醛糖還原酶(AR)是體內多元醇通路的限速酶,可以將葡萄糖還原為山梨醇。大量研究表明,AR在糖尿病發病中有重要作用。近年來,AR抑制劑(ARI)的研究也支持多元醇通路在DR致病中的作用。研究者發現,視網膜毛細血管周細胞中含有的AR,在高血糖狀態下被激活,大量的山梨醇積累于周細胞中,使其發生滲透性腫脹,肌醇和K+丟失,周細胞Na+-K+-ATP酶活性下降,導致周細胞死亡和內皮細胞受損,出現無細胞結構的毛細血管,最后閉塞。此外,在高血糖的狀態下,AR過度利用NADPH,限制了一氧化氮合成酶和GSH過氧化物酶,對NADPH的競爭引起了抗氧化防御作用的減弱,在此基礎上,進一步導致了DR的發生。還有一些學者認為,免疫損傷也參與了DR中AR的激活過程,Dagher等[10]發現,人和大鼠視網膜內皮細胞都有AR的免疫活性,把糖尿病大鼠AR阻斷可以阻止早期DR的補體激活,控制隨后發生的血管內皮細胞和周細胞凋亡及無細胞毛細血管的產生。而醛糖還原酶抑制劑可以阻止多元醇通路的激活導致視網膜內皮細胞功能的損傷[10]。由此可見AR在早期DR的微血管損害及神經細胞凋亡中起到了不可忽視的作用。
2.2 山梨醇脫氫酶與DR的關系
醛糖還原酶(AR)以NADPH為輔酶,催化己糖的還原反應,將葡萄糖轉化為相應的還原產物山梨醇,山梨醇再在山梨醇脫氫酶與輔酶Ⅰ(NAD+)的作用下氧化成果糖[11]。當血糖濃度升高時,己糖激酶被葡萄糖飽和,AR表達增強,并被激活,細胞內過多的葡萄糖通過AR轉化為山梨醇,山梨醇脫氫酶(SDH)的活性隨之相應增加,造成山梨醇及果糖在細胞內堆積。山梨醇是一種極性很強的化合物,不能自由進出細胞,引起細胞內山梨醇堆積。一方面造成細胞水腫及細胞滲透壓的損傷,引起一系列病理改變,從而誘發DM并發癥,如:白內障、視網膜病變、神經病變及腎臟病變等[12]。
多元醇通路中的山梨醇脫氫酶,它能將山梨醇轉化為果糖,但是在糖代謝的過程中AR比SDH的作用更直接。然而,Tiltonetal[13]和Amanoetal[14]提出,在糖尿病視網膜病變的形成過程中,SDH比第一步中的AR發揮了更重要的作用。在以往多元醇通路中針對AR的研究較多,對該通路中另一重要的限速酶SDH的研究卻比較少。SDH在晶狀體及腎臟等人體多個器官都有表達,它主要介導山梨醇向果糖的轉化,是多元醇通路中重要的限速酶,其在DR的發病機制中發揮了重要的作用[15]。研究發現,用鏈脲佐菌素(STZ)誘導糖尿病大鼠,在第10周可觀察到糖尿病鼠視網膜上中央神經元的凋亡和神經膠質酸性蛋白(GFAP)的表達增強,糖基化血紅蛋白(HbAlc)濃度高達16%,說明視網膜上山梨醇和果糖發生蓄積。Shinjiro Amano[14]等也發現,血糖增高時,周細胞中SDH表達增加,明顯刺激活性氧(ROS)的生成,ROS能夠介導SDH過表達對細胞的損傷作用,ROS產生增加,DNA的合成減少,血管內皮生長因子mRNA的表達增多,可能是導致高血糖狀態下相應細胞損傷的原因。使用醛糖還原酶抑制劑非達司他,能夠阻止高糖狀態下SDH在周細胞中的沉積,減少ROS的生成,減少因SDH的過表達對細胞造成的損傷,同時能明顯降低血管的通透性,阻止DR的早期改變。Tilton[13]等的研究發現,盡管在糖尿病大鼠視網膜組織中山梨醇脫氫酶的表達量增加了11倍,但是應用了SDH抑制劑后能夠減輕糖尿病大鼠眼內組織血管的功能紊亂。因此,使用非達司他阻斷山梨醇的生成,可能是一種針對糖尿病視網膜病變早期治療的新策略。這些研究說明SDH介導的山梨醇到果糖的轉變,以及ROS的產生,可能在糖尿病視網膜病變的致病機制中發揮了重要的作用。同時也提示SDH的活性在DR的病因學中可能發揮著比AR更重要的作用[16]。
3 研究展望
多元醇通路的激活是導致糖尿病視網膜病變(DR)的重要機制之一,而醛糖還原酶(AR)和山梨醇脫氫酶(SDH)是多元醇通路中研究得最多的兩個限速酶,在血糖正常時,這兩個限速酶不會激活多元醇通路,而在高血糖的情況下,其中任何一個限速酶都會導致通路的激活。目前,在醛糖還原酶和山梨醇脫氫酶的研究還多停留在化學分子階段,涉及基因表達的研究較少,下一步,我們的研究將更多會向控制這兩種酶的基因上進行,通過調控基因的表達來治療和預防疾病的發生。此外,除了對AR和SDH的研究,對于激活多元醇通路的其他化合物因素,我們還要繼續挖掘和探索。如今,我們通過對AR的研究,了解到控制DR發生的機制,通過抑制醛糖還原酶用來治療DR,開發了醛糖還原酶抑制劑ARI,給廣大DR患者帶來福音。隨著基因工程的研究的進一步深入,相信治療DR的新途徑和新藥物會越來越多。
[1] Khan ZA,Chakrabarti S.Cellular signaling and potential new treatment targets in diabetic retinopathy[J].Exp Diabetes Res,2007,13(9):1-12.
[2] 蔣玲,呂紅彬.細胞因子與糖尿病視網膜病變的研究進展[J].眼科研究,2009,27(12):1165-1168.
[3] Chung HS,Harris A,Halter PJ,etal.Regional differentes in retinal vascular reactivity[J].Invest Ophthalmol Vis Sci,1999,40(10):2448-2453.
[4] 趙堪興,楊培增.眼科學[M].第7版.北京:人民衛生出版社,2008:205-206.
[5] Williamson JR,Chang K,FrangosM,etal.Hyperglycemic pseudohypoxia and diabetic complications[J].Diabetes,2003,42:801-813.
[6] Cheung AK,Fung MK,Lo AC,etal.Aldose Reductase Deficiency prevents Diabetes-Induced Blood-Retinal Barrier Breakdown,Apoptosis,and Glial Reactivation in the Retina of db/db Mice[J].Diabetes,2005,54:3119-3125.
[7] Williamson JR.Hyperglycemie pseudouridine and diabelic complicatings[J].Diabetes,1993,42 (4):801-813.
[8] Xia P,Kramer RM,King GL.Identification of the mechanism for the inhibition of Na.K-adenoside triphosphatase by hyperglycemia involving activation of protein kinase C and cytosolic phospholipase A2[J].Jclin Invest,1995,96 (5):733-740.
[9] Engerman RL,Kern TS.Larson ME Nerve conduction and aldose reduetase inhibition during 5 years of diabetes or galactosaemia in dogs[J].Diabetologist,1994,37(2):141-144.
[10] Mori A,Saigo O,Sakamoto K,etalHyperglycemia impairs acetylcholine-induced vasodilation of retinal arterioles through polyol pathway-independent mechanisms in rats[J].J Pharmacol Sci,2010,112 (3):336-42.
[11] Dagher Z,Park YS,Asnaghi V,etal.Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy[J].Diabetes,2004,53(9):2404-2411.
[12] 吳燕,呂紅彬,蔣玲.多元醇通路與糖尿病性視網膜病變的研究進展[J].國際眼科雜志,2009,9(2):335-337.
[13] Tilton RG,Chang K,Nyengaard J.el a1.Inhibition of sorbitol dehydrogenase effects on vascular and neural dysfunction in streptozocin induced diabetic rats[J].Diabetes,1995,44:234-242.
[14] Shinjiro Amano,Sho-ichi Yamagishi,Noriaki Kato Sorbiml dehydrogenase overexpression potentiates glucose toxicity to cultured retinal pericytes[J].Biochemical and Biophysical Research Communications,2002,299:183-188.
[15] Kaiser C,de Haij,Norberg D,etal.A hydrogen-bonding network in mammalian sorbitol dehydrogenase stabilizes the tetrameric state and is essential for the catalytic power[J].Cell.Mol.Life.Sci.2007,64:3129-3138.
[16] Cheung AK,Fung MK,Lo AC.Aldose reductase deficiency prevents diabetes-induced blood-retinal barrier breakdown,apoptosis,and glial reactivation in the retina of db/db mice[J].Diabetes,2005,Nov,54(11):3119-3125.

