大粒徑石灰石熱分解動力學研究*
陳海,張世紅,楊海平,李攀,陳漢平,曾軍
(1.華中科技大學,煤燃燒國家重點實驗室,湖北武漢 430074;2.江漢油田管理局鹽化工總廠熱電廠)
大粒徑石灰石熱分解動力學研究*
陳海1,張世紅1,楊海平1,李攀1,陳漢平1,曾軍2
(1.華中科技大學,煤燃燒國家重點實驗室,湖北武漢 430074;2.江漢油田管理局鹽化工總廠熱電廠)
主要研究大粒徑石灰石的煅燒特性,采用熱重分析儀研究了5種不同粒徑石灰石的煅燒過程。石灰石粒徑分布在0.5~10 mm,煅燒溫度在900~1 050℃。研究結果表明,粒徑越小溫度越高石灰石分解速率越快,而且粒徑和煅燒溫度對石灰石熱分解機理也有明顯的影響。粒徑小溫度高時反應符合隨機成核和隨后生長機理模型,粒徑大溫度低時反應符合相界面反應機理。當粒徑為0.5~1 mm時反應活化能很小,隨著粒徑的增大反應活化能有所增加,粒徑在1~5 mm時活化能變化不大,粒徑繼續增大(5~10 mm)活化能增大了1倍。
石灰石;熱重分析;粒徑;熱分解動力學
碳酸鈣分解的早期研究可以追溯到1931年C. C.Furnas[1]的工作,隨后Charles N.Satterfield等[2]在1959年也對熱解速率控制進行了研究。早期研究表明CaCO3分解存在3種可能的速率受控機理:1)CaCO3顆粒內部的傳熱;2)在顆粒內部和離開顆粒后的CO2的擴散;3)CaCO3的化學分解。對于直徑為2 cm的圓柱形CaCO3分解的研究,Charles N. Satterfield等[2]發現熱傳遞是主要的控速因素。A.W. D.Hills[3]在1968年對1 cm直徑的球形CaCO3分解進行研究,也得出其分解速率主要受控于熱傳遞和CO2的擴散。對于大顆粒CaCO3而言,產物層的物質擴散和熱傳遞是控速的主要因素,那么隨著顆粒尺寸的減小其影響力將減小,而化學反應的因素將變得越來越重要。然而,在CaCO3分解研究中,分解受何種反應機理控制目前未有定論[4]。許多學者采用熱重法對各種粒徑的石灰石進行過研究,得到的結果差別較大(見表1)。
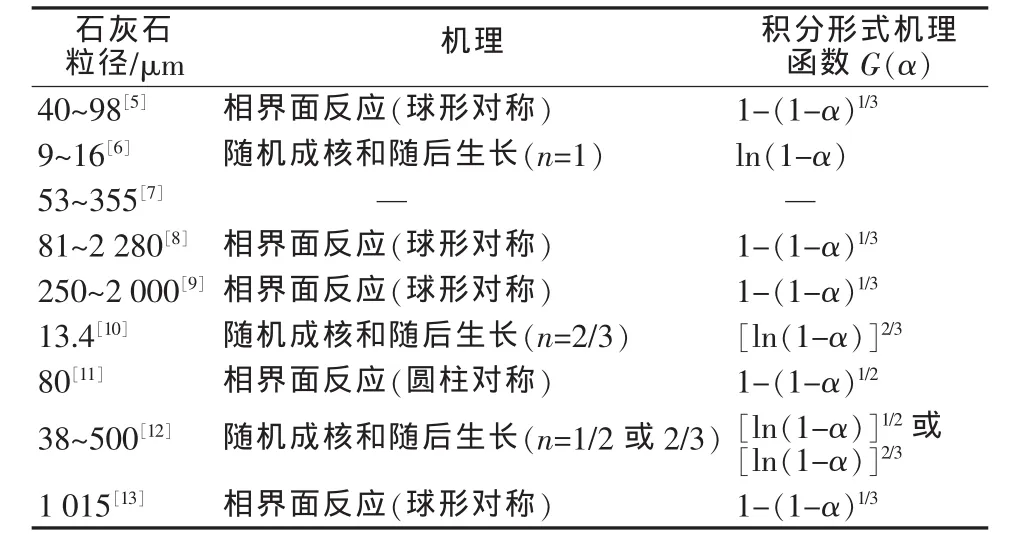
表1 各種粒徑石灰石分解機理研究現狀
石灰石是一種重要的工業原料,電廠使用粉末狀石灰石作為脫硫劑[14],鋼鐵行業使用石灰作為造渣劑,而各種煅燒窯對石灰石原料的粒徑都有要求,一般要求粒徑在30 mm以上[5]。各行業對于0~10 mm粒徑石灰石的利用非常有限,所以研究這種粒徑石灰石的有效利用方法具有現實意義。同時由表1發現,前人主要針對小粒徑石灰石的分解機理進行研究,而對大粒徑(>2 mm)石灰石的研究卻很少涉及。因此,筆者主要研究大粒徑石灰石(0~10 mm)的分解行為和分解機理。
1 實驗部分
實驗樣品選用湖北武穴石灰石,其化學成分及含量(質量分數):CaO,47.86%;SiO2,8.51%;Fe2O3,1.17%;Al2O3,3.33%;其他,39.13%。實驗采用熱天平實驗臺架,熱天平采用爐底進氣、兩段式電加熱方式。
實驗選取5種不同粒徑(0.5~1、1~2、2~3、3~5、5~10 mm)的石灰石,在4種不同溫度(900、950、 1 000、1 050℃)下在空氣氣氛中進行等溫熱重實驗。將樣品預先置于爐膛頂部的樣品池中,待爐膛升溫至所需溫度再通過升降機把樣品放入爐膛內反應,保持樣品處于空氣氛圍中,計算機自動記錄反應過程中樣品的失重曲線。
2 實驗結果及分析
圖1為5種粒徑石灰石在900~1 050℃常壓條件下煅燒反應轉化率隨時間的變化。圖1顯示,溫度升高反應速率加快。這是因為,溫度升高傳熱速率增大,化學反應更加劇烈,使得反應速率增加;另一方面,溫度升高時石灰石會出現“爆玉米花”效應。Hazler等認為,出現形同“爆玉米花”的結果,是由于二氧化碳要通過基體逃逸從而導致顆粒爆炸[7]。與此同時,粒徑為0.5~5 mm的石灰石的煅燒反應曲線都呈S形,即反應初期反應速率慢,接著速率陡增,然后持續這種反應速率,直到反應快到達終點時反應速率再次降下來。再者,高溫條件下,當粒徑為0.5~5 mm時,石灰石可以在300 s左右煅燒完全。
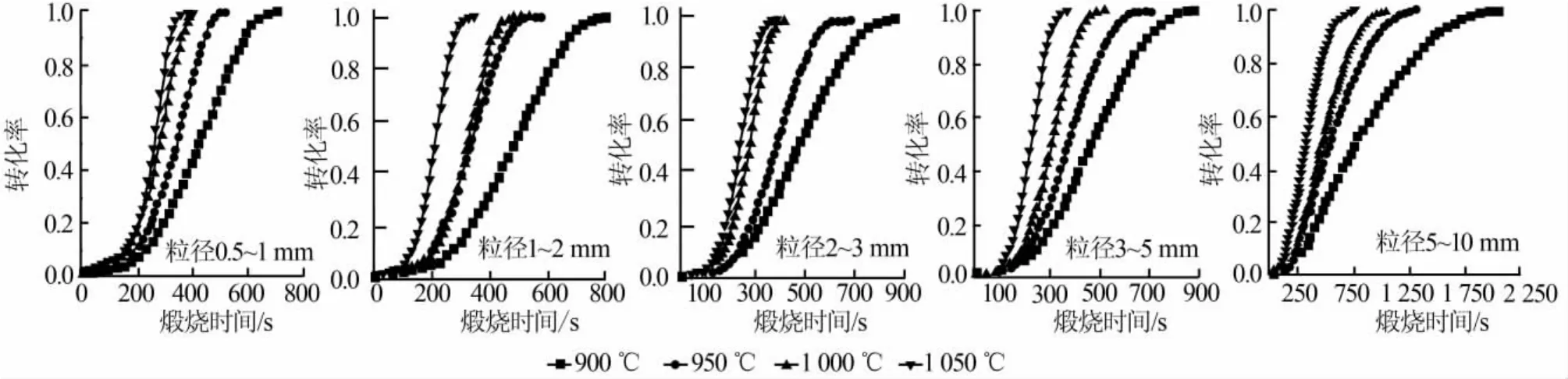
圖1 不同粒徑石灰石在不同溫度下煅燒反應轉化率與時間的關系
圖2為粒徑對石灰石煅燒的影響。由圖2看出,粒徑越小曲線峰值越大,即轉化速率越大。隨著粒徑增大,曲線漸漸變得平坦,煅燒完全所需時間變長,這與前人研究結果[15]一致。原因是粒徑越大,熱量傳遞到石灰石內部會越緩慢,同時高溫下石灰石會出現燒結現象,由于熱量是由外向內傳遞,燒結現象也會從顆粒外層開始,這樣石灰石分解氣體產物CO2從內部擴散到外界受到的阻礙會越大,即粒徑越大傳熱傳質效果越差。根據實驗,在950℃條件下各種粒徑石灰石煅燒完全所需時間依次為520 s(0.5~1 mm)、580 s(1~2 mm)、690 s(2~3 mm)、710 s(3~5 mm)、1 330 s(5~10 mm)。同時發現,當石灰石粒徑為0.5~5 mm時轉化速率曲線相近,而當粒徑更大時曲線變化很大,煅燒完全所需時間明顯延長。
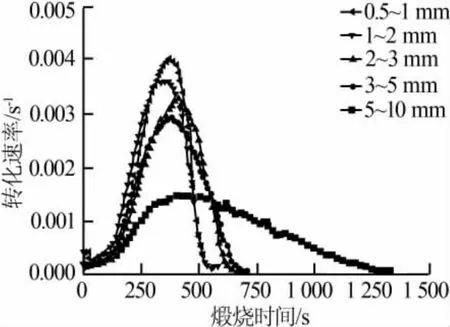
圖2 粒徑對石灰石煅燒的影響(T=950℃)
3 石灰石煅燒反應動力學分析
當石灰石加熱到分解溫度后會發生如下反應:

這個分解反應由以下階段構成:1)CaCO3微粒破壞,在CaCO3中生成CaO過飽和熔體;2)過飽和熔體分解生成CaO晶體;3)CO2氣體脫附,向石灰晶體表面擴散[16]。
根據Arrhenius公式,反應速率常數:

式中:E為反應活化能;A為指前因子。實驗中每種實驗條件下的溫度T都是恒定的,即為等溫熱重實驗,則可以認為實驗中k值恒定。
根據反應動力學積分方程,有

式中:α為石灰石反應轉化率;G(α)為積分形式的反應機理函數;t為反應時間。不同的反應機理對應著不同的機理函數[17],如表1所示。故可以取不同的機理函數G(α)做出G(α)-t曲線,然后進行線性擬合,取出擬合度最高的機理函數即可確定反應機理。表2給出不同溫度下石灰石熱分解動力學機理。
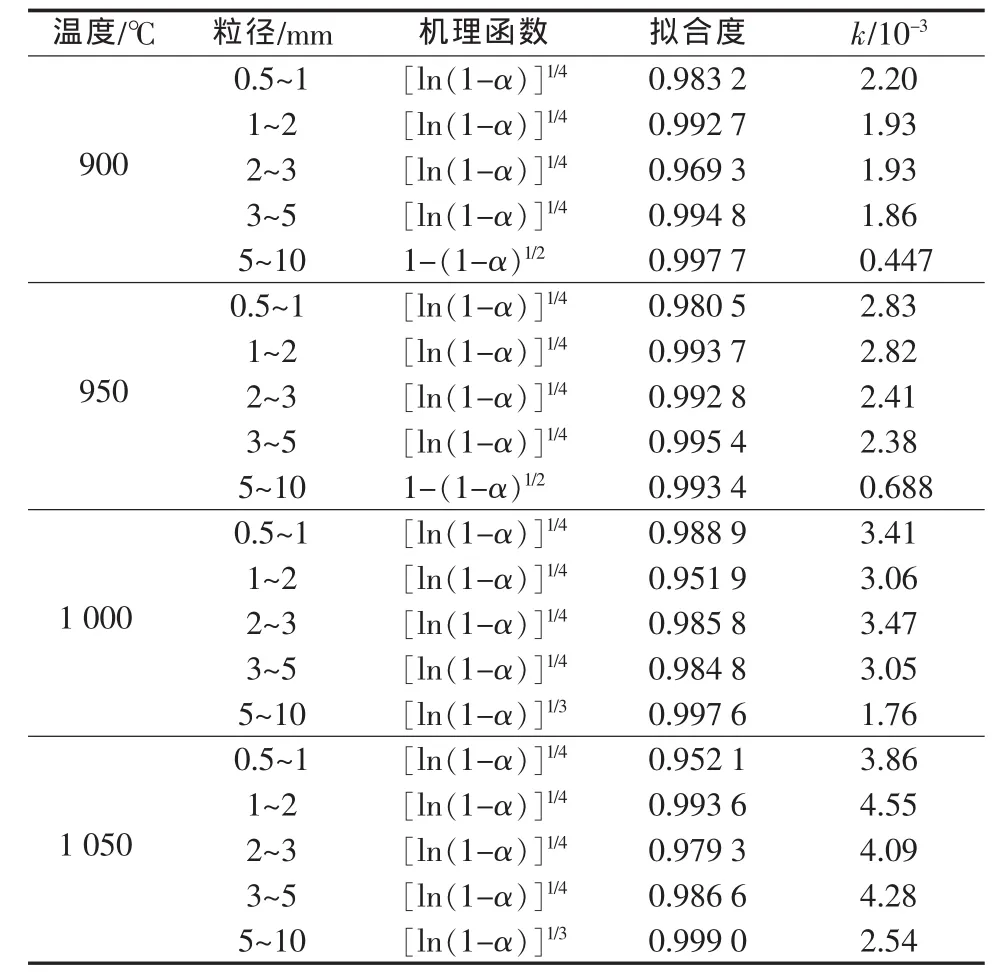
表2 不同溫度下石灰石熱分解動力學機理
由表2可以得到:當石灰石粒徑在0.5~5 mm時,煅燒過程符合隨機成核和隨后生長機理模型(n=1/4),粒徑與溫度變化對機理沒有明顯影響,這與普遍認為的相界面反應機制不同[5,8-9,11],而與文獻[6,10,18]結論類似。
隨機成核和隨后生長模型的物理意義是,反應最初發生在某些局域的點上(晶格缺陷處),隨后這些相鄰的分解產物聚集成一個新物相的核,然后核周圍的分子繼續在核上發生界面反應,舊物相不斷消失,新物相不斷生長和擴展,直至整個固相分解完畢。當反應受新相晶核的形成與長大步驟控制時,通常轉化率與時間的關系呈S形曲線,在反應初期,由于反應界面逐漸增大,反應加速;當反應達到一定程度時,由于各顆粒的反應界面相互重疊,反應界面減小,反應速率也相應逐漸減慢。這與圖1曲線相符合。
對于顆粒粒徑為5~10 mm的石灰石,當溫度為900、950℃時,反應符合圓柱形對稱的相邊界反應機理模型;而當溫度為1 000、1 050℃時,反應符合隨機成核和隨后生長機理模型(n=1/3)。相邊界反應模型的基本觀點認為反應發生在一個無厚度的幾何界面上,隨著反應的進行該界面逐漸向固態試樣內部推進,在這種模型中反應界面收縮速率與氣態產物的傳質速率相比會慢很多。
綜上可以得出,粒徑以及煅燒溫度對反應機理模型都有一定的影響。這是石灰石化學分解、熱傳遞以及CO2擴散共同作用的結果,當粒徑大、溫度低時,這3個因素都會受到一定的阻力,即化學分解以及熱傳遞緩慢,而石灰石內部反應產物CO2擴散困難,這就導致內部局域CO2濃度增高,抑制了石灰石內部的分解[15],使得反應只能從外到內逐層反應,這就變成了相邊界模型。
根據以上最佳的擬合直線,求出反應速率常數k,而對式(1)兩邊取對數,得

對于不同的T就會得到不同的k值,之后擬合出ln k-1/T直線,依據斜率可以求得E,依據截距可以求得A,計算過程曲線如圖3所示。
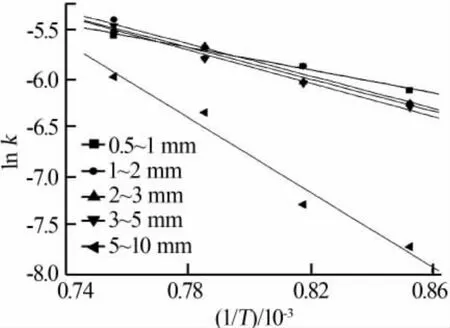
圖3 ln k-1/T擬合直線
表3給出不同粒徑石灰石動力學參數計算結果。由表3可見,粒徑為0.5~1 mm時,活化能很小,這是由于對于小粒徑石灰石的煅燒反應,化學分解因素起主導作用[19],傳熱傳質效果良好,分解反應很容易進行。隨著粒徑的增大,反應活化能并非呈現單一趨勢,而是粒徑在1~5 mm時變化不大,這與文獻[7,12]結論類似,這是因為隨著粒度的增大,比表面積減小,反應速度變慢,活化能增加,但是當粒度增大到一定范圍后,粉末缺陷增多,更易于成核,又會導致活化能的降低[20-21];隨著粒徑的繼續增大(5~10 mm),活化能增大了1倍,這是因為傳熱傳質受到了很大的阻礙,反應只能從外到內逐層進行,使得石灰石煅燒分解變得困難。

表3 不同粒徑石灰石動力學參數
4 結論
1)石灰石粒徑越小、溫度越高反應速率越快,石灰石煅燒完全所需時間越短。當石灰石粒徑為0.5~5 mm時轉化速率曲線相近,而當粒徑更大時曲線變化很大,煅燒完全所需時間明顯延長。2)粒徑為0.5~5 mm的石灰石在煅燒過程中,溫度及粒徑對模型都沒有太大的影響,屬于隨機成核和隨后生長模型(n=1/4);粒徑為5~10 mm的石灰石,當溫度較低時反應模型為圓柱形對稱的相邊界反應模型,而當溫度較高時反應模型變為隨機成核和隨后生長模型(n=1/3)。3)石灰石粒徑為0.5~1 mm時活化能很小;隨著粒徑的增大反應活化能并非呈現單一趨勢,而是粒徑在1~5 mm時活化能變化不大;粒徑繼續增大(5~10 mm)活化能增大了1倍。
[1]Furnas C C.The rate of calcination of limestone[J].Ind.Eng. Chem.,1931,23(5):534-538.
[2]Charles N Satterfield,Frank Feakes.Rates of thermal decomposition of barium carbonate—carbon mixtures[J].AIChE J.,1959,5(1):122-124.
[3]Hills A W D.The mechanism of the thermal decomposition of calcium carbonate[J].Chem.Eng.Sci.,1968,23(4):297-320.
[4]齊慶杰,馬云東,劉建忠,等.碳酸鈣熱分解機理的熱重試驗研究[J].遼寧工程技術大學學報:自然科學版,2002,21(6):689-692.
[5]彭海兒,何福禮.低熱值煤氣活性石灰豎窯及其發展前景[J].南方金屬,2006(6):55-58.
[6]范浩杰,章明川,吳國新,等.碳酸鈣熱分解的機理研究[J].動力工程,1998,18(5):40-43.
[7]仲兆平,Marnie T,章名耀,等.Caroline石灰石熱分解實驗研究[J].燃燒科學與技術,2001,7(2):110-114.
[8]魏鴻恩,羅永勤.粒度對石灰石熱解速率的影響[J].水泥工程,1996(6):29-31.
[9]倪曉奮,劉前鑫.石灰石脫硫的熱重分析研究[J].工程熱物理學報,1995,16(2):253-256.
[10]鄭瑛,陳小華,周英彪,等.CaCO3分解機理和動力學參數的研究[J].華中科技大學學報:自然科學版,2002,30(12):86-88.
[11]王世杰,陸繼東,胡芝娟,等.水泥生料分解動力學的研究[J].硅酸鹽學報,2003,31(8):811-814.
[12]張保生,劉建忠,周俊虎,等.粒度對石灰石分解動力學影響的熱重實驗研究[J].中國電機工程學報,2010,30(2):50-55.
[13]Ar I,Dou G.Calcination kinetics of high purity limestones[J]. Chem.Eng.J.,2001,83(2):131-137.
[14]王乃光,阿娜爾,劉啟旺,等.有機酸鹽強化石灰石濕法煙氣脫硫試驗研究[J].中國電機工程學報,2008,28(17):61-65.
[15]余兆南.碳酸鈣分解的試驗研究[J].熱能動力工程,1997,12(4):278-280.
[16]李道忠.高溫快燒活性石灰的工藝條件研究[J].耐火與石灰,2008,33(5):1-3.
[17]胡榮祖,史啟禎.熱分析動力學[M].北京:科學出版社,2001:127-131.
[18]王春波,李永華,陳鴻偉,等.石灰石煅燒過程中孔隙網絡結構的動態可視化數值模擬[J].中國電機工程學報,2005,25(17):88-92.
[19]Dario Beruto,Alan W Searcy.Use of the Langmuir method for kinetic studies of decomposition reactions:calcite(CaCO3)[J].J. Chem.Soc.Faraday Trans.,1974,70:2145-2153.
[20]日本化學學會.無機固態反應[M].董萬堂,董紹俊譯.北京:科學出版社,1985:64.
[21]王春波,陳傳敏.碳酸鈣直接硫化反應產物層固態離子擴散機理研究[J].中國電機工程學報,2007,27(35):44-48.
聯系方式:shzhang@hust.edu.cn
石原產業關閉新加坡鈦白廠
2013年8月12日,日本最大二氧化鈦生產商石原產業(石原産業株式會社)正式宣布,將于當年8月內關閉其位于新加坡的鈦白生產廠。自2008年金融危機以來,二氧化鈦原材料鈦礦石價格波動劇烈,使不少鈦白生產商承受不小的壓力。石原產業考慮到今后更為嚴峻的價格波動狀況,因此作出上述決定。據悉,國際鈦白生產商巨頭杜邦也正研究對旗下部分高性能產品生產企業進行分割或出售。可以預測,國際鈦白業的重組趨勢正在加速。
賈磊譯自《化學工業日報》2013-08-13
Study on thermal decomposition kinetics of limestone with large particle size
Chen Hai1,Zhang Shihong1,Yang Haiping1,Li Pan1,Chen Hanping1,Zeng Jun2
(1.State Key Laboratory of Coal Combustion,Huazhong University of Science and Technology,Wuhan 430074,China;
2.Thermal Power Plant,General Salt Chemical Plant,Jianghan Petroleum Administrative Bureau)
Thermal decomposition experiments of limestone with five different particle sizes were conducted through thermo gravimetric analyzer to study its calcined characteristics with large particle size.The limestone particle sizes were distributed in the range of 0.5~10 mm,and the temperature was controlled at 900~1 050℃during the experiments.Rresults revealed that the smaller the particle size,the higher the temperature and the faster the decomposition.And the particle size and calcining temperature made an obvious influence on the thermal decomposition mechanism.When the particle size was small and the temperature was high,the reaction was in accordance with the randomly nucleating and nucleus growth model,but in contrast,reaction was in accordance with the phase interface mechanism.When the particle size was at 0.5~1 mm,reaction activation energy was very small,and with the increase of particle size,reaction activation energy increased,while in the range of 1~5 mm,activation energy fluctuated,with the continuous increase of particle size to 5~10 mm,the activation energy doubled.
limestone;thermo gravimetric analysis;particle size;thermal decomposition kinetics
TQ132.32
A
1006-4990(2013)09-0011-04
2013-03-16
陳海(1987—),男,碩士研究生,研究方向為石灰石的煅燒特性。
張世紅
國家自然科學基金創新群體(No:51021065);國家重點基礎研究發展計劃項目(973計劃)(2010CB227003);“十二五”國家科技支撐計劃課題(2011BAD15B05-03);國家重大科學儀器設備開發專題項目(2011YQ120039)。

