吹掃捕集-氣質聯用法測定天然飲用水中揮發性有機物*
羅美中,李苑雯,鄭彥婕,陳素娟,黎永樂
(深圳市計量質量檢測研究院,廣東深圳,518000)
天然飲用水包括天然凈水與礦泉水,是以天然水為原料,經過物理方法過濾、消毒或滅菌之后,密封于容器中可直接飲用的瓶裝飲用水。由于工農業生產和日常生活中有機化合物的廣泛應用,有機污染物導致了水體被污染,并通過食物鏈危害動物和人類健康[1]。有機污染物按照化學性質可以大致分為揮發性和非揮發性兩大類。揮發性有機化合物(volatile organic compounds,VOCs)是由于經常被用作液化燃料和清洗溶劑等工業產品而通過土壤滲入至雨雪水并至地下水中,或者是由于使用氯處理等消毒方式而產生的消毒副產物。
國家標準GB8537—2008《飲用天然礦泉水》規定了理化指標26項、污染物指標6項,其余指標共計40項。該標準對有機化合物的監控較為薄弱,僅采用“耗氧量”作為有機污染物控制指標,與國外標準存有差距。因此,研究我國天然飲用水中有機化合物的檢測技術,有利于填補國內標準的空白,對水源的保護以及天然飲用水的監管、市場準入和消除貿易壁壘有積極意義。目前,有報道關注地下水[2-3]、江河水[4-5]、飲用水[6]等水體中的揮發性污染物,但鮮有針對天然飲用水樣品中的揮發性有機污染物進行調研和分析。本文以天然飲用水為研究對象,采集瓶裝飲用水及其相同水源地的實地采集樣品進行對比分析,研究其中揮發性有機污染物的檢出情況并對來源進行初步探討。
吹掃捕集-氣質聯用法是國內外測定水中揮發性有機物的常用方法,例如美國環保署標準EPA524.2[7]規定了水源水、飲用水中60種揮發性有機污染物的測定方法,檢出限在0.02~0.35 μg/L;李國征等[8]建立了飲用水中揮發性氯化消毒副產物的檢測方法,檢出限為0.02~0.13 μg/L;劉漢林等[9]建立了地表水中22種揮發性有機物的方法,方法檢出限為0.05~100 μg/L。本文在EPA524.2方法基礎上,優化了捕集管類型、吹掃時間和溫度、解吸溫度等實驗條件,降低了方法檢出限,該方法可對天然飲用水中氯化消毒劑副產物、苯系物等35種揮發性有機化合物進行同時測定。
1 實驗部分
1.1 儀器與試劑
Tekmar Stratum PTC吹掃捕集儀,Tekmar SOLATek 72 Muti-Matrix吹掃捕集自動進樣器,Agilent 7890A-5975C氣質聯用儀。Agilent#9(Tenax/Silica Gel/Carboxen)U形捕集阱。
1,2-二氯丙烷、1,2-二氯乙烷、氯苯、1,1,2-三氯乙烷、一氯二溴甲烷、二氯一溴甲烷、間-二甲苯、鄰-二甲苯、對-二甲苯、1,1-二氯乙烷、三氯乙烯、三溴甲烷、乙苯、六氯-1,3-丁二烯、苯、1,2,4-三氯苯、1,2,3-三氯苯、二溴甲烷、鄰二氯苯、1,1,1-三氯乙烷、1,2,3-三氯丙烷、異丙苯、1,1,1,2-四氯乙烷、1,1,2,2-四氯乙烷、2-氯甲苯、對-異丙基甲苯、三氯甲烷、四氯乙烯、四氯化碳、對二氯苯、1,2-二溴乙烷、苯乙烯、萘、1,2,4-三甲苯、甲苯、氟代苯、1,2-二氯苯-d4、4-溴氟苯等標準品,購自德國Dr.Ehrenstorfer,純度均大于99%。甲醇為色譜純(德國Merck)。試劑用水為蒸餾水加熱煮沸30 min后吹入氮氣15 min,現用現制。
1.2 樣品采集和分析
1.2.1 樣品的采集
(1)市售瓶裝飲用水樣品:在廣東省內大型超市購買瓶裝天然飲用水共44個 (生產地包括深圳、佛山、中山、江門、汕頭、惠州、河源等城市,共34個品牌;(2)水源水樣品:2011年12月實地采集共5個水源水樣品(其中惠州1個,深圳4個),樣品采集后于冰塊降溫保存,到實驗室后4℃保存,14 d內分析[7]。
1.2.2 吹掃捕集條件
捕集管#9;載氣:氮氣;吹掃溫度40℃;吹掃時間10 min,流量40 mL/min;解吸溫度250℃;解吸時間2 min;解吸流量300 mL/min;烘烤溫度260℃;烘烤時間25 min;烘烤流量400 mL/min。
1.2.3 氣相色譜條件
氣相色譜柱:DB-1701,30 m×0.32 mm×0.25 μm。載氣為氦氣,流速1.0 mL/min;進樣口溫度270℃;不分流進樣;初始溫度35℃(1.0 min),4℃/min升溫至180℃(3.0 min),20℃/min升溫至225℃(0.5 min)。本方法的色譜條件下,間二甲苯和對二甲苯不能分離,以兩者的總量計算。
1.2.4 質譜條件
EI源,電子能量70 eV;離子源溫度200℃;全掃描模式,掃描范圍(m/z)40~300。
1.2.5 實驗步驟
取5 mL樣品至40 mL棕色玻璃樣品瓶,螺旋蓋具聚四氟乙烯墊片后,加入5.0 μg/mL氟代苯(內標物)40 μL,放入吹掃捕集裝置中進行分析。各平行測定樣品3個,伴隨1個現場空白樣品[10]。
2 結果與討論
2.1 條件優化
2.1.1 色譜分離
根據所選的色譜柱優化實驗的氣相色譜的條件。為空白樣品中加入35種揮發性有機化合物(50pg)的總離子流色譜圖。
2.1.2 吹掃溫度優化
優化了吹掃溫度,以六氯-1,3-丁二烯、三氯甲烷、對二氯苯、甲苯、萘作為本研究化合物的代表作圖。由圖2可見,當溫度從30℃增加至40℃時,目標物的萃取量增加,吹掃效率提高,其中分子量較小的物質如三氯甲烷、甲苯的萃取量增加明顯。這是由于吹掃溫度的提高,有利于提高蒸汽壓,因而提高吹掃效率。當溫度增加至50℃時,分子質量較大的目標物,如多環芳烴萘,其吹掃效率進一步提高,但其他分子質量較其小的目標物的吹掃效率則存在下降的現象。當實驗優化后,選擇40℃為吹掃溫度。

圖1 揮發性有機化合物的總離子流色譜圖(50 pg)Fig.1 Total ion current chromatogram of the mixture standard of the contaminants注:色譜峰的序號對應表1。

圖2 吹掃溫度對峰面積的影響Fig.2 Effect of the purge temperature on the peak area
2.1.3 吹掃時間優化
吹掃時間是吹掃捕集技術的重要參數之一。優化了吹掃時間,以六氯-1,3-丁二烯、三氯甲烷、對二氯苯、甲苯、萘作為本研究化合物的代表,實驗結果見圖3。吹掃時間為2 min時,大部分目標化合物得到較好的吹掃,得到較高的響應。當繼續增加吹掃時間至10 min,吹掃的總流量為400 mL,獲得最好的吹掃效果。吹掃時間越長,分析重現性和靈敏度越高,但同時帶入更多的水分吹掃到捕集阱中,影響分析結果和減少捕集阱的壽命。根據結果選擇吹掃時間為10 min。
2.1.4 解吸時間的優化
吹掃和捕集之后,通過快速加熱吸附管將其中的揮發性物質熱解吸出來并輸送進入氣相色譜分離柱中。優化解吸時間為0.5~4 min,以六氯-1,3-丁二烯、三氯甲烷、對二氯苯、甲苯、萘作為本研究化合物的代表,實驗結果見圖4。0.5~2 min,解吸效果逐漸達到最佳值,當解吸時間繼續增加至3 min時,解吸效果呈現下降趨勢。
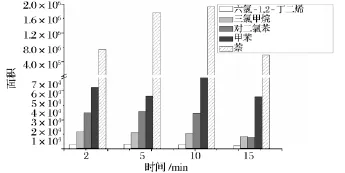
圖3 吹掃時間對峰面積的影響Fig.3 Effect of the purge time on the peak area
2.2 方法的檢出限、回收率和精密度
采用優化的方法,測定不同濃度的35種揮發性有機化合物,繪制標準曲線。所有物質在0.50~50.0 μg/L內均獲得良好的線性和相關系數,方法檢出限范圍為0.05 ~0.17 μg/L,樣品加標5 μg/L 測定回收率和RSD,測定回收率為86.5% ~113%,RSD(n=6)為1.6% ~6.1%,結果見表1。

圖4 解吸時間對峰面積的影響Fig.4 Effect of the desorb time on the peak area

表1 35種揮發性有機化合物方法的檢出限、回收率和RSD(n=6)Table 1 The limits of the detection,the recoveries,the RSD of the 35 VOC
2.3 樣品調研
采用本文建立的方法測定采集的全部樣品,35種被檢測的化合物中,共檢出1,2-二氯乙烷、一氯二溴甲烷、二氯一溴甲烷、三溴甲烷、苯、三氯甲烷、1,2,4-三甲苯、甲苯8個化合物,檢出結果見表2。所檢出化合物的含量在GB5749—2006《生活飲用水衛生標準》和WHO的《飲用水水質準則》[11]的限量要求范圍內。三氯甲烷是檢出率最高的揮發性有機化合物,檢出率為49%。其他檢出率較高的化合物包括三溴甲烷、一氯二溴甲烷、二氯一溴甲烷等三鹵甲烷類化合物(trihalomethans,THMs)。根據報道,瓶裝飲用水中THMs的成因可能是來自天然來源或者人為因素造成[12]。
為進一步研究所檢出化合物的來源,實驗選取來自相同水源地的瓶裝水樣品和水源水樣品進行對比,實驗結果見表3。由表3可見,實驗選取了2個不同品牌瓶裝水飲用水A1和A2,分別隨機抽取6個不同批次的樣品,并非所有批次樣品中均檢出相同化合物;另外,品牌 A1和 A2對應的水源水樣品 B1和B2,均未檢出以上化合物。由此可推斷THMs不是天然存在,可能來源于生產過程產生的消毒劑副產物(Disinfection by-products,DBPs)[13-15],加氯處理和臭氧化處理均有可能產生THMs或溴代THMs[4]。
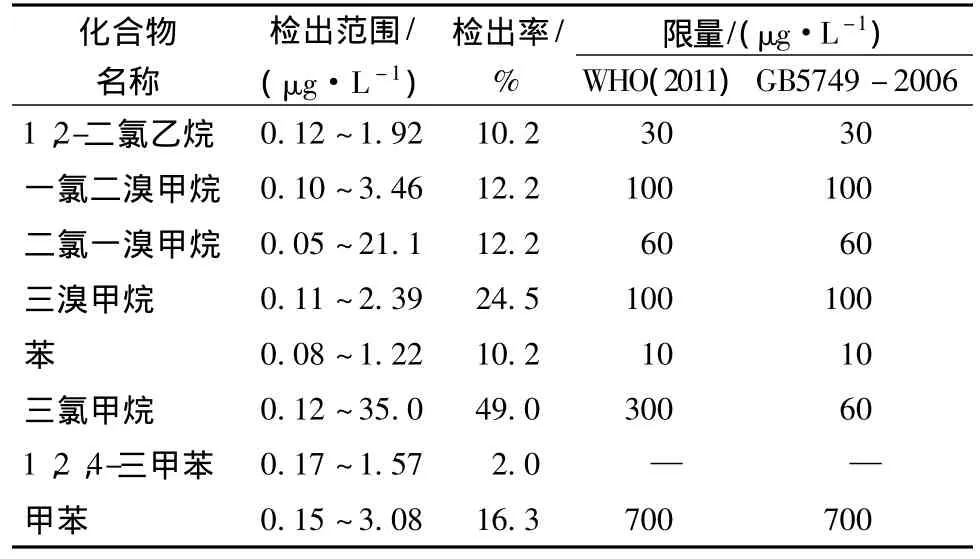
表2 天然飲用水中有機化合物的檢出結果Table 2 The results obtained from the analysis of the natural drinking water samples
此外,在瓶裝天然飲用水中還檢出苯、甲苯等苯系物,但在天然水源水中并未檢出。有研究指出,瓶裝飲用水中的苯類化合物可能來源于使用的聚對苯二甲酸類塑料(polyethylene terephthalate,PET)塑料瓶所產生[16]。本文所購買的瓶裝天然飲用水的包裝材料均為采用PET,但其確切來源尚需進一步的實驗再確定。
3 結論與展望
本方法前處理避免了使用大量有機溶劑進行富集濃縮,結合氣相色譜/質譜聯用法,能快速、靈敏地應用于天然飲用水中VOCs的測定。采集和測定了市售的44批次瓶裝天然飲用水和5個水源水樣品,天然水源水中沒有測得揮發性有機化合物。瓶裝天然飲用水中檢出部分揮發性化合物,檢出量符合相關WHO和國內相關標準的限量規定。但部分樣品中檢出三鹵甲烷,其中三氯甲烷的檢出率達到49%,應當引起對飲用水中消毒副產物的關注,加強對揮發性有機污染物的監測。另測得瓶裝天然飲用水中部分批次含有苯系物,但需繼續擴充檢測樣品的范圍和數量,再對其來源作進一步考察和分析。

表3 瓶裝天然飲用水樣品與來自相同水源地的水源水樣品測定結果的對比Table 3 The results obtained from the analysis of bottled water samples and the source water sample from the same water source
[1] Food safety/Chemical risks in food/Persistent Organic Pollutants(POPs)[M/OL].14 November 2011.http://www.who.int/foodsafety/chem/pops/en/.
[2] 胡璟珂,沈加林,馬健生.吹掃捕集 -氣相色譜-質譜法測定地下水中揮發性有機物[J].理化檢驗-化學分冊,2009,45:281-287.
[3] 黃毅,李國傲,饒竹,等.城市環境地下水調查樣品中揮發性有機物測定[J].質譜學報,2012(33):301-307.
[4] 馬先鋒,劉慕凡,施敏芳,等.吹掃捕集-氣相色譜質譜法分析漢江有機污染物[J].分析科學學報,2011(27):536-538.
[5] 李敏,余泳紅,陳慶勝.吹掃捕集-氣質聯用法測定廣州市蘿崗區井水中揮發性有機物[J].2011(21):1 626-1 627.
[6] 羅添,周志榮,林少彬.吹掃捕集氣相色譜質譜法測定飲用水中揮發性有機物[J].衛生研究,2006(35):504-507.
[7] Eichelberger J W,Munch J W,Bellar T A.EPA 524.2:Measurement of purgeable organic compounds in water by capillary column gas chromatography/mass spectrometry[S].Revision 4.1.Cincinnati,OH:US Environmental Protection Agency,1995.
[8] 陳國征,徐偉,林怡.吹掃捕集-氣相色譜/質譜法測定飲用水中揮發性氯化消毒副產物[J].中國衛生檢驗雜志.2012,22(9):2 069 -2 070.
[9] 劉漢林,劉立峰,王成娟.吹掃捕集/GC-MS聯用法分析地表水中揮發性有機物[J].分析儀器,2012(4)87-91.
[10] 周懷東,劉玲花,高繼軍,等.SL 393-2007:吹掃捕集氣相色譜/質譜分析法(gc/ms)測定水中揮發性有機污染物[M].中國:中國水利水電出版社,2007.
[11] World Health Organization.Guidelines for drinking-water quality,forth edition[S].Geneva:World Health Organization.2011.
[12] Hoekstra E G ,De-Leer E W B,Brinkman U A T.Natural formation of chloroform and brominated trihalomethanes in soil[J].Environmental Science Technology,1998,32:3724-3729.
[13] 劉艷芳,王啟山,魯金鳳,等.原水天然有機物化學特性與消毒副產物關系[J].水處理技術,2010,36(2):25-32.
[14] 韓暢,劉紹剛,仇雁翎,等.飲用水消毒副產物分析及相關研究進展[J].環境保護科學,2009,35(1):12-16.
[15] 董麗麗,黃駿雄.飲用水消毒副產物及其分析技術[J].化學進展,2005,2(17):350-358.
[16] Cristina B,Xavier D,Marie-Christine C,et al.Chemical migration in drinking water stored in polyethylene terephthalate(PET)bottles:a source of controversy[J].Water Research,2012,46(3):571-583.

