靜脈注射免疫球蛋白對宮內感染胎鼠腦組織Toll樣受體4表達影響的實驗研究
戴夢穎, 李曉捷, 孫奇峰
腦性癱瘓(簡稱腦癱)是由于發育中胎兒或嬰兒腦的非進行性損傷所致持續性運動和姿勢發育異常、活動受限的一組綜合征[1]。常并發感覺、知覺、認知、交流、行為紊亂、癲癇、繼發性肌肉與骨骼問題。近年來大量臨床觀察與流行病學研究發現:腦白質損傷(white matter damage,WMD)作為引起腦癱臨床表現的重要原因,與宮內感染的關系極為密切。Toll樣受體4(Toll-like receptor 4,TLR4)廣泛分布在腦室周圍血管叢、小膠質細胞和星形膠質細胞上,與中樞神經系統炎癥反應關系密切,是革蘭陰性菌細胞壁成分脂多糖(lipopolysaccharide,LPS)的主要效應受體。本實驗通過對宮內感染后孕鼠及時給予注 射 免 疫 球 蛋 白 (intravenous immune globulin,IVIG),觀察子代鼠腦內TLR4表達量變化,以了解IVIG對宮內感染子鼠腦損傷的影響。
1 材料與方法
1.1 實驗動物 清潔級成熟SD雌性大鼠40只,雄性大鼠20只,體質量300~500g,大連醫科大學動物實驗中心提供,動物質量合格證:SCXK(遼)2008-0002。
1.2 實驗材料 LPS為大腸埃希菌055:B5菌株(1mg/mL)(美國Sigma公司),TLR4多抗(美國Santa Cruz公司)。
1.3 動物分組 選取40只健康雌性SD大鼠,于發情期以2∶1比例與雄鼠合籠過夜,于次日觀察到陰栓為孕第1日,孕鼠分籠喂養。按隨機數字表法分為對照組8只,實驗組16只,干預組16只。
1.4 實驗方法
1.4.1 模型制備 LPS凍干粉溶于100mL滅菌生理鹽水中,配成200mg/L溶液,震蕩搖勻,4℃保存備用。分別在實驗組及干預組孕鼠妊娠第17天時注射LPS 350μg/kg,以取材時觀察到孕鼠子宮壁、胎盤充血水腫為造模成功。干預組于造模成功后3h取孕鼠后尾靜脈注射IVIG 2g/kg 1次。
1.4.2 標本的留取及保存 各組于妊娠18、19、21d迅速處死1/4數量大鼠,冰盒上剖腹取胎鼠,稱重后給予1%戊巴比妥腹腔注射后斷頭取腦。生后1d子鼠處理方法同胎鼠。一半數量的腦組織置于4%多聚甲醛(pH 7.2~7.4)中室溫固定24h后進一步透明、包埋、制成蠟塊并切片。雌鼠處死后取胎盤蘇木精-伊紅染色觀察病理變化。另一部分取出后迅速放入液氮中,次日在放置到-70℃冰箱中長期保存。
1.5 觀察指標
1.5.1 胎盤及幼鼠腦組織蘇木精-伊紅染色 取對照組、干預組和實驗組各個時間點雌鼠胎盤組織及幼鼠腦組織甲醛固定后石蠟包埋切片,進行蘇木精-伊紅染色。
1.5.2 Real time-PCR法檢測腦組織TLR4 將腦組織勻漿后提取總RNA,逆轉錄合成cDNA,將反應體系(cDNA 1μL,SYBR Greeen 10μL,上下游引物各0.5μL,DEPC-H2O 8μL)加入到7500型PCR儀反應板的反應孔中,按操作流程操作。β-actin引物序列上游5'-ATT GGG GCA GTA GCA GAT GA-3',下游5'-GGA AAT CGT GCG TGA CAT TA-3',退火溫度為61℃。TLR4引物序列上游5'-TCG TTT CTC ACC CAG TCC TC-3',下游5'-TCA GTG TGC TTG TGG TAG CC-3',退火溫度為59.8℃。
1.5.3 免疫組織化學法測定TLR4 各組石蠟包埋組織切片6張,片厚5μm,其中5張行TLR4免疫組織化學染色,1張用磷酸緩沖鹽溶液代替一抗作陰性對照。用Image Pro Plus 4.5圖像分析軟件計數TLR4表達積分光密度(IOD)。每張切片選取6個位置相應但不重復的視野均值作為該片IOD,每組選取6張切片。
1.6 統計學方法 采用SPSS 19.0統計軟件進行統計,計量資料以±s表示,多組間比較采用單因素方差分析,兩組比較采用LSD方法,多個均數之間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 孕鼠及子鼠情況 本次實驗共納入孕鼠40只,其中實驗組及干預組各16只,對照組8只。注射前后各組孕鼠活動、攝食正常,無一例出現死亡。未提前剖宮產的孕鼠孕期均超過21d,無一例在剖宮產前出現陰道流血,活動減少等分娩跡象。實驗組在注射LPS之后,胎鼠及幼鼠死亡數量逐漸增加。干預組胎鼠及幼鼠也出現一定數量的死亡數,但每個時間點死亡數量均較實驗組低。對照組胎鼠及幼鼠死亡率最低。見表1。
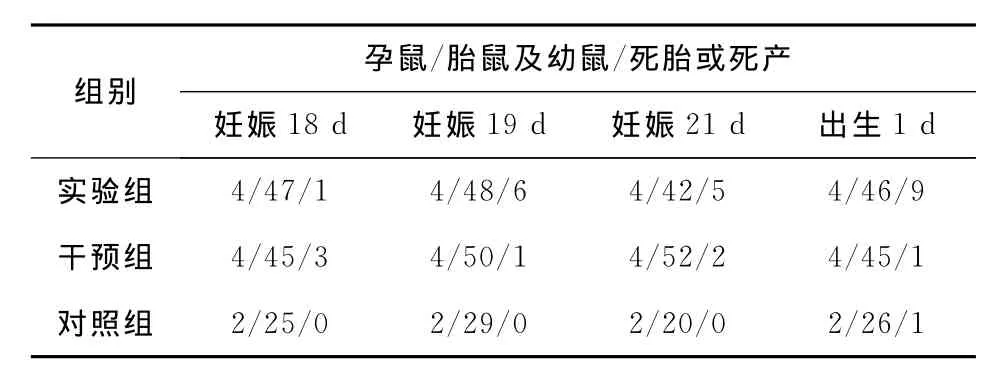
表1 分組及子鼠數量情況(n)
2.2 體質量方面 實驗組胎鼠及幼鼠在注射LPS后體質量增加幅度與對照組相比逐漸落后。干預組胎鼠及幼鼠體質量也出現增長幅度減小的現象,但減小程度不及實驗組。實驗組胎鼠剖出時顏色青紫,活動力差,刺激有反應。死胎則出現較嚴重水腫,且較活胎個頭小。干預組胎鼠剖出后,顏色紅,有主動張口等動作。對照組胎鼠剖出后顏色粉紅,活動力強,能主動張口及運動四肢。子鼠體質量比較見表2。
表2 各組胎鼠及幼鼠體質量比較±s,g)
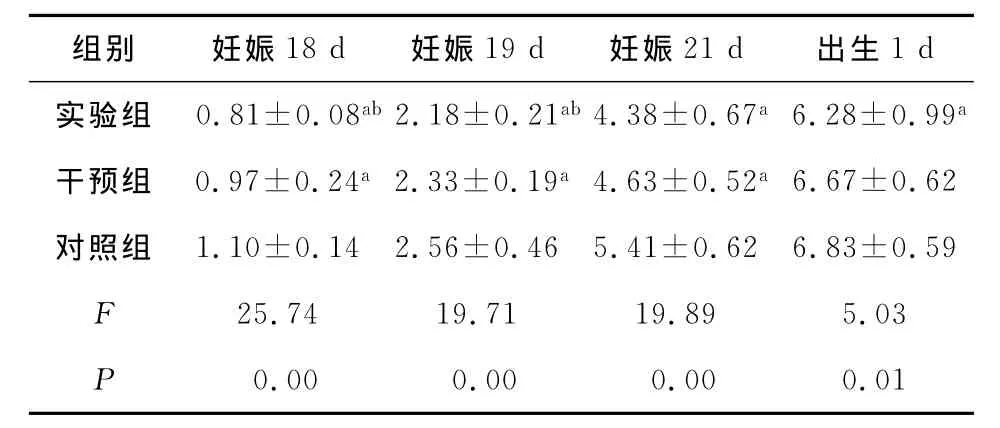
表2 各組胎鼠及幼鼠體質量比較±s,g)
注:與對照組比較,aP<0.01;與干預組比較,b P<0.01。
組別 妊娠18d 妊娠19d 妊娠21d 出生1d實驗組 0.81±0.08ab 2.18±0.21ab 4.38±0.67a6.28±0.99a干預組 0.97±0.24a2.33±0.19a4.63±0.52a6.67±0.62對照組 1.10±0.14 2.56±0.46 5.41±0.62 6.83±0.59 F 25.74 19.71 19.89 5.03 P 0.00 0.00 0.00 0.01
2.3 胎盤組織病理切片 對照組胎盤組織色澤鮮紅,血供豐富,可見大量滋養細胞與紅細胞,毛細血管間質薄,無明顯炎癥細胞浸潤。實驗組血管間質明顯增生變厚,管腔不規則,毛細血管腔狹小,血供減少,并可見大量炎性細胞浸潤。干預組胎盤血供較實驗組豐富,但仍可見炎性細胞,病理改變介于實驗組和對照組之間。
2.4 腦組織病理切片 實驗組鼠腦組織切片可見部位組織疏松,細胞成分明顯減少,神經細胞間隙增寬,多為體積小、少突起、核小、深染、核仁不清的欠分化神經元,并有局灶性出血。白質內神經纖維走向紊亂、粗細不均勻。對照組早期無明顯水腫細胞,后期細胞成分明顯多于實驗組,神經纖維紋理清晰,有條理。IVIG干預組早期神經元細胞水腫較實驗組減輕,后期細胞成分也較實驗組明顯增多。
2.5 TLR4-mRNA 含量 實驗組 TLR4-mRNA表達量在妊娠18d時達到高峰,與對照組和干預組比較差異有統計學意義(P<0.01),隨后逐漸降低。到妊娠21d時與對照組比較差異無統計學意義(P>0.05)。干預組 TLR4-mRNA 在妊娠18d時出現一過性增高,妊娠19d時,與對照組比較差異無統計學意義(P>0.05)。至出生后1d,實驗組和干預組再次出現增長高峰,與對照組比較差異有統計學意義(P<0.01)。見表3。
2.6 TLR4蛋白水平的測定 TLR4蛋白水平增加緊隨TLR4-mRNA的增加而增加。實驗組在檢測的4個時間點內TLR4水平與對照組比較,差異有統計學意義(P<0.01)。干預組在妊娠18、19d出現TLR4顯著增高后TLR4水平與對照組比較差異無統計學意義(P>0.05)。見表3。
表3 各組胎鼠及幼鼠腦內不同時間TLR4蛋白和TLR4-mRNA的表達±s)
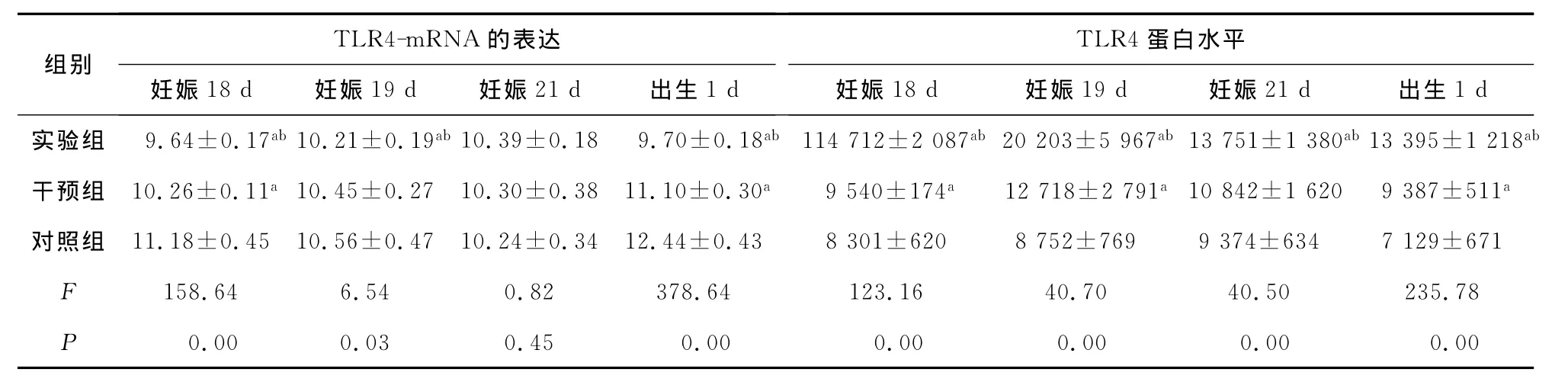
表3 各組胎鼠及幼鼠腦內不同時間TLR4蛋白和TLR4-mRNA的表達±s)
注:與對照組比較,aP<0.01;與干預組比較,b P<0.01。
組別TLR4-mRNA 的表達妊娠18d 妊娠19d 妊娠21d 出生1d TLR4蛋白水平妊娠18d 妊娠19d 妊娠21d 出生1d實驗組 9.64±0.17ab 10.21±0.19ab 10.39±0.18 9.70±0.18ab 114 712±2 087ab 20 203±5 967ab 13 751±1 380ab 13 395±1 218ab干預組 10.26±0.11a10.45±0.27 10.30±0.38 11.10±0.30a 9 540±174a 12 718±2 791a10 842±1 620 9 387±511a對照組 11.18±0.45 10.56±0.47 10.24±0.34 12.44±0.43 8 301±620 8 752±769 9 374±634 7 129±671 F 158.64 6.54 0.82 378.64 123.16 40.70 40.50 235.78 P 0.00 0.03 0.45 0.00 0.00 0.00 0.00 0.00
3 討論
WMD可以導致患兒出現腦癱、癲癇、精神發育遲滯等問題。人WMD損傷的高危時間窗大約為23~34周,即在髓鞘形成之前,少突膠質細胞前體分化成熟的時期,所以本實驗選擇80%胎齡(大鼠的孕期一般在21~23d,即孕17d)進行干預。旨在直接造成WMD。
目前認為,宮內感染多由體內最常見的條件性致病菌大腸桿菌導致[2],其LPS起重要作用。孕鼠出現宮內感染后,子宮及胎盤的供血不足,造成子鼠的體質量減輕[3]。本實驗結果顯示:由LPS造成的宮內感染,可導致子宮壁及胎盤的充血水腫,功能不良。而炎癥反應對胎盤的功能影響又直接作用于胎鼠的血液循環,使其血壓不穩,造成過量灌注或灌注不足,繼而引起腦組織水腫或顱內出血。
LPS作為第一信使激活單核細胞系內的第二信號系統,使其釋放大量TNF-α、IL-6等細胞因子,使得兩屏障的通透性增加,造成LPS進入子鼠腦內。且宮內感染引起的循環低血壓。與細胞因子的表達呈負相關[4]。這一系列的變化能直接上調TLR4-mRNA的表達[5],使得腦內 TLR4的含量增加,小膠質細胞等細胞內的第二信使激活,釋放大量細胞因子,造成少突膠質前體細胞損傷。
TLR4在胎齡1周時開始出現表達[6]。在神經系統中TLR4廣泛分布在腦室周圍血管叢、小膠質細胞、星型膠質細胞[6],其中以小膠質細胞為主。小膠質細胞被廣泛認為是神經系統內的主要免疫效應器[7]。LPS與TLR4結合后激活一系列細胞因子。進而對少突膠質前體細胞產生毒性作用,誘導其凋亡,影響髓鞘的形成,從而導致腦白質軟化。Lehnardt等[7]發現LPS作用于先天TLR4缺陷的鼠不能引起少突膠質前體細胞降低,進而證實TLR4為LPS誘導少突膠質細胞損傷所必需。TLR4的表達量與入腦LPS的劑量和時間窗有關[8]。本實驗選擇LPS注射后24h進行觀察,見24h時已經TLR4的水平升高的結果,其表達量逐漸減少。而出生后TLR4-mRNA的表達量又出現升高,考慮可能與子鼠宮內發育較差,經陰道分娩時出現再次缺氧有關。該結果與國外報道的:“經剖宮產產出的宮內感染患兒患WMD的概率減小”[9]的結果符合。
IgG可保護神經系統:在腦卒中的大鼠模型中,靜脈注射IgG可以有效保護神經元,通過中和補體來達到減少受損神經元數目的目的[10]。大鼠腦中生理量的非特異性單體IgG可以通過增加神經小膠質細胞的內吞作用并釋放腫瘤壞死因子等方式來起到保護神經細胞的作用。神經細胞本身所產生的IgG也參與到神經系統本身清除異己抗原的免疫反應中。在阿爾茲海默小鼠模型中發現IgG可以與FcRn協同作用[10],清除中樞中的β肽淀粉樣蛋白與抗β肽淀粉樣蛋白的抗原抗體復合物。而存在于腦內的IgG可以使細菌更易受調理素作用,隨之被小膠質細胞吞噬[10]。
本實驗在LPS注射后3h給予IVIG干預。大量免疫球蛋白通過中和母血中LPS,減少透過胎盤屏障LPS的量,進而減少LPS入腦的量。由于LPS激活TLR4的過程有劑量依賴性,所以減少LPS入腦即減少了TLR4的表達,進而減輕了TLR4下游的整個炎癥反應過程。同時由于IgG本身分子量小,部分IgG可入腦,繼續中和腦內炎性因子和LPS,從而減輕炎性細胞因子對少突膠質前體細胞毒性作用所致的凋亡,為日后髓鞘的形成提供了細胞數量保障。
本實驗通過減少第一信使,使第二信使的激活減少,引起效應細胞因子分泌量下降,而注射入體內的IgG本身又具有中和細胞因子的作用,從兩條途徑上減少對少突膠質前體細胞的毒性作用。保障腦組織正常髓鞘化,進而達到腦保護的作用。但由于神經細胞本身也有分泌IgG的能力[11],發揮作用的IgG有多少來自于干預,多少源自神經組織自分泌還需做進一步的深入探討。
[1] 李曉捷.實用小兒腦性癱瘓康復治療技術[M].北京:人民衛生出版社,2009:2-3.
[2] Sheiner E,Mazor-Drey E,Levy A.Asymptomatic bacteriuria during pregnancy[J].J Matern Fetal Neonatal Med,2009,22(5):423-427.
[3] Rosenkranz K,May C,Meier C,et al.Proteomic analysis of alterations induced by perinatal hypoxic-ischemic brain injury[J].J Proteome Res,2012,11(12):5794-5803.
[4] Yanowitz TD,Jordan JA,Gilmour CH,et al.Hemodynamic disturbances in premature infants born after chorioamnionitis:association with cord blood cytokine concentrations[J].Pediatr Res,2002,51(3):310-316.
[5] Ock J,Jeong J,Choi WS,et al.Regulation of Toll-like receptor 4expression and its signaling by hypoxia in cultured microglia[J].J Neurosci Res,2007,85(9):1989-1995.
[6] Rivest S.Molecular insights on the cerebral innate immune system[J].Brain Behav Immun,2003,17(1):13-19.
[7] Lehnardt S,Lachance C,Patrizi S,et al.The toll-like receptor TLR4is necessary for lipopolysaccharide-induced oligodendrocyte injury in the CNS[J].J Neurosci,2002,22(7):2478-2486.
[8] Lee SJ,Lee S.Toll-like receptors and inflammation in the CNS[J].Curr Drug Targets Inflamm Allergy,2002,1(2):181-191.
[9] Yanowitz TD,Jordan JA,Gilmour CH,et al.Hemodynamic disturbances in premature infants born after chorioamnionitis:association with cord blood cytokine concentrations[J].Pediatr Res,2002,51(3):310-316.
[10] Salminen A,Paananen R,Vuolteenaho R,et al.Maternal endotoxin-induced preterm birth in mice:fetal responses in tolllike receptors,collectins,and cytokines[J].Pediatr Res,2008,63(3):280-286.
[11] Niu N,Zhang J,Guo Y,et al.Expression and distribution of immunoglobulin G and its receptors in the human nervous system[J].Int J Biochem Cell Biol,2011,43(4):556-563.

