長期遞增負荷運動中骨髓和胸腺趨化因子CCR9、CCL25的應答性特征
張 琳, 郝選明
(華南師范大學體育科學學院,廣東廣州510631)
長期遞增負荷運動中骨髓和胸腺趨化因子CCR9、CCL25的應答性特征
張 琳, 郝選明
(華南師范大學體育科學學院,廣東廣州510631)
目的:研究對骨髓和胸腺細胞具有歸巢作用的趨化因子受體CCR9和配體CCL25在長期遞增負荷運動中的應答性特征,探討長期運動影響T細胞發育的調節機制。方法:將SD大鼠隨機分為運動組和對照組,運動組進行遞增負荷跑臺訓練6周,每周6次,每天30 m in。第1周運動負荷為10 m.m in-1,第2周為20 m.m in-1,此后每周增加5 m.m in-1,至6周時達40 m.m in-1。分別于第0、2、4、6周末,利用ELISA技術測定安靜狀態、運動后即刻和運動后3 h骨髓和胸腺中CCR9和CCL25表達水平。結果:骨髓和胸腺中的CCR9、CCL25呈現幾乎相反的應答性變化。結論:隨著遞增負荷運動的進程,骨髓中的趨化因子受體CCR9和配體CCL25總體水平越來越高,且越來越難以恢復,表明骨髓歸巢因子信號需求越來越強;而胸腺CCR9、CCL25總體水平越來越低,越來越難恢復,表明胸腺微環境紊亂程度越來越高。這應是受長期遞增負荷運動影響,T細胞歸巢及發育受阻且功能逐步下降的重要機理之一。
遞增負荷運動;運動性免疫抑制;趨化因子;骨髓;胸腺;免疫調節
Author’s addressSchool of Physical Education&Sports Science,South China Normal University,Guangzhou 510631,Guangdong Province,China
T細胞在胸腺增殖分化和成熟,但胸腺細胞沒有自我更新能力,因此,骨髓中的造血祖細胞需要歸巢于胸腺才能維持T細胞的發育。祖細胞從骨髓歸巢入胸腺的過程類似于成熟白細胞的歸巢,包括選擇素介導對脈管內皮的弱黏附,再通過整合素的強黏附,以及祖細胞滲出[1-2]。這些一系列定向的、協調有序的歸巢事件需要細胞間相互作用以及多種因子的參與[3],其中選擇素介導對脈管內皮的弱黏附過程必須伴隨趨化因子信號。CC趨化因子配體25(CC chemokine ligand 25,CCL25)是新近發現的CC趨化因子家族成員。已有研究結果顯示,趨化因子CCL25及其受體CC趨化因子受體9(CC chemokine receptor 9,CCR9)參與骨髓T前體細胞歸巢入胸腺[4],以及未成熟胸腺細胞在胸腺基質中的遷移[5]。本實驗對這些具有歸巢作用的趨化因子進行研究,觀察它們在6周遞增負荷運動中應答與恢復特征,為運動性免疫抑制的調節機制提供研究基礎。
1 材料與方法
1.1 實驗對象 8周齡雄性SD大鼠128只(購自廣東中醫藥大學實驗動物中心,許可證號為粵SCXK2008-0020,No.0043379,粵 監 證 字F2008A002),隨機將其分為對照組和實驗組。對照組32只,正常喂養,不進行運動干預,分別于第0、2、4、6周(WK0、WK2、WK4和WK6)取樣,測試相同指標,用于判別大鼠生長對各指標的影響。實驗組96只進行6周遞增負荷跑臺運動訓練。
1.2 運動訓練與取樣 遞增負荷跑臺訓練6周,每周6 d,每天1次,每次30 min。第1周運動負荷為10 m·min-1,第2周為20 m·min-1,隨后,每周遞增負荷增量5 m·min-1,至第6周,達到40 m·min-1最大負荷強度。取樣時間:第0周,即未經訓練的大鼠于安靜狀態(A)、一次性運動(10 m·min-1,30 m in)后即刻(J)及運動3 h取樣;第2、4、6周,每周最后一次訓練完成后48 h取樣,取樣日進行與上周相同負荷的跑臺運動,分別在安靜狀態(A)、運動后即刻(J)、運動后3 h(3 h),無菌取大鼠骨髓和胸腺。
1.3 測試指標及方法 運用ELISA方法測定歸巢因子骨髓和胸腺CCL25、CCR9水平,ELISA試劑購自武漢華美公司,嚴格按照試劑盒說明操作。
1.4 統計學處理 所有數據用平均數±標準差(X—± SD)表示,用PASW Statistics 17.0統計軟件進行統計處理;組間比較采用單因素方差(one-way ANOVA)分析,P<0.05為差異具有顯著性的統計學意義。
2 實驗結果
2.1 各周對照組骨髓、胸腺組織CCR9、CCL25的變化狀態(圖1) 實驗結果表明,各對照組(C組)骨髓和胸腺組織中的CCR9、CCL25各周之間無顯著性差異(P>0.05),可以認為6周生長對這些指標無顯著影響。以下主要探討各周各組對運動訓練的應答性特征。

圖1 各周對照組骨髓、胸腺組織CCR9、CCL25的變化情況Figure 1. Changes of CCR9 and CCL25 in Bone Marrow and Thymus of Control Group in Different Weeks
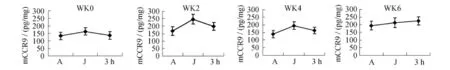
圖2 骨髓CCR9各周應答性變化情況Figure 2. Response of CCR9 in Bone Marrow in Different Weeks
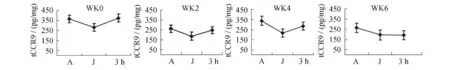
圖3 胸腺CCR9各周應答性變化情況Figure 3. Response of CCR9 in Thymus in Different Weeks
2.2 骨髓、胸腺組織CCR9的應答性變化(圖2、圖3)大鼠在6周遞增負荷的跑臺訓練中,骨髓和胸腺中的CCR9呈現幾乎相反的應答性變化:負荷初次應答的第0周,以及第2周末和第4周末運動即刻均明顯上升,恢復3 h下降,呈倒“V”型應答曲線;第6周末,則在運動后呈持續升高趨勢。在遞增負荷的不同階段它們的應答幅度也不同:第0周J組大鼠骨髓CCR9含量與A組相比上升(P<0.05),運動后3 h組下降,略高于A組(P>0.05);第0周J組大鼠胸腺組織CCR9含量與A組相比下降(P<0.01),運動后3 h組恢復。各運動組在第2周、4周骨髓CCR9含量均高于A組(P<0.05或P<0.01),其中第2周和第4周J組與A組比較均顯著性上升(P<0.01),3 h組與J組相比下降(P<0.01),但均高于A組。J組、3 h組在第2周、4周胸腺CCR9含量低于A組(P<0.01),3 h組與J組相比上升(P<0.01),但均低于A組。在第6周各運動組骨髓CCR9含量高于A組(P<0.01),且3 h組仍高于J組(P>0.05);在第6周各運動組胸腺CCR9含量均低于A組(P<0.01),且3 h組仍低于J組(P>0.05)。
2.3 骨髓、胸腺組織CCL25的應答性變化(圖4、圖5)
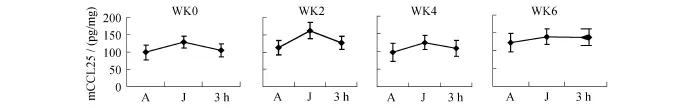
圖4 骨髓CCL25各周應答性變化情況Figure 4. Response of CCL25 in Bone Marrow in Different Weeks
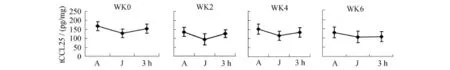
圖5 胸腺CCL25各周應答性變化情況Figure 5. Response of CCL25 in Thymus in Different Weeks
大鼠在6周遞增負荷的跑臺訓練中,CCL25的應答性特征與CCR9相似,在遞增負荷的不同階段它們的應答幅度也不同:第0周J組大鼠骨髓CCL25含量與A組相比上升(P<0.05),運動后3 h組略高于對照組,但無顯著性意義(P>0.05);第0周J組大鼠胸腺組織CCL25含量與A組相比下降(P<0.01),運動后3 h組高于J組(P>0.05),但低于A組(P>0.05)。J組骨髓CCL25含量在第2、4周高于A組(P<0.05或P<0.01),3 h組與J組相比下降。J組胸腺CCL25含量在第2、4周低于A組(P<0.05或P<0.01),3 h組與J組相比上升。在第6周J組骨髓CCL25含量高于A組(P<0.05),且3 h組仍高于J組(P>0.05);在第6周J組胸腺CCL25含量低于A組(P<0.05),3 h組與J組相比無顯著性差異(P>0.05)。
3 分析與討論
骨髓T細胞前體歸巢入胸腺以及胸腺細胞在胸腺不同區域的遷移過程中,趨化因子及其受體表達起重要的調節作用。雖然多種骨髓細胞有T譜系分化潛能,但表達CCR9的亞群優先歸巢入胸腺。其中,造血干細胞(hematopoietic stem cells,HSCs)缺乏表面表達CCR9,不能歸巢入胸腺;而多能祖細胞(multipotent progenitors,MPPs)和共同淋巴樣祖細胞(common lymphoid progenitors,CLPs)2種亞型的表面表達CCR9,能優先地歸巢入胸腺。CCL25能夠誘導骨髓細胞亞群、胎兒血前胸腺細胞和新生兒胸腺祖細胞歸巢和定植于胸腺,阻斷CCL25致使祖細胞進入胎兒胸腺減少[6]。
另外,CCL25可通過CCR9傳遞胸腺細胞的發育和遷移信號,促進胸腺細胞的發育和成熟。L.Carramolino等[7]研究報道,胸腺中的CCR9正常情況下主要表達于CD4-CD8-T雙陰性(double-negative,DN)細胞、CD4+CD8+T雙陽性(double-positive,DP)細胞及CD8+T單陽性(single-positive,SP)細胞。當DN和DP細胞上的CCR9與CCL25相互作用后,CCL25誘導細胞Ca2+的移動從而促進其向胸腺趨化運動,這些細胞在胸腺先后經歷陽性選擇和陰性選擇后,主要分化發育成為CD4+T和CD8+T單陽性T細胞,隨后CCR9在CD4+T細胞上的表達大量減少,而在CD8+T細胞的表達基本不變,表明胸腺CCR9、CCL25含量對T細胞亞群分化有較大程度影響。
為探討運動性免疫抑制過程中CCR9、CCL25對骨髓祖細胞胸腺歸巢的作用及胸腺細胞發育的調節機制,本研究選取骨髓和胸腺組織,初步研究了趨化因子CCL25、CCR9在骨髓和胸腺組織中的表達規律。從實驗結果來看,CCL25、CCR9在骨髓和胸腺組織中均有表達,6周遞增負荷跑臺運動過程中,骨髓和胸腺中CCR9、CCL25呈現不同的應答趨勢:骨髓中CCR9、CCL25呈現先上升再回落的倒“V”型曲線,而胸腺中CCR9、CCL25呈現先下降再回升的“V”型曲線。在遞增負荷的不同階段,CCR9、CCL25應答幅度不同:其中第0周運動后即刻骨髓中CCR9、CCL25水平升高,而胸腺中的水平下降,表明CCR9、CCL25對運動負荷應答非常敏感,一次性運動即可引起骨髓中趨化因子及其受體的升高而胸腺水平下降。第2周時應答幅度最大,運動后即刻組骨髓中CCR9、CCL25顯著性升高,而在胸腺中顯著性下降。第4周時應答幅度最大,運動組骨髓CCR9、CCL25與第2周相比顯著性下降,但仍高于第0周水平;胸腺CCR9、CCL25水平與第2周相比顯著性升高。第6周運動組骨髓CCR9、CCL25顯著性上升,但在胸腺再次下降。在前4周運動組中,胸腺CCR9、CCL25水平在3 h組均有所恢復,但在第6周沒有恢復的趨勢。這表明隨著免疫抑制的進程,胸腺CCR9、CCL25水平逐漸下降。
胸腺CCR9、CCL25水平逐漸下降趨勢可能會影響胸腺細胞的發育進程,其機制可能是:胸腺CCR9、CCL25水平下降,不能維持未成熟DN細胞在胸腺不同位置的遷移,DN細胞不能準確、及時地遷移進入促使其發育的胸腺部位,使DN細胞無法獲得有效的胸腺微環境,胸腺DN細胞的分化增殖異常,繼而抑制下游DP雙陽性細胞的擴增,產生更強的分化抑制效應,導致SP單陽性細胞亞群數量下降,比例失衡。由上述結果可推測,胸腺CCR9、CCL25水平下降可能是胸腺細胞發育受損的重要因素。
骨髓CCR9、CCL25的動態變化規律與胸腺相反,在遞增負荷運動過程中也出現了波動,呈現先上升再回落的倒“V”型曲線,最終隨免疫抑制程度的加深而上升。其機制一方面可能是由于胸腺結構持續性破壞,胸腺萎縮和胸腺祖細胞在運動性免疫抑制過程中逐漸減少,需要更多的骨髓祖細胞歸巢入胸腺,機體在運動應激過程中,盡力維持其穩態,相應地加強了上游骨髓趨化因子的需求信號,胸腺部位趨化因子越缺乏,骨髓信號越強。另一方面,在病理研究中,有報道CCR9、CCL25的表達與淋巴細胞的募集相關,而且它們在疾病發生時的高表達很可能與疾病發生時免疫細胞對其他組織和系統的遷移、浸潤密切相關。CCR9的活化能夠提供細胞存活的信號,從而有可能增強病理細胞的生存和增殖能力[8],因而有可能是一種病情加重的信號;因此,在骨髓中CCR9、CCL25的表達隨免疫抑制加劇而表達量增加的機制及其生物學意義有待進一步研究。
4 小結
CCR9和CCL25的應答性變化與遞增負荷運動的進程有關。骨髓中CCR9和CCL25的上升可能是由于胸腺持續性破壞,機體為盡力維持其穩態而加強了上游骨髓歸巢因子的需求信號。胸腺CCR9和CCL25下降可能導致胸腺微環境紊亂,從而影響胸腺細胞發育。
隨著遞增負荷運動的進程,骨髓中的趨化因子受體CCR9和配體CCL25總體水平越來越高,且越來越難以恢復,表明骨髓歸巢因子信號需求越來越強。
在胸腺中趨化因子受體CCR9和配體CCL25總體水平越來越低,恢復也越來越難,表明胸腺微環境紊亂程度越來越大。
胸腺微環境的破壞,歸巢因子作用的減弱,應是受長期遞增負荷運動影響,T細胞歸巢及發育受阻且功能逐步下降的重要機理之一。
[1] Cyster JG.Chemokines,Sphingosine-1-Phosphate,and Cell Migration in Secondary Lymphoid Organs[J].Annu Rev Immunol,2005(23):127-159
[2] Rosen SD.Ligands for L-Selectin:Homing,Inflammation,and Beyond[J].Annu Rev Immunol,2004(22):129-156
[3] Anderson G,Jenkinson E J.Lymphostromal Interactions in Thym ic Development and Function[J].Nat Rev Immunol,2001,1(1):31-40
[4] Zabel B A,Agace W W,Campbell J J,et al.Human G Protein-Coupled Receptor GPR-9-6/CC Chemokine Receptor 9 is Selectively Expressed on Intestinal Homing T Lymphocytes,Mucosal Lymphocytes,and Thymocytes and is Required for Thymus-Expressed Chemokine-Mediated Chemotaxis[J].JExp Med,1999,190(9):1241-1256
[5] Majka M,Janowska-Wieczorek A,Ratajczak J,et al. Stromal-Derived Factor 1 and Thrombopoietin Regulate Distinct Aspects of Human Megakaryopoiesis[J].Blood 2000,96(13):4142-4151
[6] Liu C,Ueno T,Kuse S,et al.The Role of CCL21 in Recruitment of T Precursor Cells to Fetal Thymi[J]. Blood,2005,105(1):31-39
[7] Carramolino L,Zaballos A,Kremer L,et al.Expression of CCR9β-Chemokine Receptor is Modulated in Thymocyte Differentiation and is Selectively Maintained in CD8+T Cell from Secondary Lymphoid Organs[J].Blood,2001,97(4):850-857
[8] Youn B S,Kim Y J,Mantel C,et al.Blocking of c-FLIP(L)-Independent Cycloheximide-Induced Poptosis or Fas-Mediated Apoptosis by the CC Chemokine Receptor 9/ TECK Interaction[J].Blood,2001,98(4):925-933
Responsive Characteristics of Chemotactic Factors CCR9/CCL25 in Bone M arrow and Thymus during Long-Term Incremental Exercise
∥ZHANG Lin,HAO Xuanming
Objectives:It is to observe the responsive characteristics of CCR9/CCL25,the two chemotactic factors in bone marrow and thymus during long-term incremental exercise and to explore the regulative mechanism of T lymphocyte development with long-term exercise.Methods:Sprague-Dawle rats were randomly divided into control and exercise group.Exercise protocol:treadmill exercise,successive 6 weeks,6 days per week,30 minutes per day,10 m·m in-1in week 1,20 m·m in-1in week 2,with 5 m·m in-1increment in the following weeks till it reached 40m·min-1in the 6thweek.Samples were taken before exercise,at rest,immediately after exercise and 3 hours after exercise,respectively at the end of week 2,4 and 6.CCR9/CCL25 was tested by ELISA.Results:CCR9/CCL25 in bone marrow and thymus presented almost opposite responsive pattern during 6-week incremental exercise. Conclusions:There is an increasing grow th for CCR9/CCL25 level in bone thymus and more difficulty of recovery during the incremental exercise,which means an increasing grow th of demands for chemotactic factors in bone marrow.On the other hand,a decreasing grow th for CCR9/CCL25 level in thymus and more difficulty of recovery show the increasingly big disorder for thymus micro-environment.It should be one of the important mechanisms for T lymphocyte development impairment and gradually downgrading function with long-term incremental exercise.
incremental exercise;mobility immune suppression;chemotactic factor;bone marrow;thymus;immune regulation
G804
A
1000 -5498(2013)03 -0056 -04
2012 -10 -20;
2013 -02 -06
中國博士后科學基金資助項目(20110490909);廣東省自然科學基金資助項目(S2011040003164,9151063101000059)
張琳(1971 -),女,河南南陽人,華南師范大學博士后;Tel:13660106216,E- mail:sdtyzl@yahoo.cn
郝選明(1954 -),男,陜西韓城人,華南師范大學教授,博士,博士生導師;Tel:(020)85211498,E- mail:hxm@scnu.edu.cn

