力竭運動誘導大鼠心肌過氧亞硝酸陰離子生成
李艷冬,周 剛,肖曉丹,劉禮丹,崔國霞
Sport College,Hunan University,Changsha Hunan,410082
運動性疲勞研究至今已有一百多年的歷史,大量研究結果表明:不同強度、不同時間、不同運動方式產生的運動性疲勞機制是完全不同的。1978年迪拉德(Dillard)首次將自由基理論引入運動醫學領域。近30多年來的文獻顯示:急性運動和力竭運動都可以導致內源性氧自由基生成增多,脂質過氧化反應增強、構成了對細胞膜系統的損害,與運動性疲勞的關系密切。運動中產生的主要自由基是超氧陰離子(superoxide radical,O2-。),它是機體其他活性氧的主要來源。在病理情況下,O2-。可與NO結合進一步生ONOO-。NO過多會導致心血管損害,并伴有氧自由基和ONOO-形成[1]。研究認為,ONOO-是細胞因子誘導的心肌收縮功能衰竭的主要介導物[2]。但是,尚不清楚運動生成的過量超氧陰離子是否也誘導組織ONOO-生成。本研究假設力竭運動后,心肌ONOO-的大量生成可能導致心肌疲勞,心臟輸血功能的下降是產生運動性疲勞的原因。
1 材料與方法
1.1 實驗動物
雄性SD大鼠16只,6周齡,體重200-250 g,購于湖南中南大學動物實驗中心,分籠飼養(每籠4只),自由進水、飲食(國家標準嚙齒類動物常規飼料喂養),環境溫度18~22℃,濕度40%-60%,自然晝夜節律變化光照。
1.2 動物分組與運動方案
大鼠適應性喂養三天,隨機分為2組:安靜組(C組,n=8),運動組(E組,n=8)。
安靜組(C組):正常籠內生活,不施加運動負荷。
運動組(E組):力竭運動前三天進行適應性跑臺運動,跑速10 m/min,每次5-10 min。第四天進行跑臺力竭運動,前20 min以20 m/min的速度進行跑臺運動,20 min后每5 min提速15%直至力竭。整個運動過程采用跑臺的聲、光、電刺激強迫大鼠持續運動。大鼠力竭標準為:兩眼無光,毛發豎起,聲光電刺激無反應,翻身后無力掙扎。
1.3 樣本的采集與處理
大鼠力竭后即刻麻醉、解剖、取樣。用水合氯醛30 mg/kg腹腔麻醉,暴露腹腔,左心室取血后迅速取心室肌組織。全血室溫靜置3小時,常溫3 000 rpm離心10 min取上清,-20℃保存待測。取出的心肌用0.9%NaCl溶液清洗,去除血液、結締組織,濾紙濾干,勻漿管密封,-20℃保存,以備勻漿,所有操作在冰上完成。
1.4 測試指標與方法
MDA測試:采用微量丙二醛測定試劑盒測定,試劑盒購于南京建成科技有限公司,按試劑盒說明操作。
SOD測試:采用超氧化物歧化酶試劑盒測定,試劑盒購于碧云天生物科技有限公司,按試劑盒說明操作。
NO測試:采用硝酸還原酶法測定,試劑盒購于南京建成科技有限公司,按試劑盒說明操作。
ONOO-測定:采用酶聯免疫分析法測定,試劑盒武漢貝茵萊生物科技有限公司,按試劑盒說明操作。
1.5 數據分析
采用Prism統計軟件分析,結果用平均值±標準差(M±SD)表示,P<0.05代表顯著性差異,P<0.01代表極顯著性差異。
2 結果
如表1所示,力竭運動后,E組和C組相比,大鼠心肌ONOO-生成明顯升高,增高43%(P<0.05,見圖1);心肌MDA濃度上升52%(P<0.05,見圖2);心肌SOD活力下降60%,有非常顯著性差異(P<0.01,見圖3)。E組較C組比的血清中NO含量有小幅上升,但無統計學意義(P>0.05,見圖4)。提示力竭運動可使大鼠心肌自由基產生增多,抗氧化能力下降,脂質過氧化水平升高。
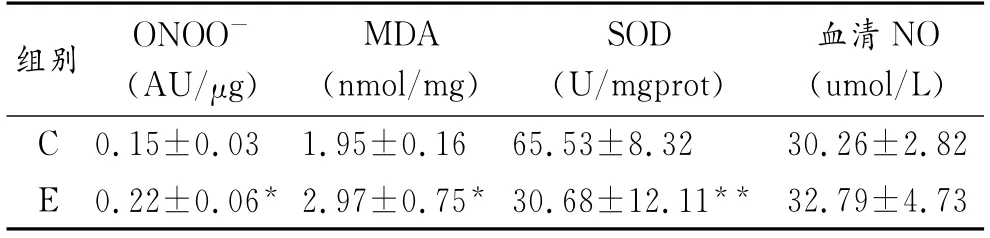
表1 大鼠血清NO、心肌MDA、SOD和ONOO-變化
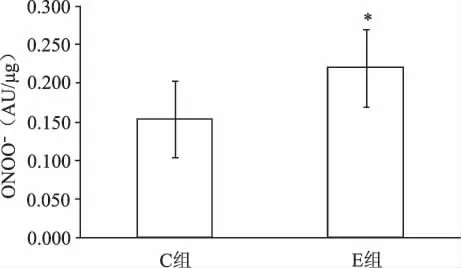
圖1 力竭運動E組和C組ONOO-比較(*P<0.05:表示與C組相比)
3 討論
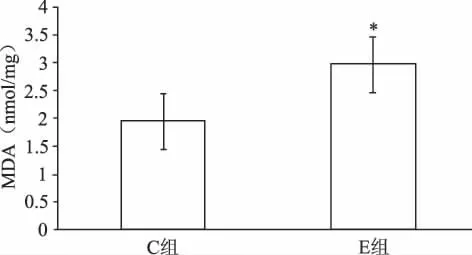
圖2 力竭運動E組和C組心肌MDA含量比較(*P<0.05:表示與C組相比)
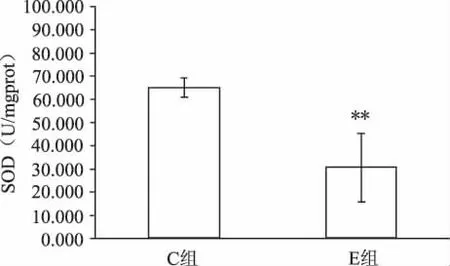
圖3 力竭運動E組和C組心肌SOD活力比較(**P<0.01:表示與C組相比)
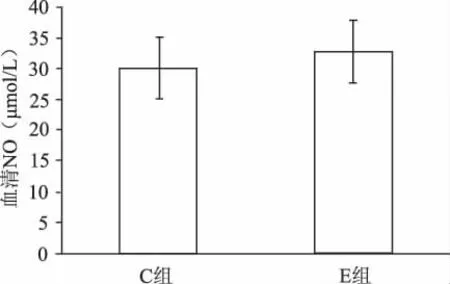
圖4 力竭運動E組和C組血清NO的比較
ONOO-是游離酪氨酸或蛋白質酪氨酸硝基化形成的穩定的終末代謝物,是蛋白質硝基化的特異性標志物,是介導氧化應激損傷作用的重要環節,是近年來細胞損傷機制研究的熱點之一。在生物體內,ONOO-主要來源于NO和O2-。的快速非酶促反應。NO/O2-。反應形成ONOO-,其過程是不可逆的,此反應的速率[6.7×109 molP(L·s)]遠大于超氧化物歧化酶/O2-。反應的速率[2×109 molP(L·s)][3],而且無需酶催化,只要同時有大量NO和O2-。生成,NO/O2-。反應形成ONOO-就占主導地位。有研究指出ONOO-還有另一種生成途徑[6],即NO/亞鐵細胞色素C途徑。NO與亞鐵細胞色素C反應生成NO-和高鐵細胞色素C,NO-再與O2-。反應生成ONOO-。
ONOO-在生物體內主要是通過以下幾種途徑發揮作用[7]。1)強氧化作用,ONOO-是一種強效氧化劑,其氧化能力比過氧化氫大2 000倍,能與多種分子發生反應,特別是氧化鐵/硫中心、鋅指結構和蛋白巰基,引起蛋白質、脂質和DNA的氧化性損害[3-5]。2)硝基化作用,ONOO-與蛋白質分子中的酪氨酸反應形成硝基酪氨酸而影響蛋白質功能[3-5]。研究認為,硝基酪氨酸是ONOO-細胞毒性的主要介導分子[8]。低濃度ONOO-即可使酪氨酸硝基化,不可逆地降低心肌收縮和舒張功能[9]。3)影響能量代謝,酶蛋白被氧化或硝基化后活性減低,如線粒體ATP合成酶、烏頭酸酶活性受抑制導致能量生成減少[10]。4)干擾鈣運轉,ONOO-可干擾細胞鈣轉運系統,Ca2+內流增加,引起細胞鈣超載,損害心肌細胞,并導致心肌細胞機械功能障礙,甚至停搏于舒張期[11,12]。研究發現,經過急性力竭運動后,大鼠肝線粒體的Ca2+濃度上升,細胞內鈣過量可進一步通過產生各種氧自由基、NO和其毒性產物—過氧亞硝基陰離子(ONOO-)的方式,過度活化蛋白激酶C(PKC),Ca2+/Ca調蛋白依賴的蛋白激酶Ⅱ、磷酸磷脂酶等生物大分子降解,損傷細胞線粒體功能,加重細胞酸中毒,最終導致細胞凋亡[13]。
實驗過程中發現力竭運動組的ONOO-含量顯著高于安靜組,推測這可能與力竭運動導致大量活性氧生成有關,尤其是O2-。和NO過量生成有關。
MDA是公認的衡量機體自由基代謝的敏感指標,其生成量不僅反映氧自由基生成與否,還反映脂質過氧化程度,因而測定MDA含量可推測脂質過氧化程度,同時因其壽命長、毒性大,還可引起其他物質產生過氧化作用的連鎖反應,所以MDA的含量還可反映組織損傷的程度。從本實驗結果看,力竭運動后大鼠心肌MDA含量明顯升高,表明力竭運動后心肌中氧自由基顯著增加。SOD對機體的氧化與抗氧化平衡起著至關重要的作用,此酶可通過催化超氧陰離子形成過氧化氫而清除超氧陰離子,保護機體免受損傷,因而SOD活性的高低是機體抗氧化能力強弱的標志。SOD可催化超氧陰離子生成過氧化氫,并在過氧化氫酶(catalase,CAT)作用下分解為氧和水而被清除,因而SOD活性的高低對維護自由基代謝的平衡尤為重要。結果顯示,力竭運動后心肌中SOD顯著下降,說明機體清除自由基能力明顯降低。形成此現象的原因可能與力竭運動后自由基產生增加,SOD消耗太多有關。由MDA,SOD的檢測結果可推測,力竭運動后,機體的氧化程度明顯升高,抗氧化能力顯著下降,心肌中自由基濃度顯著升高。由于機體清除自由基能力的減弱,氧自由基增多,其中O2-在一定程度上也顯著增多。NO有細胞保護作用,而NO/O2-。反應形成的ONOO-則具有細胞毒作用。動物體內NO生物合成的唯一途徑是NO合酶(nitric oxide synthase,NOS)的 酶 促 反 應[14]。NOS有 三 個 亞 型,分 別 為eNOS,nNOS,iNOS。近年來在運動生化方面有大量關于NO的相關研究。劉鴻宇等研究認為,反復運動疲勞后大鼠乳頭體各部nNOS陽性神經元數量和面積顯著增加,NO可能是乳頭體參與疲勞應激反應中的一種遞質[16]。李麗等研究認為,過度訓練可導致運動性腎損傷,進而引起運動性球-管混合型蛋白尿,其機理之一可能是腎缺血再灌注時其機理之一可能是腎缺血再灌注時iNOS活性增強,誘導NO增多,引起腎小管功能障礙[17]。敬繼紅等發現運動導致腦組織中NO的大量生成,并引起腦損傷[18]。在運動中,機體NO的升高會損害機體組織。由于NO半衰期很短,很難檢測組織中的NO,但從檢測到的血清中NO的含量也有上升趨勢,可以推測,力竭運動可能導致NO的過量生成,心肌大量生成的ONOO-可能是由于運動導致的O2-。與NO反應所致。
本研究表明,力竭運動誘導心肌過氧亞硝酸基的大量生成,其機制是源于力竭運動誘導心肌O2-。的大量生成與NO的過量生成。心肌ONOO-的大量生成可能導致心肌疲勞,心臟輸血功能的下降是產生運動性疲勞的原因。
[1] Shah AM,MacCarthy PA.Paracrine and autocrine effects of nitric oxide on myocardial function[J].Pharmacol Ther,2000,86(1):49286.
[2] Ferdinandy P,Danial H,Ambrus I,et al.Peroxynitrite is a major contributor to cytokine-induced myocardial contractile failure[J].Circ Res,2000,87:241-247.
[3] Bechman JS,Koppenol WH.Nitric oxide,superoxide,and per2 oxynitrite:the good,the bad,and the ugly[J].Am J Physiol,1996,271(Cell Physiol 40):C1 424-437.
[4] Pryor WA,Squadrito GL.The chemistry of peroxynitrite:a product from the reaction of nitric oxide with superoxide[J].Am J Physi2ol,1995,268.
[5] 周 玫,陳 瑗.體內一氧化氮和過氧亞硝酸的生成及其生物學效應[J].中國動脈硬化雜志,1998(6).
[6] Sharpe MA,Cooper CE.Reactions of nitric oxide with mitochondri2al cytochrome c:a novel mechanismfor the formation of nitroxyl anion and peroxynitrite[J].Biochem J,1998,332(Pt1):9-19.
[7] 羅 義.一氧化氮和過氧亞硝酸陰離子的心肌損害作用[J].中國動脈硬化雜志,2001(9):172-174.
[8] Seo HG,Tannenbaum SR.Identification of a stress-inducible pro2 tein containing nitrotyrosine in RAW264.7 cells activated by IFN-γand LPS.Proceedings of the 5th international meeting on the biology of nitric oxide[J].Jpn J Pharmacol,1997,75(1):105.
[9] Digerness SB,Harris KD,Kirklin JW,et al.Peroxynitrite irrev2 ersibly decreases diastolic and systolic function in cardiac muscle[J].Free Radic Biol Med,1999,27(11-12).
[10]Oyama J I,Shimokawa H,Momii H,et al.Role of nitric oxide and peroxynitrite in the cytokine-induced sustained myocardial dysfunc2 tion in dogs in vivo[J].J Clin Invest,1998,101(2):207-214.
[11]Ishid H,Ichimori K,Hirota Y,et al.Peroxynitrite-induced car2 diac myocyte injury[J].Free Rad Biol Med,1996,20:343-350.
[12]Ishida H,Genka C,Hirota Y,et al.Distinct roles of peroxynitrite and hydroxyl radical in triggering stunned myocardium-like impair2 ment of cardiac myocytes in vitro[J].Mol Cell Biochem,1999,198(1-2):31-38.
[13]李善妮,瞿樹林,湯長發.急性不同強度至力竭運動對大鼠肝細胞凋亡的影響[J].北京體育大學學報,2006(5):636-634.
[14]Griffith OW,Stuehr DJ.Nitric oxide synthase:properties and catalytic mechanism.Ann Rev Physiol,1995,57:707-736.
[15]方允中,鄭榮梁.自由基生物學的理論與應用[M].北京:科學出版社,2008.
[16]劉鴻宇,藥宏亮,崔建梅,等.運動性疲勞對大鼠乳頭體nNOS表達的影響[J],中國應用生理學雜志,2009,25(3):381-382.
[17]李 麗,常 波.過度訓練導致大鼠運動性蛋白尿機制的研究[J].西安體育學院學報.2007,24(3):80-84.
[18]敬繼紅,馬學智.刺五加提取物對大強度耐力運動大鼠不同組織NO、NOS含量的影響[J].武漢體育學院學報,2006(5).

