復合肝素及CD34抗體可降解鎂合金支架在心肌血運重建中的應用
張 嵬,楊 力,劉曉程,張杰民,陳 越,張亞東
(天津醫科大學心血管病臨床學院、泰達國際心血管病醫院,天津 300457)
冠狀動脈旁路移植術和經皮冠狀動脈介入是當前治療冠心病的主要手段,但是對于彌漫性病變的患者并不適于用上述的方式重建心肌血運。心肌打孔治療是終末期冠心病的一種治療方式,然而人工腔道的閉塞卻嚴重影響了該治療方式的效果。目前有研究顯示,心肌鉆孔合并心室支架植入的方法重建缺血心肌血運取得了一定的研究成果[1~3]。2011年11月~2012年6月,我們應用鎂合金替代以前應用的聚乳酸/乙醇酸制成新型的可降解心室支架,同時復合肝素及CD34抗體,以期增加支架強度,保持支架通暢,促進腔道內血管內皮細胞生長,從而有效地重建心肌血運。
1 材料與方法
1.1 材料 vWF鼠抗人單克隆抗體、羊抗鼠IgG多克隆抗體(Dako公司,丹麥);顯微鏡攝像系統(BX51,OLYMPUS公司,日本);經圖像分析軟件Image Pro Plus 6.0(MediaCybernetics,美國);中華實驗用小型豬(購自北京琉璃河科興實驗動物養殖中心);麻醉機、心電監護儀(Detax-Ohmeda 700,美國);高速機械打孔器(北京凱邁醫療設備公司)
1.2 方法
1.2.1 豬急性心肌梗死模型及鎂合金支架的制備①模型建立:選用中華實驗小型豬18只,肌注鹽酸賽拉嗪(2 mg/kg)誘導麻醉,然后氣管插管,呼吸機輔助通氣(潮氣量350 mL,呼吸頻率15次/min,氧流量1 L/min)。術中吸入1%~2%異氟醚,靜脈持續泵入丙泊酚3 mg/(kg·h)維持麻醉,持續進行心電監護。經胸骨正中切口暴露心臟,結扎冠脈前降支中、遠端1/3交界處,通過心電圖確定心肌梗死模型制作成功。心肌梗死模型制作成功后,將動物隨機分為3組(每組6只):A組為對照組,B組為心肌打孔+復合緩釋肝素的可降解鎂合金支架植入組,C組為心肌打孔+復合緩釋肝素和CD34抗體的可降解鎂合金支架植入組。在B組和C組中,于心肌梗死區采用自制高速鉆孔器(13000 r/min)由心外膜各打兩個透壁孔道。每個孔道內植入1枚可降解的管形支架,隨即結扎心外膜預留的荷包縫線控制出血并固定支架。術后肌注青霉素300萬U,2次/d,連續3 d。②鎂合金支架的制備:支架由鎂鋅合金制成,直徑2 mm,厚度0.15 mm,長度10 mm,分別涂覆肝素及CD34抗體。每個鎂合金支架復合肝素約500 μg,控釋作用可持續6個月左右。鎂合金支架的抗壓性測試結果顯示,支架的徑向抗壓性能為75 kPa,能滿足支架植入心肌的要求。降解時間測試結果顯示,鎂合金支架體外降解時間1個月以上。
1.2.2 超聲心動圖檢測 圖像采集應用GE 33超聲心動儀,S3探頭頻率為1.6~3.2 MHz,同步記錄ECG。分別于心尖兩腔、四腔、左心室長短軸切面采集資料存盤,脫機測量左室舒張末期容積(LVEDV)、左室收縮末期容積(LVESV),計算LVEF=(LVEDV-LVESV)/LVEDV×100%。
1.2.3 核素心肌灌注顯像 心肌梗死模型建成后即刻和術后6周時經豬耳緣靜脈注射14.8 MBq/kg99mTc—甲氧基異丁基異腈,給藥30 min后行心電門控心肌灌注核素顯像。儀器為GE Millennium VG-5,配低能通用型準直器,兩個探頭呈90°夾角,繞心臟旋轉180°,每幀采集25 s,共采集30幀,矩陣64×64,放大倍數2.0。采用濾波反投影重建原始圖像。通過Emory Cardiac Toolbox軟件量化灌注質量缺損百分率(MDP)的變化,其中MDP=(Md/Mt)×100%。Md指灌注缺損部位心肌質量,Mt指整個心肌質量。以每只動物治療前和治療后6周時MDP的差值(△MDP),作為衡量各組血流灌注情況改善的指標。
1.2.4 新生血管密度的量化分析 上述圖像采集結束后,靜脈注射100 g/L的KCl 10 mL使心臟停搏于舒張期。從孔道周圍隨機采集組織標本,依次經40 g/L的甲醛固定24 h、脫水、浸蠟、包埋及切片(5 μm)后,常規行HE染色與免疫組織化學染色。后者的主要步驟為:切片以30 ml/L的H2O2阻斷,滴加正常羊血清封閉,依次滴加小鼠抗人血管性血友病因子單克隆抗體(4℃過夜)及二抗羊抗小鼠IgG多克隆抗體,加DAB顯色后,蘇木素復染。在放大倍率、曝光時間均相同的條件下,每組隨機采集50個非重疊視野圖像,轉化為Tiff格式保存,經圖像分析軟件Image Pro Plus 6.0處理,校正A值后進行量化分析。
1.2.5 統計學方法 應用SPSS13.0統計學軟件,實驗數據以表示,組間數據的比較采用單因素方差分析。P≤0.05為有統計學差異。
2 結果
2.1 實驗動物情況 本實驗選用中華小型豬18只建立心肌梗死模型,4只在結扎冠脈后出現室顫,予電除顫后均復律,全組無死亡。支架植入組6周內各臟器均未發現栓塞,提示無支架殘余脫落。
2.2 超聲心動圖檢查 心梗模型制作成功后即可見相應部位的局部室壁運動減弱。治療前各組LVEF無明顯差異。術后6周時檢查結果顯示,C組、B組LVEF分別為(53±2)%、(47±3)%,均高于A組[(43±3)%],三組差異有統計學意義(P均<0.05)。
2.3 核素心肌灌注顯像測定 治療6周,B組和C組的△MDP值分別為(-1.43±0.47)%和(-1.47±0.82)%,明顯低于 A 組[(2.75 ±0.24)%],差異有統計學意義(P均<0.05)。C組的△MDP略低于B組,但差異無統計學意義。A、B、C 3組的短軸核素心肌灌注掃描結果顯示,治療后6周時心肌灌注缺損面積較治療前明顯改善。見圖1。
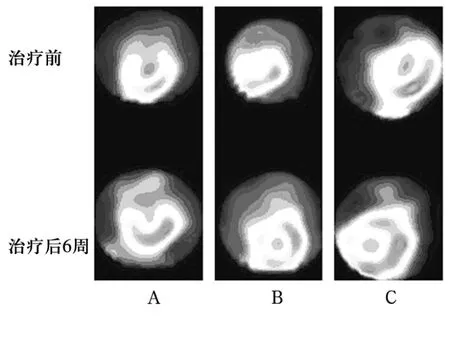
圖1 三組治療前和治療后6周心肌灌注核素掃描顯像垂直短軸圖像
2.4 組織學分析 6周后心臟組織學檢查見A、B、C 3組的人工腔道基本上完全閉鎖,鎂合金支架全部被吸收,孔道周圍形成少量的瘢痕組織。6周后,通過免疫組織化學方法檢測缺血心肌組織中新生血管密度的變化。經圖像分析軟件量化分析后顯示,治療后6周B組、C組新生血管密度OD值為5381±76和5682±29,較A組(2873±59)明顯增加(P均<0.01)。A組和B組之間沒有統計學差異(P>0.05)。
3 討論
心肌打孔是有效的心肌再血管化方法之一,其治療的理論基礎是左心室腔內的動脈血可以通過孔道灌注到心肌竇狀隙,從而營養與支持心肌細胞[4]。但是目前的研究結果表明,無論激光打孔還是機械打孔,都無法維持孔道的長期開放[5]。本實驗所采用的鎂合金支架抗壓性能好,可以維持腔道處于持續開放狀態。此外,支架由可降解的鎂合金材料制成,控制肝素與CD34抗體持續緩慢釋放,發揮其在局部持續抑制凝血途徑的激活和誘導微血管形成及微循環重建的作用。CD34于1984年由美國科學家Civin發現,屬于鈣黏蛋白家族,其結構包括胞外區、跨膜區、胞質區3部分[6]。CD34是內皮祖細胞上的一個相對特異的表面抗原,參與了內皮祖細胞的定位與黏附。抗CD34抗體能夠特異識別細胞,并通過抗原抗體結合原理從外周血中募集內皮祖細胞。Rotmans等[7]證實在血管材料上預置CD34抗體可通過抗原抗體反應的原理捕獲循環中的內皮祖細胞,而內皮祖細胞在一定條件下可進一步分化成內皮細胞。此外,美國Orbus Medical Technologies公司所研制成功的Genous生物工程R支架就是在不銹鋼冠脈支架上涂覆一層含有CD34抗體的基質成分。研究證實,該種支架可促進內膜損傷處的修復和支架表面的早期內皮化,并取得了較好的短期臨床效果。我們將CD34抗體復合到支架上使其在短期內發揮捕獲循環中內皮祖細胞的優勢,促進內皮祖細胞種植并加速細胞分化,在人工腔道內生長出內皮細胞。
本實驗發現,在治療后6周支架全部吸收,未見殘余及臟器栓塞,證實了鎂合金支架的安全性。但是,支架所形成的人工腔道為纖維組織所填充,未見明顯的血管內皮細胞生長,人工腔道完全閉鎖。因此,本實驗研究并沒有達到預期的目的,缺血心肌內沒有形成被覆內皮細胞的人工腔道。上述結果說明,鎂合金支架內雖含有緩釋肝素,卻沒有抑制腔道內血栓的形成,考慮此與人工腔道直徑偏小、無法抑制內外源凝血機制有關。再者,CD+34細胞僅占骨髓單核細胞的1.5%,在外周血中的比例低于0.5%,內皮祖細胞數量太低以致于無法發揮其效應。綜合考慮上述可能造成腔道閉鎖的原因可為今后支架的改進提供思路。首先,增加支架的內徑至3 mm或以上;其次,利用一些能夠影響外周血中內皮祖細胞濃度的細胞因子或藥物,如GM-CSF、G-CSF、促紅細胞生成素、血管內皮生長因子和他汀類藥物等促進內皮祖細胞的動員,增加被捕捉細胞的數量,從而促進腔道的內皮化[8]。
本實驗還發現,復合肝素和CD34抗體的可降解鎂合金支架植入心肌梗死區后,能夠顯著增加缺血心肌的新生血管密度,增加缺血部位心肌的灌注,進而改善心臟的功能,說明可降解鎂合金支架植入對急性心肌梗死具有積極的治療作用。
[1]Wang Y,Liu XC,Zhang GW,et al.A new transmyocardial degradable stent combined with growth factor,heparin,and stem cells in acute myocardial infarction[J].Cardiovasc Res,2009,84(3):461-469.
[2]Liu XC,Zhao J,Wang Y,et al.Heparin and basic fibroblast growth factor-incorporated stent:A new promising method for myocardial revascularization[J].J Surg Res,2010,164(2):204-213.
[3]Zhang GW,Liu XC,Li-Ling J,et al.Mechanisms of the protective effects of BMSCs promoted by TMDR with heparinized bFGF-incorporated stent in pig model of acute myocardial ischemia[J].J Cell Mol Med,2011,15(5):1075-1086.
[4]Sen PK,Udwadia TE,Kinare SG,et al.Transmyocardial acupuncture,a new approach to myocardial revascularization[J].J Thorac Cardiaovasc Surg,1965,50(2):181-189.
[5]Chang PY,Lu SC,Lee CM,et al.Homocysteine inhibits arterial endoliethial cell growth through transcriptional downregulation of fibroblast growth factor-2 involving G protein and DNA methylation[J].Circ Res,2008,102(8):933-941.
[6]任素萍,奚永志.CD34分子及其單克隆抗體應用[J].中國輸血雜志,2003,16(5):350-354.
[7]Rotmans JI,Heyligers JM,Verhagen HJ,et al.In vivo cell seeding with anti-CD34antibodies successfully accelerates endothelialization but stimulates intimal hyperplasia in porcine arteriovenous expanded polytetrafluoroethylene grafts[J].Circulation,2005,112(1):12-18.
[8]Aoki J,Serruys PW,van Beusekom H,et al.Endothelial progenitor cell capture by stents coated with antibody against CD34:the HEALING-FIM(Healthy Endothelial Accelerated Lining Inhibits Neointimal Growth-First In Man)Registry[J].J Am Coll Cardiol,2005,45(10):1574-1579.

