實時熒光PCR法快速檢測耐熱霉菌費氏新薩托菌
張 慧 鄭曉冬 姜 侃 汪 新 陳小珍
(1.浙江省質量檢測科學研究院理化分析檢測部,浙江 杭州 310013;2.浙江大學生物系統工程與食品科學學院,浙江 杭州 310058)
費氏新薩托菌(Neosartoryafischer)是一種耐熱、耐干燥、耐酸堿的菌種,廣泛分布于土壤尤其是果園的土壤中,是果蔬汁中易污染的耐熱霉菌之一。它不僅是飲料和熱加工食品中的有害菌,易引起食品貯存期間的腐敗變質[1-4],也是人畜共患的致病菌,可引起角膜炎、心內膜炎和肺部曲霉病等,還可產生真菌毒素,嚴重威脅人們的身體健康[5-8]。目前耐熱霉菌的檢測通常采用PDA平板培養方法,檢測時間長[2],因此,快速、準確的分子生物學檢測技術逐漸用于耐熱霉菌的檢測[9]。有研究[10,11]采用普通 PCR 技術,利用包含在核糖體單位的內部轉錄間隔區上的序列作為特異性引物,實現費氏新薩托菌的快速鑒別,但采用實時熒光PCR技術快速檢測費氏新薩托菌的研究較少。
Beta-tubulin基因序列是耐熱霉菌——費氏新薩托菌的保守序列,本試驗在此基礎上設計特異性引物和探針,優化反應體系的組成,建立實時熒光PCR快速檢測方法,對果蔬汁產品質量有效控制和保障食品安全,具有重要意義。
1 材料與方法
1.1 材料與儀器
1.1.1 菌株及來源
費氏 新 薩托 菌 (Neosartoryafescheri)ATCC66640、ATCC66641,雪 白 絲 衣 霉 菌 (Byssochlamys nivea)ATCC22260、ATCC18742,純 黃 絲 衣 霉 (Byssochlamys fulva)ATCC24474、ATCC24008:北京中原合聚經貿有限公司;
宛 氏 擬 青 霉 (Paecilomyces variotii)CICC4024、CICC4025:中國工業微生物菌種保藏管理中心;
宋內志賀菌 (Shigella sonnei)ATCC25931、金黃色葡萄球菌 (Staphylococous aureus)ATCC6538、阪崎腸桿菌(Enterobacter sakazakii)ATCC51329、福 氏 志 賀 氏 菌(Shigella flexneri)ATCC12022、 溶 血 性 鏈 球 菌(Streptococcus hemolyticus)CMCC32210、大 腸 埃 希 氏 菌(Escherichia coli)ATCC25922:上 海 漢 尼 生 物 技 術 有 限公司。
1.1.2 主要儀器
高速離心機:Microfuge 16型,貝克曼庫爾特商貿有限公司;
電子天平:AL204型,梅特勒-托利多(儀器)上海有限公司;
實時熒光PCR儀:7300型,美國應用生物系統公司。
1.1.3 主要試劑
Biospin真菌基因組DNA提取試劑盒:杭州博日科技有限公司;
PCR反應緩沖液(10×)(Mg2+free)、MgCl2、dNTP(三磷酸脫氧核糖核苷)混合物、DNA聚合酶:寶生物工程(大連)有限公司;
ROX染料:上海位點生物科技有限公司。
1.2 試驗方法
1.2.1 菌株培養 費氏新薩托菌在馬鈴薯葡萄糖培養基中培養3~6d(25℃),觀察有菌絲體或菌絲球形成,挑出,以備提取DNA使用。
1.2.2 模板DNA提取 將1.2.1中制備的菌絲體參照Biospin真菌基因組DNA抽提試劑盒說明進行操作處理,提取真菌DNA模板。
1.2.3 引物設計 費氏新薩托菌引物設計參考KACC41668beta-tubulin的部分基因序列。利用PrimerExpressTM(V3.0,美國ABI公司)軟件分析和設計引物和Taq-Man探針位點,序列見表1。引物和探針由Invitrogen公司合成。
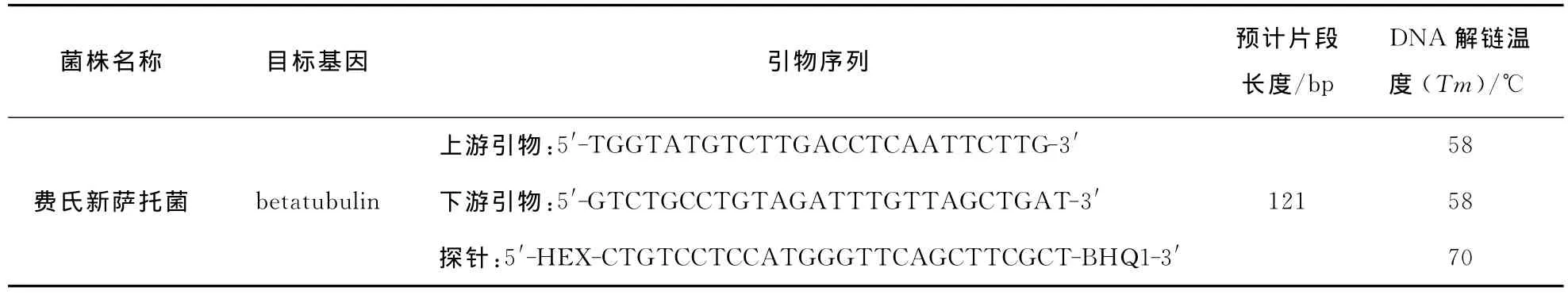
表1 引物與Taqman探針序列Table 1 Specific primer and Taqman probe sequences
1.2.4 實時熒光PCR反應體系的優化
(1)實 時 熒 光 PCR 反 應 條 件:95 ℃ (3min),95 ℃(15s)、59℃(40s)、40個循環。
(2)實時熒光PCR反應體系按表2初始體系組成開始優化,依次優化ROX染料、Mg2+、DNA聚合酶、dNTP混合物的用量。
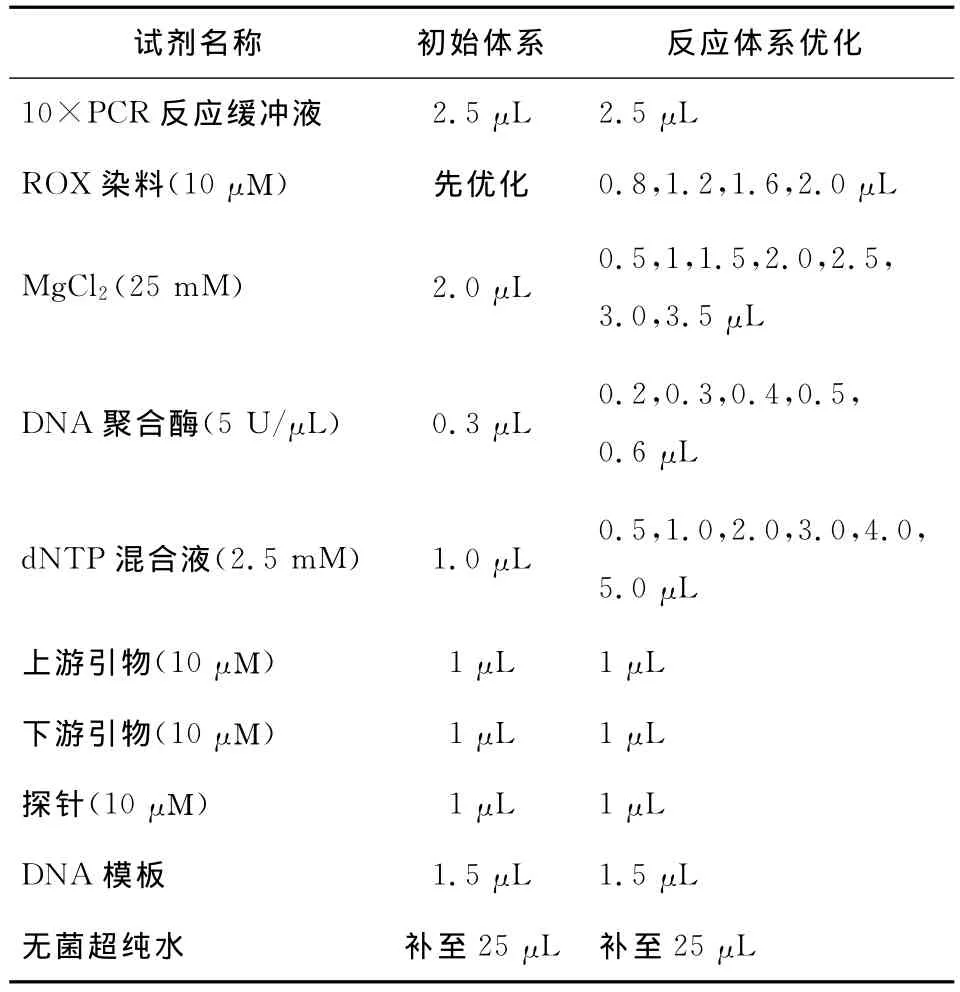
表2 實時熒光PCR反應體系組成Table 2 Real-time PCR reaction system
1.2.5 特異性試驗 分別應用1.1.1中顯示的費氏新薩托菌、雪白絲衣霉菌、純黃絲衣霉菌、宛氏擬青霉菌和多株非耐熱霉菌,提取DNA后,按試驗優化的方法進行實時熒光PCR反應,驗證費氏新薩托菌檢測的特異性。
1.2.6 靈敏度試驗 以費氏新薩托菌標準菌株ATCC66640為參考菌株,提取 DNA,提取液(57ng/μL)進行10倍梯度稀釋,使 DNA 濃度約為101,100,10-1,10-2,10-3,10-4,10-5,10-6,10-7ng/μL,應用以上 DNA 按優化的實時熒光PCR方法檢測,觀察結果,考察靈敏度。
2 結果與分析
2.1 PCR體系中探針的適用性和ROX染料用量選擇
采用7300型PCR儀進行實時熒光PCR試驗時,通常在反應體系中添加ROX熒光染料,用以校正加樣誤差或者是孔與孔之間的誤差等,提供一個穩定的基線。
圖1顯示出不同ROX用量對費氏新薩托菌的PCR擴增結果的影響不同。0.8~2.0μL ROX的PCR體系均呈對數曲線擴增,0.8μL用量的曲線1不夠平滑,綜合考慮,選取1.2μL ROX用量作為以后試驗中費氏新薩托菌實時熒光PCR擴增用量。
2.2 PCR體系中 Mg2+濃度的選擇
Mg2+是影響Taq酶活性的關鍵因素,Mg2+濃度過高,會增加非特異性擴增;Mg2+濃度過低,影響Taq酶發揮最佳活性。因此,PCR反應體系中Mg2+濃度的選擇至關重要。
圖2顯示了Mg2+濃度對費氏新薩托菌實時熒光PCR的影響,當 Mg2+的用量為0.5,1.0μL時,均未出現對數擴增的曲線,說明PCR體系中Mg2+濃度過低,影響了PCR擴增的正常進行。由圖2可知,費氏新薩托菌適宜的Mg2+用量在1.5~3.5μL。綜合考慮,2.5μL Mg2+用量作為費氏新薩托菌以后PCR試驗的用量。
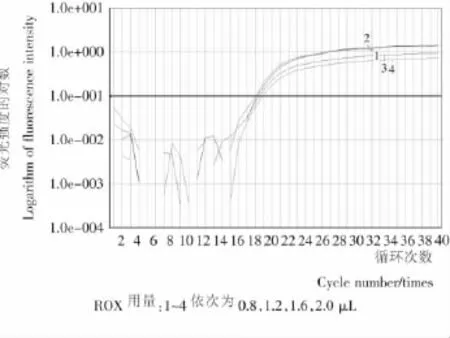
圖1 不同ROX用量對實時熒光PCR擴增影響Figure 1 Effect of ROX concentration on real-time PCR amplification

圖2 Mg2+濃度對實時熒光PCR擴增影響Figure 2 Effect of Mg2+ concentration on real-time PCR amplification
2.3 PCR體系中DNA聚合酶用量的選擇
DNA聚合酶是以DNA為復制模板,將DNA由5'端點開始復制到3'端的酶。DNA聚合酶是DNA片段擴增的關鍵物質。圖3顯示了不同的DNA聚合酶用量對費氏新薩托菌實時熒光PCR的影響,當酶的用量在0.2~0.6μL時,獲得了良好的對數擴增曲線,并且不同酶用量的熒光強度差別不大。因此,認為PCR反應體系中0.2μL的用量即可滿足實時熒光PCR擴增需求。
2.4 PCR體系中dNTP用量的選擇
dNTP又叫三磷酸脫氧核糖核苷,dNTP混合液是三磷酸鳥嘌呤脫氧核苷酸、三磷酸腺嘌呤脫氧核苷酸、三磷酸胸腺嘧啶脫氧核苷酸和三磷酸胞嘧啶脫氧核苷酸的摩爾比為1∶1∶1∶1的混合物,是構成DNA鏈的基本組成物質。
dNTP過少,影響PCR擴增效率;過量,dNTP可與Mg2+結合,從而降低體系中Mg2+濃度,造成Taq聚合酶活性下降。圖4中費氏新薩托菌在dNTP用量為2.0,3.0,4.0μL時的PCR擴增效率較好,熒光信號的強度較高。為既滿足試驗需求又節約成本,以2.0μL為后續PCR試驗用量。
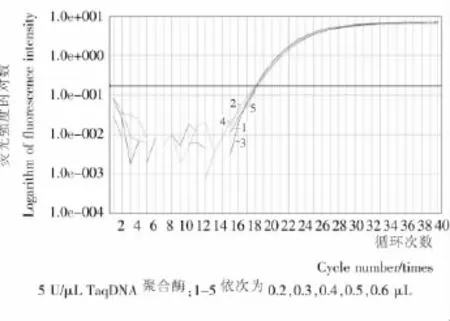
圖3 DNA聚合酶用量對實時熒光PCR擴增影響Figure 3 Effect of DNA polymerase concentration on real-time PCR amplification
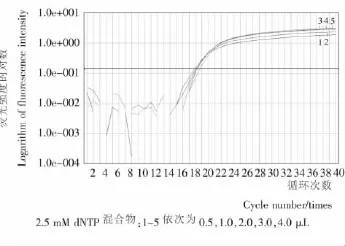
圖4 dNTP用量對實時熒光PCR擴增影響Figure 4 Effect of dNTP concentration on real-time PCR amplification
綜上所述,經過優化后費氏新薩托菌的實時熒光PCR反應體系組成見表3。
2.5 特異性
實時熒光PCR檢測費氏新薩托菌特異性的擴增結果見圖5。圖5顯示該菌的引物和探針只對費氏新薩托菌(ATCC66640、ATCC66641)產生擴增,而對其他非費氏新薩托菌均無交叉反應,特異性良好。
2.6 靈敏度
對費氏新薩托菌的DNA提取物進行10倍梯度稀釋后,進行實時熒光PCR反應,檢測結果見圖6。費氏新薩托菌最低8.6×10-4ng/反應體系的DNA能夠被擴增;其他更低的稀釋度沒有信號增長。
3 討論
費氏新薩托菌是人畜共患的致病菌,易污染果蔬汁而引起產品變質,脹罐胖聽。本試驗根據Genbank公布的betatubulin基因序列,設計了特異性引物和Taqman探針,建立了費氏新薩托菌的實時熒光PCR檢測方法。與前人所建的費氏新薩托菌PCR檢測方法[10,11]相比,該方法利用熒光探針通過實時熒光PCR實時監測目的基因的擴增,整個檢測過程為完全閉管狀態,避免了污染;同時,無需電泳等PCR后處理過程,快速、準確。實時熒光PCR反應體系中ROX染料、Mg2+濃度、DNA聚合酶和dNTP用量等,對PCR擴增反應的正常進行均有一定的影響,通過各梯度試驗確定,25μL的反應體系中,1.2μL ROX 染料(10μΜ)、2.5μL MgCl2(25mM)、0.2μL DNA 聚合酶(5U/μL)、2.0μL dNTP混合物(2.5mM)、2.5μL 10×PCR反應緩沖液為適用于費氏新薩托菌擴增的最佳反應體系,基因組DNA的靈敏度為8.6×10-4ng/反應體系,方法特異性較好。該方法的建立為耐熱霉菌費氏新薩托菌的快速檢測提供了新思路。
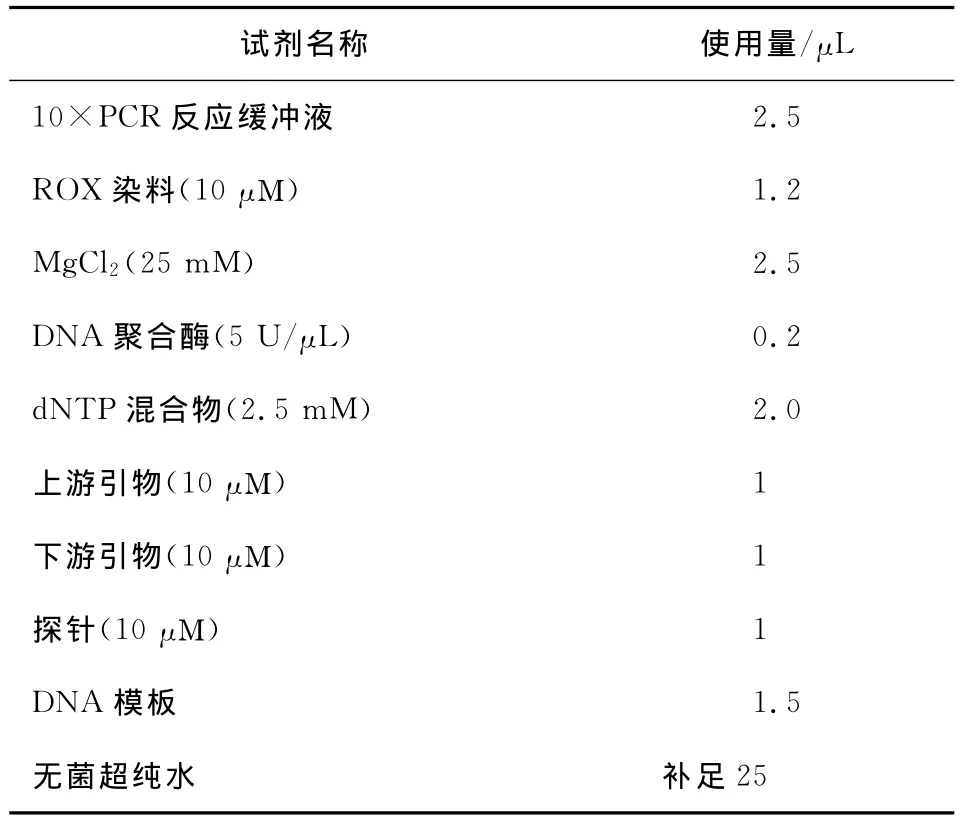
表3 優化后的費氏新薩托菌實時熒光PCR反應體系Table 3 The optimal real-time PCR system
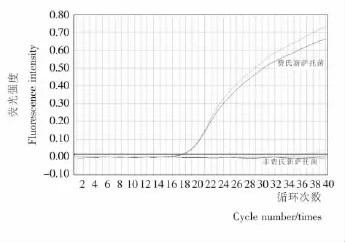
圖5 費氏新薩托菌的特異性Figure 5 Specificity of real-time PCR for Neosartoryafescheri
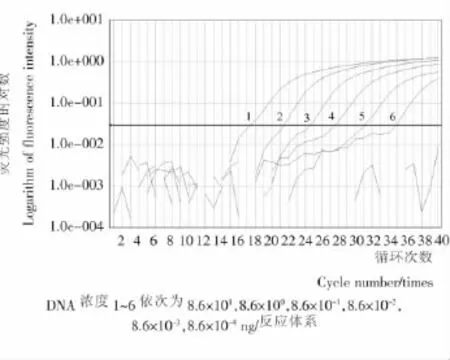
圖6 費氏新薩托菌實時熒光PCR檢測靈敏度Figure 6 Sensitivity of real-time PCR for Neosartoryafescheri
1 Nielsen P V,Beuchat L R,Frisvad J C.Growth of and fumitremorgin production by Neosartoryafischeri as affected by temperature,light,and water activity[J].Appl.Environ.Microbiol.,1988,54(6):1 504~1 510.
2 郭偉鵬,吳清平,張菊梅,等.果汁飲料中耐熱霉菌的分離和鑒定研究[J].生物技術通報,2008(增刊):244~247.
3 祝紅昆.耐熱性霉菌引起果蔬汁飲料腐敗問題的實驗探討[J].云南大學學報(自然科學版),2008,30(S1):359~362.
4 郝天婷,周幗萍.2例果汁飲料中污染真菌的鑒定分析[J].中國釀造,2010(9):155~157.
5 Tournas V.Heat-resistant fungi of importance to the food and beverage industry[J].Crit Rev Microbiol,1994,20(4):243~263.
6 Summerbell R C,L de Repentigny,C Chartrand,et al.Graftrelated endocarditis caused by Neosartoryafischeri var.spinosa.[J].J.Clin.Microbiol.,1992,30(6):1 580~1 582.
7 Girardin H,Monod M,Latge J.Molecular characterization of the food-borne fungus Neosartoryafischeri (Malloch and Cain)[J].Appl.Environ.Microbiol.,1995,61(4):1 378~1 383.
8 Silva F V,Gibbs P.Target selection in designing pasteurization processes for shelf-stable high-acid fruit products[J].Crit Rev Food Sci.Nutr.,2004,44(5):353~360.
9 張慧,鄭曉冬,姜侃,等.PCR快速檢測耐熱霉菌雪白絲衣霉菌[J].食品與機械,2012,28(6):96~98.
10 Lau A,Chen S,Sorrell T,et al,Development and clinical application of a panfungal PCR assay to detect and identify fungal DNA in tissue specimens[J].J.Clin.Microbiol.,2007,45(2):380~385.
11 Emmanuelle C N T,Robert A.Method for detecting heat-resistant micro-organisms capable of contaminating certain food products:United States,6117636[P].2000-09-12.

