水紅花子花旗松素乙醇回流法提取工藝優化
劉 剛 張雁南 杜乾坤 范澤慧
(吉林工程技術師范學院食品工程學院,吉林 長春 130052)
水紅花子是紅蓼的干燥成熟果實,有健脾消食、化痞散結、清熱明目、抑菌等作用[1]。已有研究[1-3]證明,水紅花子富含黃酮類化合物,主要成分有槲皮素、花旗松素、3,5,7-三羥基色原酮等。花旗松素(taxifolin)是一種二氫黃酮醇類化臺物,化學名為5,7,3′,4′-四羥基二氫黃酮醇[4]。屬生物類黃酮擬維生素P,也稱黃杉素、紫杉葉素、二氫化槲皮素(di-hydroquercetin,DHQ)[5]。花旗松素具有抗氧化、抗輻射、抗病毒、抗腫瘤、保護細胞內酶等活性作用[4-6]。已作為一種安全的食品添加劑(抗氧劑)被廣泛用于植物油、動物油、奶粉、含脂糕點等食品的保鮮,還開發出功能性飲料及相應的食品[5]。市場上的花旗松素大都是以落葉松為原料制得,紅蓼分布廣泛,是以種子繁殖的一年生草本植物,從其種子水紅花子中提取花旗松素不但提高了紅蓼的經濟價值,也擴大了花旗松素的來源。目前關于花旗松素,特別是水紅花子中花旗松素提取工藝研究未見報道。
響應曲面分析法以較少試驗次數和較短時間對所選試驗參數進行全面研究,在天然藥物有效成分提取等領域有廣泛應用[7]。本研究以水紅花子為原料,利用響應面法對乙醇回流法提取花旗松素的工藝條件進行優化,為水紅花子功能成分的開發利用提供參考依據。
1 材料與方法
1.1 材料與試劑
水紅花子:采自長春市郊,成熟、干燥、形態完整;
無水乙醇、甲醇:分析純,天津光復精細化工研究所;
花旗松素標準品:純度≥98%,中國藥品生物制品檢定所。
1.2 儀器與設備
微型植物試樣粉碎機;FZ102型,河北省黃驊市齊家務科學儀器廠;
鼓風干燥箱;DHG-9075A型,上海一恒科學儀器有限公司;
臺式循環水式真空泵;SHZ-ⅢA型,鄭州英峪領科儀器設備有限公司;
電子天平;AL204型,梅特勒-托利多儀器(上海)有限公司;
紫外可見分光光度計;S53型,上海棱光有限公司;
水浴鍋;HH-S4型,金壇市醫療儀器廠。
1.3 方法
1.3.1 花旗松素標準曲線的繪制 精密稱取花旗松素對照品5.0mg,用甲醇溶解于50mL容量瓶中,甲醇定容,作為標準溶液儲備液。分別精密吸取 0,0.2,0.4,0.6,0.8,1.0mL標準溶液儲備液于10mL容量瓶中,甲醇定容,以溶劑作空白,在最大吸收波長290nm處用紫外可見分光光度計測各溶液吸光度[8],繪制標準曲線(見圖1),得到標準曲線回歸方程:y =0.046 1x+0.001 3,R2=0.999 6。

圖1 花旗松素標準曲線Figure 1 The standard curve of taxifolin
根據回歸方程計算樣品液中花旗松素的含量,計算水紅花子花旗松素的提取量:

1.3.2 花旗松素的提取 將水紅花子干燥,粉碎,過60目篩。稱取5.00g水紅花子粉末,加入一定量的乙醇溶液,室溫下浸泡30min,之后在一定溫度下回流提取一定時間,提取1次,過濾,殘渣用相應濃度的乙醇溶液洗滌數次,濾液和洗液轉移至250mL容量瓶中,用相應濃度的乙醇定容,再稀釋10倍,在290nm處測定吸光度值,計算花旗松素提取量。
1.3.3 試驗設計
(1)單因素試驗:以花旗松素提取量為評價指標,考察各因素對花旗松素提取量的影響。基礎試驗條件:水紅花子粉末5.00g、乙醇溶液體積分數55%、料液比1∶15(m∶V)、提取溫度65℃、提取時間1h、提取1次。單因素試驗設計:乙 醇 溶 液 體 積 分 數35%,45% ,55%,65%,75% ,85%,95%;提取溫度35,45,55,65,75,85,95 ℃;提取時間1.0,1.5,2.0,2.5,3.0,3.5,4.0h;料液比1∶9,1∶12,1∶15,1∶18,1∶21,1∶24,1∶27(m∶V)。
(2)中心組合試驗設計:在單因素試驗的基礎上,采用Design Expert 7.0.0軟件,根據 Box-Behnken的中心組合試驗設計原理[9,10],設計3因素3水平的響應面分析試驗優化水紅花子中花旗松素的乙醇回流提取工藝。
2 結果與分析
2.1 單因素試驗結果
2.1.1 乙醇濃度對花旗松素提取量的影響 由圖2可知,隨著溶劑體積分數的提高,花旗松素提取量增大,體積分數在65%時,提取量達到最大;體積分數繼續增大,花旗松素提取量降低。乙醇水溶液隨乙醇體積分數的增加而極性減小,花旗松素是多酚羥基化合物[5],其極性比無水乙醇強比水弱,試驗結果說明花旗松素的極性與體積分數65%的乙醇溶液相似。而且隨著乙醇濃度增加,脂溶性雜質溶出量增加,對花旗松素吸光度的測定也會存在干擾,因此乙醇體積分數選擇在55%~75%較為適宜。

圖2 乙醇濃度對花旗松素提取量的影響Figure 2 The influence of ethanol concentration on taxifolin extraction yield
2.1.2 提取溫度對花旗松素提取量的影響 由圖3可知,花旗松素的提取量隨著提取溫度的提高而增加。溫度的升高,有助于傳質過程,使分子擴散運動激烈,加快溶質的擴散和溶劑的滲透[11]。溫度過高,黃酮類化合物容易被氧化而受到破壞,溶劑容易揮發[12]。綜合考慮,提取溫度在95℃較為適宜。
2.1.3 提取時間對花旗松素提取量的影響 由圖4可知,花旗松素提取量隨提取時間的增大而增大,當時間達到3h后,隨提取時間的增加提取量的提高不明顯。這主要是由于隨著提取時間的延長,細胞內外濃度達到平衡,活性成分不再溶出[13]。因此,選擇提取時間在3h左右較為合適。

圖3 提取溫度對花旗松素提取量的影響Figure 3 The influence of extracting temperature on taxifolin extraction yield
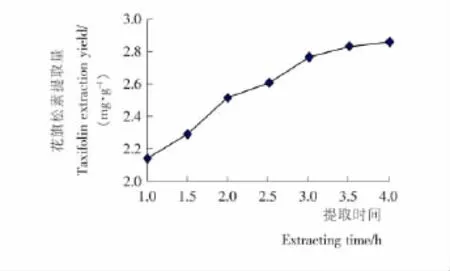
圖4 提取時間對花旗松素提取量的影響Figure 4 The influence of extracting time on taxifolin extraction yield
2.1.4 料液比對花旗松素提取量的影響 由圖5可知,花旗松素提取量隨著料液比的減小先增大,當料液比降到1∶18(m∶V)以后提取量下降。由此可見,增加溶劑用量有利于花旗松素的溶出,但溶劑用量過大,雜質溶出量增加,干擾測定,使提取量下降,同時造成溶劑的浪費。因此選擇料液比為1∶15~1∶21(m∶V)較合適。
2.2 響應面法優化提取工藝
2.2.1 響應面設計與結果分析 根據單因素試驗結果,固定提取提取溫度95℃和提取次數1次,以花旗松素提取量為響應值,選取乙醇體積分數、提取溫度、料液比為自變量進行響應面分析設計試驗(表1)。
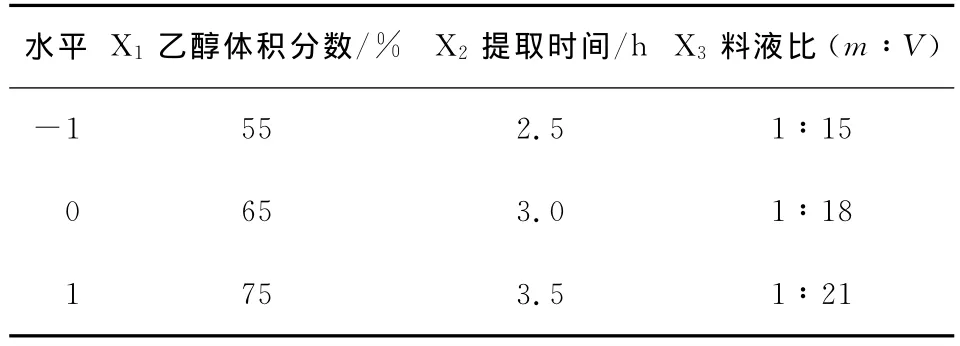
表1 中心組合設計的因素與水平Table 1 Variables and levels in central composite design
對所得的試驗數據(表2)進行多元回歸擬合,得到多元二次回歸方程:


表2 中心組合試驗方案與結果Table 2 Central composite design matrix and corresponding results
由表3可知,模型達到極顯著水平(P<0.000 1);方程的失擬誤差P=0.325 3,表現為不顯著;模型的相關系數R2=0.994 3,說明響應值的變化有99.43%來源于所選變量[14];方差分析結果中,X1、X2、X3、X21、X22、X23對試驗結果影響極顯著(P<0.01),X1X2對試驗結果影響顯著(P<0.05),其他項不顯著;各因素對花旗松素提取量的影響大小,提取時間影響最大,其次是乙醇體積分數,料液比影響最小。
2.2.2 各兩因素交互作用對花旗松素提取量的影響 響應曲面的坡度越陡峭,表明響應值對因素的改變越敏感。等高線揭示了交互作用的規律,圖中等值線密的方向,對應的坐標所表示的因素為交互作用的主要方面[15]。由圖6可知,X1和X2交互作用顯著,各因素對花旗松素提取量影響的大小順序為X2>X1>X3,這與方差分析結果一致。
2.2.3 花旗松素提取工藝條件的確定 由回歸模型預測的工藝條件為乙醇體積分數62.52%、提取時間3.37h、料液比1∶19.29(m∶V),預測花旗松素提取量理論值5.95mg/g。為了試驗操作簡便,調整工藝條件為乙醇體積分數63%、提取時間3.4h、料液比1∶19(m∶V),得到的提取量是5.94mg/g,說明預測值與實際值之間有很好的擬合性,采用響應面法優化得到的花旗松素提取工藝參數準確可靠。

表3 方差分析結果?Table 3 Result of analysis of variance

圖6 響應面分析圖Figure 6 Response surface
結合上述優化條件,考察提取次數對花旗松素提取量的影響,精密稱取5.00g水紅花子粉末,反復回流提取3次,收集各次提取液,稀釋,在290nm處測定花旗松素溶液的吸光度,計算各處理的花旗松素提取量。
由圖7可知,隨著提取次數的增加,花旗松素提取量明顯下降,3次提取的總提取量為7.42mg/g,第1次的提取量5.94mg/g,第2次的提取量為1.26mg/g,第3次的提取量為0.22mg/g,提取2次的提取量總和為7.2mg/g,占總提取量的97.04%。提取2次后,水紅花子中花旗松素殘留量已經很少,因此,確定提取次數為2次。綜上得出水紅花子花旗松素的提取工藝條件為乙醇體積分數63%、提取時間3.4h、料液比1∶19(m∶V)、提取溫度95℃、提取2次。
3 結論
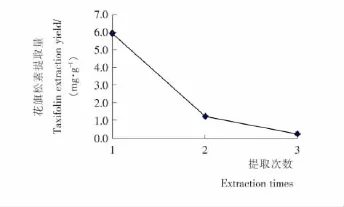
圖7 提取次數對花旗松素提取率的影響Figure 7 The influence of extraction times on taxifolin extraction yield
本研究采用響應面法優化水紅花子中花旗松素的乙醇回流提取工藝,得出最佳提取工藝條件為乙醇體積分數63%、提取時間3.4h、料液比1∶19(m∶V)、提取溫度95℃、提取2次,此時花旗松素提取量為7.2mg/g。影響花旗松素提取量的各因素的大小順序為提取時間>乙醇體積分數>料液比。
1 張繼振,林茂.紅蓼果實黃酮化合物的研究[J].中草藥,1990,21(8):7~8,28.
2 楊國勛,宋蕾,李奎蓮,等.紅蓼果實化學成分的研究[J].中國藥學雜志,2003,38(5):338~340.
3 楊衛萍.水紅花子化學成分的研究[D].長春:吉林大學,2008.
4 喬華,謝鋆,張曉云.花旗松素的生物活性及其應用[J].中草藥,2003,34(8):15~17.
5 趙艷萍.花旗松素納米給藥系統的研究[D].蘭州:蘭州大學,2010.
6 徐紅艷,包怡紅.天然產物中二氫槲皮素分離純化及發展趨勢[J].食品與機械,2010,26(5):173~176.
7 劉瑞林,詹漢英,陳鈿,等.響應曲面優化超聲輔助提取山茱萸籽油工藝及其成分分析[J].食品科學,2012,33(12):1~7.
8 劉東,林書玉,梁戈亮.分光光度法測水紅花子中花旗松素含量[J].現代生物醫學進展.2008,8(2):331~332.
9 楊文雄,高彥祥.響應面法及其在食品工業中的應用[J].中國食品添加劑,2005(2):68~71.
10 費榮昌.試驗設計與數據處理[M].無錫:江南大學出版社,2001:59~63.
11 肖衛華,韓魯佳.黃芪黃酮乙醇回流提取工藝的研究[J].食品工業科技,2008,29(1):233~235.
12 甘正偉,陳學澤.香薷總黃酮化合物提取工藝研究[J].食品與機械,2012,28(2):135~138.
13 劉軍海,任惠蘭,裘愛泳.杜仲葉中總黃酮提取工藝研究[J].食品與機械,2007,23(4):92~94,118.
14 吳暉,賴富饒,胡筱波.響應面分析法優化油菜花粉多糖提取工藝的研究[J].食品與機械,2007,23(5):66~69,73.
15 蒲彪,姚佳.鮮食青花椒熱處理工藝[J].食品科學,2012,33(12):46~51.

