生物肥料多功能芽孢桿菌的篩選及其作用機理研究
張艷群,來航線,韋小敏,王旭東
(西北農林科技大學資源環境學院,陜西楊凌712100)
生物有機肥是多種有益微生物菌群與有機肥結合形成的新型、高效、安全的微生物-有機復合肥料。施入后能提高肥料利用率,調節植株代謝,增強根系活力和養分吸收能力[1-3]。目前,運用生物肥料中的有益微生物防治植物病害以及生物凈化環境已成為研究熱點,其中具有產孢功能,耐熱和耐干旱的芽孢桿菌越來越為人們所關注[4-6]。
芽孢桿菌是一類好氧和兼性厭氧、產生抗逆性內生孢子的革蘭氏陽性桿狀細菌或球狀細菌。具有抗逆性強、生長快速、適應范圍廣等優點[7],加之易于制成粉劑,便于儲藏運輸,利于實現大規模生產,具有很好的應用前景和極大的開發潛力。
植物病害生防芽孢桿菌的研究開發應用目前已取得了令人矚目的成就,但仍存很多問題,如功能菌種單一,效果不穩定[8]。目前,國內外的研究主要集中于PGPR類制劑,而且多見于生物防治等領域[9-10]。大多數研究都集中于單一功能生物因子或同一功能的不同生物因子的功能菌群的研究[8],對芽孢桿菌的研究相對較少,尤其對多功能芽孢菌株篩選或功能芽孢菌株的復配組合研究甚少。因此,本研究以芽孢桿菌的抑病、促生、活化養分及改善微生物區系四個方面為出發點,通過皿內拮抗試驗、盆栽促生試驗及土壤養分和微生物類群的測定,旨在篩選多功能芽孢桿菌,通過組合得到最優芽孢桿菌組合,為功能型生物有機肥的研發和生產提供理論和實踐指導。
1 材料與方法
1.1 試驗材料
1.1.1供試菌株 芽孢桿菌:菌株B05、B06、B09,均為中國工業微生物菌種保藏管理中心(CICC)提供的可作為生物肥料開發的功能菌株,分別為蠟狀芽孢桿菌 (Bacillus cereus,CICC編號為21688)、枯草芽孢桿菌 (Bacillus subtilis,CICC編號為63501)和蠟狀芽孢桿菌 (Bacillus cereus,CICC編號為21687),其余的6株芽孢桿菌為側孢芽孢桿菌B01(Bacillus laterosporus)、枯草芽孢桿菌B02(Bacillus subtilis)、枯草芽孢桿菌B03(Bacillus subtilis)、地衣芽孢桿菌B04(Bacillus licheniformis)、枯草芽孢桿菌B07(Bacillus subtilis)、納豆芽孢桿菌B08(Bacillus natto),均為本實驗室分離鑒定及保藏的可用于肥料開發應用的芽孢菌株。
病原真菌:茄鐮刀菌F01、鐮刀菌F02、尖孢鐮刀菌F03、尖孢鐮刀菌F04、腐皮鐮刀菌F05、腐皮鐮刀菌 F06、甜瓜蔓枯病菌 F07、甜瓜根腐病菌F08,均由西北農林科技大學資源環境學院微生物課題組薛泉宏教授提供。F01、F02為土豆致病菌,F03~F06為黃瓜致病菌,F07、F08為甜瓜致病菌。
1.1.2供試植物 小白菜品種“金早生小白菜F1”由陜西秦興種苗有限公司提供。盆栽試驗土壤采自西北農林科技大學試驗田,為摟土。
1.1.3供試培養基[11]改良牛肉膏-蛋白胨瓊脂培養基(NA)用于芽孢桿菌和病原細菌的培養與保存;牛肉膏-蛋白胨液體培養基(NB)用于芽孢桿菌的液體發酵培養;病原菌真菌培養基(PDA)用于植物病原真菌的培養與保存;高氏一號培養基用于微生物區系分析。
1.2 測定方法
1.2.1 9株芽孢桿菌抗菌譜的測定[12]采用平板對峙培養法,在PDA平板中央接入培養18 h的拮抗芽孢桿菌菌碟(φ=5 mm),距拮抗細菌四周2 cm處接種培養3~5 d的植物病原真菌菌碟(φ=5 mm),以平板中央不接種拮抗細菌為對照,28℃ 培養,待對照長滿平板時,測量抑菌帶寬及拮抗細菌菌落半徑,計算抑制率。抑制率(%)=抑菌帶寬/拮抗細菌菌落半徑×100。
1.2.2 9株芽孢桿菌發酵液拮抗能力的測定[13]將NA斜面培養基上活化18 h左右的芽孢桿菌接入NB液體培養基,37℃ 200 r/min發酵72 h后,4℃15000 r/min離心30 min,收集上清液,并經細菌濾器(孔徑0.22 μm)過濾,即得無菌發酵液。采用瓊脂塊培養法,將芽孢桿菌發酵液傾入冷卻45℃ 左右的PDA培養基中,混勻后倒平板,待冷凝后,在平板上接種病原菌碟,以不加無菌發酵液的PDA平板為對照,28℃ 培養5 d,待對照菌落長滿平皿2/3時,用十字交叉法測量病原菌菌落直徑,計算生長抑制率。抑制率(%)=(對照組菌落直徑-處理組菌落直徑)/(對照組菌落直徑 -原菌碟直徑)×100。
1.2.3小白菜生物量的測定[14]采用菌懸液澆灌土壤接種法,將小白菜的種子用無菌水浸種24 h后,播種于裝有田間土的盆缽中,10個處理,每個處理20個重復,常規方法育苗,待真葉長出后,將9株芽孢桿菌的菌懸液(×108cfu/mL)分別澆灌于各植株根部土壤,以清水為空白對照。接種后,定期測定地上部分和地下部分鮮重和干重。
1.2.4土壤中養分的測定[15]采集1.2.3中10種處理播種前、種植中期及收獲后的鮮、干土樣,測定土壤養分狀況。土壤pH用DELTA320pH計測定;有機質用重鉻酸鉀容量法;全氮用凱氏定氮法;速效氮用靛酚藍比色法;全磷和全鉀用NaOH熔融—火焰光度計法;速效磷用鉬銻抗比色法,速效鉀用NH4OAc浸提—火焰光度計法測定。
1.2.5土壤中微生物類群的測定[16]采用平板菌落計數法,真菌稀釋至 10-1、10-2、10-3涂平板,28℃培養 5 d;細菌稀釋至 10-4、10-5、10-6涂平板,37℃ 培養24 h;放線菌稀釋至10-3、10-4、10-5涂平板,28℃ 培養7 d;芽孢菌數的測定是將細菌稀釋度為 10-3、10-4、10-5的試管 80 ℃水浴 30 min后涂平板,37℃ 培養24 h。
1.2.6 9株芽孢桿菌室內相容性試驗[17]將9株芽孢桿菌在NA斜面上活化后,制成菌懸液(約108cfu/mL),分別加入無菌的濾紙片(φ=5 mm)浸泡10 min。取0.1 mL B01菌懸液于新鮮 NA平板上均勻涂布10 min后,將蘸有另外8株芽孢桿菌菌懸液的濾紙片貼在平皿上,28℃ 恒溫培養48 h后觀察抑菌圈的形成情況。用同樣方法驗證菌株 B02及其他菌株之間的相容性。
試驗數據用Excel 2003和SASS 13.0統計軟件進行統計分析,LSD法進行差異顯著性檢驗。
2 結果與分析
2.1 9株芽孢桿菌抗菌譜的測定
通過對峙培養法,對9株芽孢桿菌的抗菌譜進行了測定。由表1和表2可以看出,除菌株B09外,其余8株芽孢桿菌對植物病原真菌均有不同程度的抑制作用。菌株B06和B07抗菌譜最廣、拮抗活性最高,對8種病原菌都有抑制作用,B06對7種病原菌的抑菌帶寬都大于4 mm,對4株病原菌的R2/R1≥1;B07次之,對4種病原菌的抑菌帶寬都大于4 mm,對3株病原菌的 R2/R1≥1。B01、B02、B03和B04分別僅對2種或4種病原菌的抑菌帶寬大于4 mm,其中僅3株都對2種病原菌R2/R1≧1;菌株B05僅對2種病原菌有較弱的抑制作用。菌株B08抗菌譜也較廣,但抑制作用較弱。
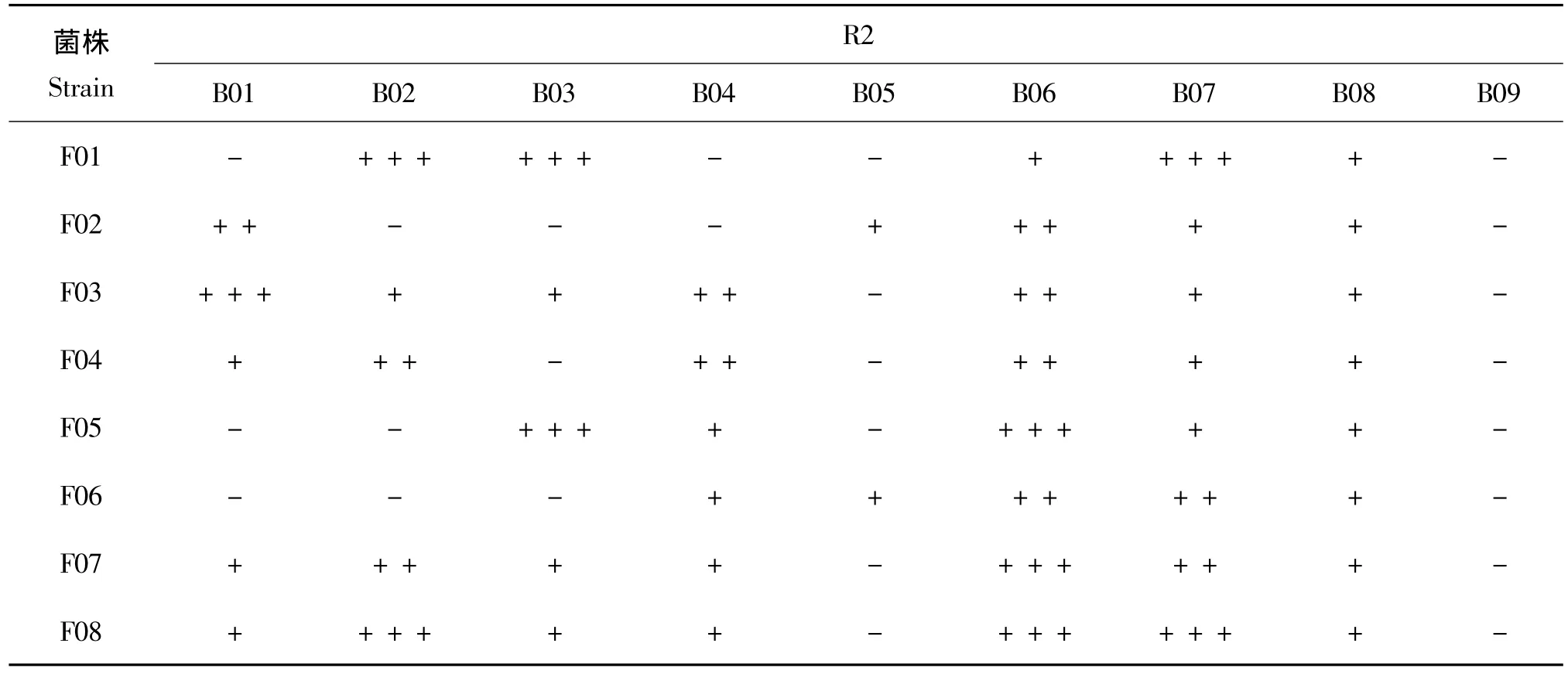
表1 9株芽孢桿菌菌體對8種植物病原菌的抑制能力Table 1 Antagonistic capabilities of the 9 bacillus strains to 8 pathogens

表2 9株芽孢桿菌對8種植物病原菌的抑制作用Table 2 Inhibitory effects of the 9 bacillus strains against 8 pathogens
2.2 9株芽孢桿菌發酵液拮抗活性的測定
通過瓊脂塊法,進行了9株芽孢桿菌發酵液拮抗活性的測定。由表3可以看出,菌株B02、B04、B06和B07發酵液的抗菌譜最廣,對8株植物病原菌都有抑制作用。其中B06和B07的抑菌活性最好。B06對8株病原菌的抑制率為66.7% ~87.5%;B07對8株病原菌的抑制率為55.6% ~81.3%;B02次之,對8株病原菌的抑制率為32.3% ~64.9%。菌株B01、B03、B05和B08分別都對7種病原菌有抑制作用,B09僅對5種病原菌有抑制作用,抑制率范圍為2.8% ~51.4%。綜合抗菌譜和發酵液拮抗活力的測定結果,得出菌株B06的拮抗活性最高,B07次之。

表3 9株芽孢桿菌無菌濾液對8種病原真菌的拮抗試驗結果Table 3 Inhibitory rates of the 9 bacillus sterile fermentation filtrates against 8 pathogens fungi
2.3 9株芽孢桿菌菌懸液處理對小白菜生長的影響
播種前盆栽土壤的基本養分狀況:pH 7.3左右、有機質含量38.15 g/kg、全氮1.79 g/kg、速效氮481.28 mg/kg、全磷1.27 g/kg、速效磷304.06 mg/kg、全鉀12.48 g/kg、速效鉀363.9 mg/kg。
采用菌懸液澆灌土壤法,對不同時期小白菜植株的生長狀況進行了測定,表4結果顯示,30 d時,B03和B04菌懸液處理的小白菜苗和根的干重與對照差異顯著,具有促生作用,苗干重比對照分別增長了36.4%、27.3%。其余各菌株處理與對照無顯著性差異或低于對照水平,未表現出促生作用。60 d時,除B02和B08外,其余各菌株菌懸液處理的小白菜苗干重和根干重與對照相比差異性顯著,表現出了促生作用。菌株B04、B05、B07和B09菌懸液處理的小白菜苗干重和根干重與對照相比差異顯著,苗干重比對照分別增加了44.3%、38.8%、38.2% 和36.4%,促生作用顯著。菌株B01、B03和B06促生作用相對較弱,苗干重比對照增加了7.6% ~27.4%。

表4 9株芽孢桿菌菌懸液處理30 d和60 d對白菜苗生長的影響Table 4 Influence of 9 bacillus strain on the growth of cabbage in 30 days and in 60 days
2.4 9株芽孢桿菌菌懸液處理對不同時期土壤養分變化的影響
養分活化的界定:若處理組全量氮、全量磷或全量鉀的含量大于或等于對照組的水平,且處理組速效氮、速效磷或速效鉀的含量大于對照組的含量,則具有活化氮、磷或鉀的作用;反之則不具有活化氮、磷或鉀的作用[15]。
通過盆栽試驗測定了9株芽孢桿菌菌懸液處理對不同時期土壤養分的活化作用,結果見表5和表6。由表5可以看出,9株芽孢桿菌菌懸液處理30 d時,土壤中有機質含量與對照差異顯著,比對照增加了8.1% ~52.2%。菌株 B03、B04、B05、B06和B09菌懸液處理土壤中全氮和速效氮的含量大于或等于對照水平,具有活化氮的作用,菌株B03活化氮的能力最強,活化率為23.2%;9株芽孢桿菌處理的全磷含量都低于對照水平,均無活化磷的作用。菌株B03、B04、B05、B07和 B09菌懸液處理的全鉀和速效鉀含量顯著高于對照水平,具有活化鉀的作用,且B05活化鉀的能力最強,活化率為26.8%;其次是 B07,活化率為13.5%。
由表6可以看出,9株芽孢桿菌菌懸液處理60 d時,除菌株B01外,其余各菌株處理的有機質含量均高于對照水平,其中B03、B06、B07和 B09菌懸液處理的有機質含量較高為38.2~38.9 g/kg。菌株B01和B06菌懸液處理的全氮和速效氮含量大于或等于對照水平,具有活化氮的作用,且 B06的活化率最高為19.5%。B01和 B09菌懸液處理的全磷和速效磷的含量高于對照水平,具有活化磷的作用,且B09活化率最高為8.4%。菌株B06菌懸液處理的全鉀和速效鉀的含量大于或等于對照水平,具有活化鉀的作用,活化率為21.4%。

表5 9株芽孢桿菌菌懸液處理30 d對土壤養分的影響Table 5 Influence of 30 days treatment of the 9 bacillus suspended liquid on soil nutrients

表6 9株芽孢桿菌菌懸液處理60 d對土壤養分的影響Table 6 Influence of 60 days treatment of the 9 bacillus suspended liquid on soil nutrients
2.5 9株芽孢桿菌對土壤微生物區系的影響
通過盆栽試驗測定了9株芽孢桿菌接種不同時期對土壤微生物類群的影響(表7),由表7可以看出,9株芽孢桿菌菌懸液處理30 d~60 d時,土壤中細菌和放線菌的數量和種類較對照均有增加,分別是對照的6.1~11.6倍和1.2~1.6倍;真菌的數量和種類明顯呈減少的趨勢,真菌的數量比對照減少了35%~75%。以上結果表明,9株芽孢桿菌菌懸液接入土壤后,使土壤中細菌和放線菌數量增加,土壤中真菌數量減少,減少了病害發生,有利于土壤中微生物菌群的改善,朝平衡的方向發展[18]。

表7 接種9株芽孢桿菌30 d和60 d后小白菜根區土壤微生物的數量Table 7 Microbial quantities in the places of cabbage's rhizosphere after inoculated the 9 bacillus strains at the 30 and 60 days
2.6 室內相容性試驗
9株芽孢桿菌的室內相容性試驗結果為:B06、B08、B09拮抗B01;所有菌株與 B02無拮抗作用;B04、B05、B06、B07、B08、B09 拮抗 B03;B02、B03、B05拮抗 B04;B04、B06、B08拮抗 B05;B03、B05拮抗 B06;B05、B09拮抗 B07;B05拮抗 B08;B04、B06、B07拮抗 B09。由以上結果可以得出9株芽孢桿菌相容的組合有:B01-B02-B03;B01-B02-B05;B01-B02-B07;B01-B04-B07;B04-B06-B07-B08;B02-B06-B07-B08;B02-B05-B09;B02-B08-B09。綜合2.1~2.5的試驗結果,可以得出最優復配組合為 B01-B04-B07和B04-B06-B07。
3 討論與結論
在植物病害生防細菌中,芽孢桿菌是最易從土壤和植株中分離得到,并對多種土傳真菌病害具有較好防病作用的一類重要細菌。在農業生產中,芽孢桿菌在防病的穩定性、與化學農藥的相容性等方面表現出非芽孢細菌所沒有的優勢。因此,生防芽孢細菌的篩選對農業生物防治極其重要。本研究結果表明,9株芽孢桿菌 B01~B09的菌體和無菌代謝液對8種植物真菌病害有不同程度的抑制作用。菌株B06和B07對植物病原真菌的拮抗作用具有廣譜性和高效性。在PDA培養基上,菌株代謝液與培養基1∶4混合倒平板,菌株B06和B07對病原真菌腐皮鐮刀菌、甜瓜蔓枯病菌和甜瓜根腐病菌均具有較好的抑制作用,抑制率分別達到 75.3%、87.5%和78.6%。
許多根際防病芽孢桿菌對植物生長有促進作用,它們或者本身具有解磷、固氮解鉀等特殊生理功能,可以將物質轉化為植物所需的營養成分[19];或者產生多種生理活性物質刺激調節植物生長;或者通過刺激土壤中某些生理功能微生物的繁殖,加強土壤肥力,間接為寄主植物的生長提供更多養分,使植物處于良好的生長狀態[20]。小白菜盆栽試驗結果表明,供試的9株芽孢桿菌的大部分菌株對小白菜的生長具有不同程度的促進作用。菌株 B03和B04的促生作用較強,菌懸液處理后能顯著增加小白菜生物量,且處理后小白菜根系較對照健壯,能促進植物根系生長,對作物有增產作用。此外,這些芽孢桿菌還具有活化氮、磷和鉀的作用。初步可以認為供試芽孢桿菌對小白菜植株的促生作用是由于菌株自身具有解磷、解鉀和固氮等特殊生理功能將物質轉化為植物所需養分而導致的。
土壤中的微生物繁殖快、數量大、代謝能力強是生態系統中碳、氮、磷、鉀等元素的轉化因子和重要庫源,對平衡生態系統有著極其重要的意義。微生物區系結果分析表明,不同芽孢桿菌處理后,土壤中細菌和放線菌的數量和種類有所增加,真菌的數量和種類有所減少,說明外源接入特定細菌制劑對植株根域細菌和真菌數量會產生強烈影響。細菌在微生物3大類群中數量最多、比例最大,決定著植物根域微生態環境的菌群平衡和物質能量的轉化速度。因此,植株根域細菌數量的增加,真菌數量的減少,可促使植株根域土壤由真菌型向細菌型轉變,并減少了真菌性病害的發生。拮抗細菌和放線菌數量的增加,可對真菌性土傳病害形成防御屏障,促使植株根域微生物菌群朝有利的方向發展[21]。
近年來,國內外對生物肥料的研究不斷深入,微生物的種類也更加多元化,但對芽孢桿菌進行多元化的篩選及將具有不同功效的芽孢桿菌進行組合得到全效型和功能型的芽孢菌株或其組合仍然是生物肥料研制中的不足,同時又是一個研究熱點。本研究從抑病、促生、養分活化和改善微生物區系四個方面,篩選出了7株具有一種或多種功能的芽孢桿菌,并得到功能組合B04-B06-B07和B01-B04-B07,使微生物菌群在組成和功能上逐漸由單一走向多元化成為可能,為復合生物肥料的研發和生產提供了理論指導,對生物農業的快速發展具有重大意義。
[1] 趙秉強,張福鎖,廖宗文.我國新型肥料發展戰略研究[J].植物營養與肥料學報,2004,10(5):536-545.Zhao B Q,Zhang F S,Liao Z W.Study of the development strategy of our country’s new fertilizer[J].2004,10(5):536-545.
[2] 張毅民,萬先凱.微生物菌群在生物有機肥制備中研究進展[J].化學工業與工程,2003,20(6):523-526.Zhang Y M,Wan X K.Study progress of microbial flora in microbial organic fertilizer’s preparation[J].Chem.Ind.Eng.,20(6):523-526.
[3] 吳海燕,劉春光,呂鴻飛,等.吉林省生物有機肥產業化的現狀與發展趨勢[J].吉林農業科學,2007,32(6):32-35.Wu H Y,Liu C G,Lv H F et al.Present situation and development tendency of microbial organic fertilizer's industrialization in Jilin province[J].J.Jilin Agric.Sci.,2007,32(6):32-35.
[4] 吳秀紅,張新中,周永燦,等.關于芽孢桿菌Bacillus應用概述[J].現代漁業信息,2007,22(7):47-55.Wu X H,Zhang X Z,Zhou Y C et al.Outline of related Bacillus spp[J].Mod.Fishery Inform.,2007,22(7):47-55.
[5] Zhou Q X, Song Y F, Sun T H. Study progressof bioremediation’s application[J].Prog.Nat.Sci.,2004,14(7):721-728.
[6] John M.W.Microbial interactions and biocontrol rhizosphere[J].J.Experim.Bot.,2001,52:487-511.
[7] 于淑池.植物真菌病害生防芽孢桿菌的研究進展[J].通化師范學院學報,2007,28(8):52-54.Yu S C.Study progress of bio-control bacillus to plant fungal diseases[J].J.Tonghua Norm.Coll.,2007,28(8):52-54.
[8] Guetsky R,Sht ienberg D,Elad Y et al.Combining biocontrol agents to reduce the variability ofbiologicalcontrol[J].Phytopathology,2001,91:621-627.
[9] Jotiyanon K.Mixtures of plant growth-promoting rhizobacteria for induction of systemic resistance against multiple plant diseases[J].Biol.Control,2002,24(3):285,291.
[10] Ozlem K.Comparison of strains of lysobacter enzymogenes and PGPR for incuction of resistance against bopolaris sorokinia in tall fescue[J].Biol.Control,2004,3(2):446,455.
[11] 程麗娟,薛泉宏.微生物學實驗教程[M].西安:世界圖書出版社,2000.383-385.Cheng L J,Xue Q H.Microbiology experiment tutorial[M].Xi’an:The World Book Publishing House,2000.383-385.
[12] 馮書亮,王容燕,林開春,等.拮抗細菌Bs-208菌株鑒定及對幾種植物病原菌的抑菌測定[J].中國生物防治,2003,19(4):171-174.Feng S L,Wang R Y,Lin K C et al.Identification of antagonistic bacterium Bs-208 and its inhibition to some pathogenic fungi[J].Chin.Biol.Control,2003,19(4):171-174.
[13] 郭金鵬,劉曉昌,仝贊華,等.芽孢桿菌HSY.8.1對植物病原真菌的抑制及其抑菌產物特性[J].吉林農業大學學報,2010,32(1):29-33,50.Guo J P,Liu X C,Tong Z H et al.Inhibition of bacillus strain HSY.8.1 to pathogenic fungiand characteristic ofits bacteriostatic product[J].J.Jilin Agric.Univ.,2010,32(1):29-33,50.
[14] 何紅.辣椒內生枯草芽孢桿菌Bacillus subtilis防病促生作用的研究[D].福州:福建農林大學博士學位論文,2003.He H.Study of disease prevention and growth promotion of chiliendogenous bacillus subtilis[D].Fuzhou:PhD dissertation,Fujian Agriculture and Forestry University,2003.
[15] 鮑士旦.土壤農化分析第三版[M].北京:中國農業出版社,2000.30-183.Bao S D.Analysis of soil agriculture and chemical[M].Beijing:China Agriculture Press,2000.30-183.
[16] 邱思鑫.防病、促生植物內生芽孢桿菌的研究[D].福州:福建農林大學博士學位論文,2004.Qiu S X.Study of disease prevented and growth promoted of plant endogenous bacillus[D].Fuzhou:PhD dissertation,Fujian Agriculture and Forestry University,2004.
[17] 張昕,張炳欣,趙宇華,等.多功能菌群混合施用的生態效應[J].應用生態學報,2005,16(10):1909-1912.Zhang X,Zhang B X,Zhao Y H et al.Ecological effect of multifunctional flora mixed use[J].Chin.J.Appl.Ecol.,2005,16(10):1909-1912.
[18] 郭志英.生防菌劑接種方法對辣椒防病促生作用及根區微生態的影響[D].陜西楊凌:西北農林科技大學碩士學位論文,2008.GuoZ Y.Effectofdifferentvaccinalmethod ofbiocontrolpreparations on chili resistance and growth and root zone microecology[D]. Yangling, Shaanxi:NorthwestA&F University,2008
[19] 王素英.對作物具有促生和防病作用的細菌組合的篩選[D].北京:中國農業大學碩士學位論文,2003.Wang S Y.Screening of bacterial combinations with the role of promotion and prevention to crops[D].Beijing:Ms thesis,China agricultural university,2003.
[20] 張霞,唐文華,張力群.枯草芽抱桿菌B931防治植物病害和促進植物生長的作用[J].作物學報,2007:33(2):236-241.Zhang X,Tang W H,Zhang L Q.The study of Bacillus subtilis B931 to prevent and control plant diseases and promote plant growth[J].J.Crops,2007:33(2):236-241.
[21] 周永強,薛泉宏,楊斌,等.生防放線菌對西瓜根域微生態的調整效應[J].西北農林科技大學學報(自然科學版),2008,36(4):143-150.Zhou Y Q,Xue Q H,Yang B et al.Adjusted effect of inoculating with bio-control actinomyces on micro bial flora of watermelon rooting zone[J].J.Northwest A&F Univ.(Nat.Sci.Ed.),2008,36(4):143-150.

