擠壓組織化對小麥面筋蛋白結構影響的研究
馬 寧 朱科學 郭曉娜 彭 偉 周惠明
(江南大學食品學院,無錫 214122)
近年來,由于禽流感、口蹄疫等動物疾病的發生和宗教信仰、素食主義等原因,替代肉制品越來越受到人們的重視。組織化植物蛋白(TVP)以植物蛋白為原料,經擠壓加工得到。TVP蛋白質含量高(一般高于56%,干基),無膽固醇,復水后具有肉類的纖維結構和咀嚼感,是一種理想的肉類替代品[1]。
作為TVP的主要成分,蛋白質的變化及蛋白質-蛋白質之間的相互作用是TVP組織化得以形成的關鍵,也是擠壓植物蛋白組織化機理研究的主要內容和焦點。前人的研究多集中在對大豆蛋白和花生蛋白的探討上,研究表明,不同擠壓原料、操作參數下得到的研究結果有很大出入[2]。本試驗以谷朊粉為主要原料,系統研究了小麥面筋蛋白在擠壓過程中的變化及擠壓過程中蛋白質-蛋白質之間的作用,為制備高質量的TWP提供理論基礎。
1 材料與方法
1.1 試驗材料
谷朊粉:安徽古井集團,蛋白質質量分數76.2%,干基;小麥粉:安徽瑞福祥食品有限公司,蛋白質質量分數12.1%,干基。
1.2 儀器和設備
DYY-Ⅲ23A型電泳槽:北京六一儀器廠;Nexus智能傅立葉紅外光譜儀:美國Thermo Nicolet公司;Agilent1100液相色譜儀:美國安捷倫公司;UV-2800型紫外分光光度計:尤尼柯上海儀器制造公司。
1.3 試驗方法
1.3.1 小麥面筋蛋白擠壓試驗
擠壓試驗在布勒中國無錫擠壓實驗室完成,擠壓機型號CAMPACtwinTM62,螺桿直徑62 mm,長徑比20∶1。喂料速度:150 kg/h;調制器用水溫度:常溫;擠壓機Ⅱ區、Ⅲ區、Ⅴ區的溫度分別為155℃、155℃、175℃;物料含水量:24.0%(以物料100%計);螺桿轉速:400 r/min;模孔尺寸:2 mm×56 mm;小麥粉質量分數:7.0%,谷朊粉質量分數93.0%。
1.3.2 小麥面筋蛋白擠壓前后亞基變化
采用SDS-PAGE法分析小麥面筋蛋白擠壓前后亞基的變化[3]。
選用10%分離膠,4%濃縮膠,考馬斯亮藍G-250染色。上樣液的配制:精確稱取10.3 mg的樣品溶解于1 mL的上樣緩沖液中,離心(16 000×g,10 min)取上清液。還原和非還原的SDS-PAGE的區別在于加與不加β-巰基乙醇(2-ME)。采用兔磷酸化酶B(97 400 u)、牛血清白蛋白(66 200 u)、兔肌動蛋白(43 000 u)、牛碳酸酐酶(31 000 u)、胰蛋白酶抑制劑(20 100 u)、雞蛋清溶菌酶(14 400 u)作為相對分子量標準。
1.3.3 小麥面筋蛋白擠壓前后溶解度試驗及化學交聯鍵分析
參照 Prudencio-Ferreira等[4]的方法,利用蛋白質在不同裂解液中溶解度的不同分析蛋白質-蛋白質的交聯方式。
浸提溶液:A、pH7.6,0.035 mol/L 磷酸鹽緩沖液;B、pH7.6 ,A+0.015 g/mL SDS;C、pH7.6,A+0.1 mol/L 2 - ME;D、A+pH7.6,0.015 g/mLSDS+0.1 mol/L 2 -ME。
蛋白質浸提:原料(WG)和擠壓樣品(TWP)冷凍干燥后粉碎備用。稱取冷凍干燥后的待測樣0.500 g左右,分別加入10 mL上述不同浸提液中,在恒溫水浴振蕩器中室溫浸提2 h,離心(16 000×g,10 min)后取上清液。沉淀中再分別加入10 mL上述浸提液,重復浸提,離心。合并兩次上清液于50 mL容量瓶中,定容,得樣品蛋白質浸提溶液。蛋白質含量用改良后微量凱氏定氮法測定。試驗重復2次。
蛋白質溶解度=[上清液中蛋白質(g)/樣品中蛋白質(g)]×100%
化學交聯鍵分析:參考 Hanger[5]的方法。①天然狀態蛋白質,即溶解于pH7.6磷酸鹽緩沖液中的蛋白質;②以非共價鍵結合的蛋白質=溶于B-溶于A;③以共價鍵結合的蛋白質=溶于C-溶于A;④以二硫鍵和非共價鍵交互作用結合的蛋白質=溶于D-溶于B-溶于C+溶于A。
1.3.4 小麥面筋蛋白擠壓前后游離巰基的變化
采用 DTNB 的方法測定[6-7]。稱取240 mg左右的樣品加到10 mL5 mol/L pH 8.0鹽酸胍/Tris-Gly溶液中,磁力攪拌 10 min,離心(5 000×g,30 min),分別取5 mL鹽酸胍/Tris-Gly和1.5 mL 1×10-3mol/L DTNB,將上述兩種溶液分別加入到3 mL上清液中。混合液在25℃恒溫水浴10 min后,在412 nm處測定吸光值。考馬斯亮藍法測定蛋白濃度。
游離巰基(μmol/g蛋白質)=(73.53×A412×D)/c
式中:73.53=106/13 600,D 為稀釋倍數(取值為9.5/3),c為樣品中蛋白質質量濃度/g/L。
1.3.5 小麥面筋蛋白擠壓前后半胱氨酸分析[8]
稱取120 mg的樣品與10 mL水解管中,加入5 mL 6 mol/L的鹽酸溶液酸水解,充氮封管,110℃下水解24 h。切開封管,洗滌定容至10 mL容量瓶中。抽干后,采用鄰苯二甲醛OPA柱前自動衍生,上Agilent1100液相色譜儀進行氨基酸組成分析。
1.3.6 小麥面筋蛋白擠壓前后二級結構的變化
采用傅里葉紅外光譜測定擠壓前后小麥面筋蛋白質的二級結構[9]。
樣品用研缽研碎,37℃真空干燥。取少量樣品與溴化鉀混合,放入瑪瑙研缽中,紅外燈下研磨10 min。10 kg壓力下壓制成厚薄均勻、呈半透明狀的薄片。將壓制好的薄片放入紅外光譜儀中掃描,得到樣品的傅里葉紅外光譜圖。測試前,先測空白背景圖。在 OmnicV6.2軟件內扣除背景后,采用peakfitV4.2軟件進行相應的圖譜處理分析。
1.4 試驗數據統計與分析
利用 Excel對數據進行整理和繪圖。使用SPSS16.0軟件對數據進行方差分析,選取Duncan測試,在P<0.05檢驗水平對數據進行統計學分析。
2 結果與討論
2.1 擠壓組織化對小麥面筋蛋白亞基的影響
從圖1非還原SDS-PAGE可以得知,與原料Y2有多個亞基條帶相比,J2樣品中幾乎觀察不到亞基條帶,僅在20 100 u和14 400 u有顏色較淺的條帶出現,且泳道上方也未見蛋白質聚集體,表明沒有出現溶出的蛋白未進入分離膠的情況。Anderson等[10]在研究面粉擠壓前后的變化時,也得出相同結果。結合非還原的SDS-PAGE溶解液中只添加了SDS,無β-巰基乙醇,樣品中只有以非共價鍵結合的蛋白質發生裂解,溶于樣品溶解液中。可以推斷:擠壓過程中,大量的小麥面筋蛋白亞基以共價鍵的連接形式發生了交聯,進而導致擠壓組織化的樣品并未被裂解溶于樣品溶解液中,故J2中無明顯條帶出現。
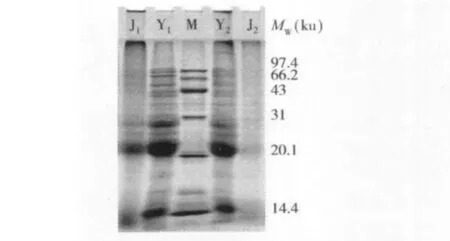
圖1 小麥面筋蛋白擠壓前后SDS-PAGE電泳圖
對比還原SDS-PAGE電泳圖可以發現:J1樣品電泳條帶中,97 400~14 400 u之間各亞基條帶顏色明顯變淺,高分子質量蛋白區(97 400~47 000 u)顏色變淺尤為明顯,但依然可以看出并未有條帶消失。且未出現新的亞基條帶,在大于97 400 u的位置和濃縮膠頂端出現了顏色較深的條帶。結合以上現象可以得出:小麥面筋蛋白經擠壓組織化后,并未發生亞基的裂解,而是發生聚合、交聯等變性反應,生成分子質量較大的聚合物。這些聚合物中較大分子質量的不能透過濃縮膠進入分離膠,較小的則透過濃縮膠,在分離膠的頂端發生聚集[11]。且這些聚合物可能是以酰胺鍵的形式結合,因為還原性的SDSPAGE溶解液中含有SDS和β-巰基乙醇,可同時將非共價鍵和二硫鍵裂解。
2.2 擠壓組織化對小麥面筋蛋白溶解度及化學交聯鍵的影響
構成蛋白質高級結構的力的作用類型是多樣的、復雜的,常見的有二硫鍵(共價鍵)、氫鍵、疏水作用、離子鍵、靜電作用等其他非共價鍵。2-ME和SDS可以分別破壞蛋白質分子之間的二硫鍵和非共價鍵(主要是疏水作用和氫鍵),利用樣品在不同化學鍵破壞溶劑中的溶解度的不同,可分析樣品蛋白質之間力的作用類型和重要性[12]。

表1 擠壓組織化對小麥面筋蛋白溶解度的影響
由表1可知,擠壓組織化后,TWP在A(磷酸鹽緩沖液)中的溶解度變化不顯著(P>0.05),在 B(SDS)和、C(2-ME)、D(SDS+2-ME)溶液中的溶解度均顯著下降(P<0.05)。
為了更直觀的分析各交聯鍵對維持蛋白質結構的貢獻,將樣品在不同裂解液中的溶解度轉換為化學鍵的形式[4],如表2所示。

表2 不同結合狀態小麥面筋蛋白的溶解度/%
從表2可知,維持原料小麥面筋蛋白之間交聯的貢獻大小依次是非共價鍵>二硫鍵和非共價鍵交互>天然狀態>二硫鍵,擠壓組織化之后,蛋白質之間的作用力依次是二硫鍵和非共價鍵交互>非共價鍵>天然狀態>二硫鍵。可以推斷,在擠壓過程中,有少量的非共價鍵出現斷裂,同時二硫鍵大量生成;維持TWP的主要化學鍵并不是某種單一的化學作用力,而是二硫鍵和非共價鍵之間的交互作用。
Liu等[13]分析了大豆蛋白在擠壓過程中蛋白質-蛋白質之間的作用,結果發現:擠壓過程中有大量的二硫鍵形成,非共價鍵并未有顯著改變,二硫鍵對組織化蛋白纖維結構的形成起最重要作用;Cheftel[14]也指出,影響擠壓組織化產品的化學鍵應該是共價鍵,因為在150℃、高剪切作用下,氫鍵、疏水鍵和靜電作用可能會打破。但張汆[15]通過研究擠壓花生蛋白認為:非共價鍵結合(疏水作用和氫鍵)作用是影響組織化結構的主要化學鍵,其次才是二硫鍵。不同研究結果可能是由于擠壓機、擠壓原料、擠壓條件不同所致。為了更直觀的探討二硫鍵在擠壓過程中的變化,我們對小麥蛋白擠壓組織化前后游離巰基和半胱氨酸的含量進行了分析。
從表1中還可以發現:小麥面筋蛋白和TWP在D溶液中的溶解度分別為95.73%和84.67%。這說明,在小麥面筋蛋白和TWP中,還分別有15%、5%左右的蛋白質之間的交聯鍵并未被SDS和2-ME打破,且擠壓組織化之后,這部分蛋白顯著的增加。這可能是由于:①SDS和2-ME并不能打破所有的非共價鍵和二硫鍵,尤其是種類較多的非共價鍵。未溶解的蛋白可能是以離子鍵、靜電作用等其他SDS不能打破的非共價鍵的方式交聯;②SDS和2-ME打破非共價鍵和二硫鍵的能力不足以完全破壞小麥面筋蛋白和TWP中的非共價鍵和二硫鍵,從而使蛋白質并未被完全浸提出。具體的原因還需進一步的研究探討。
2.3 擠壓組織化對小麥面筋蛋白游離巰基及半胱氨酸含量的影響
從表3可知,擠壓組織化之后,小麥面筋蛋白中游離巰基含量顯著的減少(P <0.05)。Li等[16]認為,擠壓后游離巰基的減少可以說明小麥面筋蛋白在擠壓過程中發生了變性,并通過分子間二硫鍵聚合。游離巰基減少通常伴隨著二硫鍵的增加,一般學者認為這是由于巰基發生氧化所致。Anderson等[10]則認為,在擠壓過程,巰基的減少還有可能是由于高剪切和熱的作用。

表3 擠壓組織化對小麥面筋蛋白中游離巰基的影響
小麥面筋蛋白中含硫氨基酸——半胱氨酸含量擠壓過后減少了32%。半胱氨酸的減少可能是兩個原因所致:半胱氨酸的巰基發生氧化,形成二硫鍵;半胱氨酸也可能與其他物質結合,生成具有擠壓風味的揮發性有機物。但目前還未有研究結果可以支持后者[17]。因此,可以得出,小麥面筋蛋白在擠壓組織化過程中,減少的半胱氨酸發生了氧化,生成二硫鍵。
2.4 擠壓組織化對小麥面筋蛋白二級結構的影響
從圖2可知,小麥面筋蛋白經擠壓組織化后,α-螺旋、無規則卷曲、β-折疊均有所減少,其中α-螺旋減少了33%,最為劇烈。β-轉角增加了73%。這可能是因為:α-螺旋在蛋白質二級結構中是最不穩定的結構[18]。因此,在擠壓過程中,α-螺旋首先轉化為較穩定的轉角結構,但并未完全發生轉變,仍保留部分α-螺旋。少量的無規卷曲和β-折疊也轉變為β-轉角。由此可見,擠壓組織化過程中,蛋白質的二級結構并未被完全破壞,只是發生了由部分不穩定結構向穩定構象的轉變。

圖2 谷朊粉擠壓前后蛋白質二級結構的變化
前人對擠壓植物蛋白組織化的二級結構研究很少,而且主要集中在大豆蛋白的研究。康立寧[9]認為,擠壓大豆蛋白組織化時,β-折疊幾乎保持不變,α-螺旋已完全轉化為轉角,無規卷曲也有所增加。且他指出,可將α-螺旋是否完全發生轉化作為大豆蛋白是否完全組織化的微觀標準。與本試驗結果比較,有一定的相同點,如轉角結構的增加和α-螺旋的減少,但并不完全相同。這可能與原料、擠壓機、操作參數的不同所引起。綜上所述,植物蛋白組織化過程中,蛋白質二級結構的變化是否有一定的共性,是否可以從二級結構的變化來判斷組織化的形成及程度仍需要進一步的系統研究。
3 結論
3.1 綜合小麥面筋蛋白擠壓組織化前后 SDSPAGE、溶解度變化、游離巰基變化及半胱氨酸的變化可知,擠壓組織化過程中,有大量二硫鍵生成,非共價鍵幾乎不變。
3.2 維持TWP蛋白質之間的力主要是二硫鍵和非共價鍵的交互作用,以單一的非共價鍵和二硫鍵結合在一起的蛋白質僅占12.81%和0.91%。
3.3 擠壓組織化并未完全破壞小麥面筋蛋白的的二級結構,其中的α-螺旋、無規則卷曲、β-折疊向穩定的β-轉角轉變。目前的研究還不能從二級結構的變化來判斷組織化是否形成及形成程度。
[1]Asgar M A,Fazilah A,Huda N,et al.Nonmeat protein alternatives as meat extenders and meat analogs[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):513-529
[2]Chen F L.Chemical Cross- Linking and Molecular Aggregation of Soybean Protein During Extrusion Cooking at Low and High Moisture Content[J].Food Science and Technology,2011,44(4):957 -962
[3]Pogna N E,Autran JC,Mellini F,et al.Chromosome1B - encoded gliadins and glutenin subunits in durum wheat:Genetics and relationship to gluten strength[J].Journal of Cereal Science,1990,11(1):15 -34
[4]Prudencio-Ferreira SH,Areas J A G.Protein-Protein Interactions in the Extrusion of Soya at Various Temperatures and Moisture Contents[J].Journal of Food Science,1993,58(2):378-381
[5]Hanger D F.Effect of extrusion upon soy concentrate solubility[J].Journal of Agriculture and Food Chemistry,1984,32(2):293-296
[6]Fischer T.Effect of extrusion cooking on protein modification in wheat flour[J].European Food Research and Technology,2004,218(2):128 -132
[7]李慧靜,田益玲,李寧,等.轉谷氨酰胺酶對小麥面粉加工品質的影響研究[J].農業工程學報,2008,24(02):232-236
[8]Koh BK,Lim ST.Effect of Hydroquinone on Wheat Gluten[J].Food Science and Biotech - Nology,2000.9(6):341 -345
[9]康立寧.大豆蛋白高水分擠壓組織化技術和機理研究[D].楊凌:西北農林科技大學,2007
[10]Anderson A K,Ng P K W.Changes in disulfide and sulfhydryl contents and electrophoretic patterns of extruded wheat flour proteins[J].Cereal Chemistry,2000,77(3):354-359
[11]陳鋒亮.植物蛋白擠壓組織化過程中水分的作用[D].北京:中國農業科學院,2010
[12]Liu K S,Hsieh Fu - Hung.Protein - Protein Interactions in High Moisture-Extruded Meat Analogs and Heat-Induced Soy Protein Gels[J].Journal of The American Oil Chemistry’Society,2007(84):741 -748
[13]Liu K S,Hsieh F H.Protein - Protein Interactions during High-Moisture Extrusion for Fibrous Meat Analogues and Comparison of Protein Solubility Methods Using Different Solvent System [J].Journal of Agricultural and Food Chemistry ,2008,56(3):2681 -2687
[14]Cheftel J C.New Protein Texturization Processes by Extrusion Cooking at High Moisture Levels[J],Food Reviews International,1992,8(2):235 -275
[15]張汆.花生蛋白擠壓組織化技術及其機理研究[D].楊凌:西北農林科技大學,2007
[16]Li M,Lee T C.Effect of extrusion temperature on solubility and molecularweight distribution of wheat flour proteins[J].Journal of Agricultural and Food Chemistry,1996,44(3):763-768
[17]Bredie W L P,Hassell G M,Guy R C E,et al.Aroma characteristics of extruded wheat flour and wheat starch containing added cysteine and reducing sugars[J].Journal of Cereal Science,1997,25(1):57 -63
[18]王彰,許時纓.食品化學[M].北京:中國輕工業出版社,2003:134.

