不同誘導(dǎo)階段的骨髓間充質(zhì)干細(xì)胞修復(fù)兔骨損傷的實驗研究
朱莎 凌斌 孫潔
因創(chuàng)傷或疾病造成的骨損傷極為常見。近年來,骨髓間充質(zhì)干細(xì)胞 (Bone mesenchymal stem cells,BMSCs)的臨床應(yīng)用已成為研究的熱點[1-5]。BMSCs在不同誘導(dǎo)劑的作用下,定向分化為各種組織的成體細(xì)胞前,都可能階段性地處于對應(yīng)的前體細(xì)胞或前體干細(xì)胞的狀態(tài),亦或是各種“專能干細(xì)胞”的狀態(tài)。而目前國內(nèi)尚無BMSCs誘導(dǎo)分化不同階段細(xì)胞移植治療組織損傷修復(fù)的療效評價和報道。本實驗將BMSCs誘導(dǎo)分化不同階段的細(xì)胞移植入骨損傷動物模型,比較不同分化階段的細(xì)胞對組織損傷修復(fù)的療效,確定最適宜移植的細(xì)胞時間和狀態(tài),從而最大程度發(fā)揮BMSCs在組織損傷修復(fù)中的作用。
1 材料與方法
1.1 主要材料試劑和儀器
H-DMEM培養(yǎng)基、標(biāo)準(zhǔn)胎牛血清(Gibco公司,美國),CD34、CD45 、CD73、CD105 抗體、 慢病毒包裝質(zhì)粒和表達(dá)質(zhì)粒:Vivid color TM pLenti6.2-GW/EmGFP Expression Control Vector及ViraPowerTM Lentivirus Expression System(Invitrogen公司,美國),蘇木精、伊紅(上海美季生物技術(shù)有限公司),胰蛋白酶、二甲基亞砜、4%多聚甲醛(Sigma公司,美國),堿性磷酸酶染液(南京建成科技有限公司)。
SW-CJ-2F百級層流超凈工作臺 (蘇州佳寶凈化工程設(shè)備有限公司),Heal Force HF240細(xì)胞培養(yǎng)箱(上海力申科學(xué)儀器有限公司),倒置相差顯微鏡(Nikon公司,日本),全自動脫水機、組織包埋機HISOCENTREZ(Shandon 公司,英國),流式細(xì)胞儀(BD Calibur公司,美國),激光共聚焦顯微鏡(LSM500,德國),外科手術(shù)器械(中國科學(xué)院昆明動物研究所提供)。
正常健康新西蘭大耳白兔40只,雌雄不限,體質(zhì)量2.5~3.0 Kg,由中國科學(xué)院昆明動物研究所實驗動物中心提供。實驗過程中對動物的處置符合2006年科技部 《關(guān)于善待實驗動物的指導(dǎo)性意見》的規(guī)定。
1.2 方法
1.2.1 兔尺骨骨折模型的制備
參考前期兔開放型骨折模型制備方法[6-8],大耳白兔電子秤上秤重,10%水合氯醛3.5 mL/Kg腹腔注射麻醉,固定于手術(shù)臺。兔仰臥位,左上肢備皮。于左前肢中段掌外側(cè)作縱形切口,切開皮膚及皮下組織,暴露尺骨中段,環(huán)形切開相應(yīng)長骨膜,不銹鋼鋸條沿兩端點鋸斷尺骨,形成5 mm長的缺口,注意使兩斷端平面盡量保持平行且避免過度傾斜。青霉素沖洗,切口逐層縫合包扎,不行任何固定。術(shù)后每日肌注青霉素400 000 U/只,連續(xù)3 d。造模后立即在麻醉下拍攝患肢正位X線片,了解骨折類型及移位程度,要求骨折類型為橫斷型,無明顯移位。
1.2.2 BMSCs的分離、培養(yǎng)及鑒定
2%利多卡因2 mL局部浸潤麻醉大耳白兔,股骨髓腔內(nèi)抽取骨髓約3~4 mL,加入40 mL PBS稀釋,2 000 r/min離心3 min,棄上清,重復(fù)3遍。重懸細(xì)胞,加入3.5 mL紅細(xì)胞裂解液,冰板上持續(xù)搖晃30 min,破碎紅細(xì)胞,待紅細(xì)胞充分裂解后加入PBS至10 mL,3 000 r/min離心3 min,棄上清,再洗滌3遍。細(xì)胞用培養(yǎng)液重懸,移入含10%FBS的DMEM完全培養(yǎng)液的5 mL培養(yǎng)皿中,置于37℃、5%CO2培養(yǎng)箱中培養(yǎng)。24 h后換液,棄掉懸浮的單個核細(xì)胞及培養(yǎng)液,在倒置相差顯微鏡下觀察細(xì)胞形態(tài),每隔3~4 d換液,按1∶2傳代。應(yīng)用流式細(xì)胞儀對培養(yǎng)至第 3 代的細(xì)胞表面抗原 CD34、CD45、CD73(SH3)、CD105(SH2)進(jìn)行表型鑒定。
1.2.3 細(xì)胞的轉(zhuǎn)基因標(biāo)記
采用脂質(zhì)體介導(dǎo)轉(zhuǎn)染法,將含綠色熒光蛋白的慢病毒轉(zhuǎn)染兔骨髓間充質(zhì)干細(xì)胞,以ViraPowerTM Lentivirus Expression System制備慢病毒。將質(zhì)粒用LipofectamineTM2000轉(zhuǎn)導(dǎo)入?yún)R合度80%的293FT細(xì)胞中,轉(zhuǎn)導(dǎo)后12 h換新鮮培養(yǎng)基,換液后48~72 h收集培養(yǎng)基,用0.45 μm的濾膜過濾培養(yǎng)基,超速離心機25 000 r/min,4℃離心3 h,100倍濃縮病毒。在無抗生素條件下,將病毒添加到培養(yǎng)基中,和BMSCs共培養(yǎng)8 h后,換新鮮培養(yǎng)基。
1.2.4 BMSCs向前體骨細(xì)胞的定向誘導(dǎo)
用傳至第3代的BMSCs計數(shù)后接種于6孔板中。次日半量換液,改成含有地塞米松0.1 μmol/L、維生素 C 50 μmol/L、β-甘油磷酸鈉 10 μmol/L 及含10%FBS的H-DMEM的成骨誘導(dǎo)培養(yǎng)液。以后每2~3天換液,鏡下觀察細(xì)胞形態(tài)變化。
1.2.5 不同分化階段的細(xì)胞移植
胰酶消化各階段細(xì)胞,制備成1×106cells/mL的2 mL細(xì)胞懸液,按照3×106cells/Kg注射兔骨損傷模型,注射速度為1 mL/min;對照組注入等量HDMEM培養(yǎng)基,并觀察移植后組織綠色熒光表達(dá)。
1.2.6 移植后X線片觀察
分別于移植后第2、4、6周時,攝X線片,讀片采用盲法,評價兩項參數(shù)。根據(jù)骨折愈合過程中外骨痂和骨折線的變化規(guī)律,將外骨痂和骨折線進(jìn)行半定量檢測[9]。
外骨痂定量:0分,外骨膜無反應(yīng);1分,外骨膜出現(xiàn)反應(yīng);2分,外骨痂大小或密度較前明顯提高;3分,外骨痂連在一起形成皮質(zhì)骨橋;4分,外骨痂輕度吸收;5分,外骨痂明顯吸收;6分,外骨痂接近完全吸收,骨折處皮質(zhì)骨密度接近正常皮質(zhì)骨。
骨折線定量:0分,骨折線清晰無變化;2分,骨折線開始變?yōu)槟:?分,骨折線模糊未消失,但出現(xiàn)較牢固的連接跡象;6分,骨折線己消失,骨折線被高密度的骨痂取代;8分,骨髓腔處密度開始減低;10分,骨髓腔處密度減低明顯;12分,骨髓腔完全再通。
將評分相加即為骨折愈合的X線評分。
1.3 統(tǒng)計學(xué)處理
使用SPSS 11.5進(jìn)行統(tǒng)計學(xué)處理。全部數(shù)據(jù)采用均數(shù)±標(biāo)準(zhǔn)差表示,各實驗組的組間及組內(nèi)比較均采用單因素方差分析,P<0.05為差異有統(tǒng)計學(xué)意義,P<0.01為差異顯著。
2 結(jié)果
2.1 體外培養(yǎng)兔BMSCs的形態(tài)
光鏡觀察發(fā)現(xiàn),接種24 h可見部分細(xì)胞貼壁;培養(yǎng)36~48 h后,貼壁的單核細(xì)胞開始增多;5~7 d后,逐漸形成分散的細(xì)胞集落,集落之間彼此相連,細(xì)胞緊密排列,呈旋渦狀、網(wǎng)狀、放射狀向周圍擴(kuò)展,逐漸與鄰近集落相融合;12~14 d,細(xì)胞各個集落間相互融合達(dá)85%,細(xì)胞相互間緊密貼附,單個細(xì)胞呈狹長梭形,大多數(shù)細(xì)胞沿胞體長軸呈有序排列;經(jīng)3~4次傳代后,形成較典型的BMSCs(圖1)。
2.2 兔BMSCs表面抗原的流式細(xì)胞分析
結(jié)果顯示,體外培養(yǎng)的BMSCs不表達(dá)血細(xì)胞表面標(biāo)記,如CD34、CD45;表達(dá)間充質(zhì)干細(xì)胞表面標(biāo)記 CD73、CD105(圖 2)。
2.3 兔BMSCs的GFP標(biāo)記
激光共聚焦顯微鏡觀察顯示,慢病毒轉(zhuǎn)染后培育48 h,GFP標(biāo)記的BMSCs顯示綠色熒光(圖3)。
2.4 BMSCs誘導(dǎo)為成骨細(xì)胞的細(xì)胞形態(tài)變化
BMSCs誘導(dǎo)3 d后,細(xì)胞增殖旺盛,呈漩渦狀生長,融合成單層,細(xì)胞形態(tài)仍保持長梭形。誘導(dǎo)7 d時,細(xì)胞增殖速度減慢,開始出現(xiàn)細(xì)胞聚集的現(xiàn)象,細(xì)胞逐漸匯合呈鋪路石狀,細(xì)胞形態(tài)發(fā)生改變,由梭形變?yōu)榘w較小的立方形,高倍鏡下可見細(xì)胞呈復(fù)層生長。誘導(dǎo)8~10 d時,細(xì)胞呈多角形成骨樣細(xì)胞,胞質(zhì)顏色變深,含粗大顆粒,胞核明顯,胞外基質(zhì)分泌逐漸增多,膠原堆積,鈣鹽沉積。誘導(dǎo)14 d時,形成不透光、散在褐色點狀礦化結(jié)節(jié)中心。誘導(dǎo)21 d時,礦化結(jié)節(jié)連接成小片狀(圖4)。誘導(dǎo)28 d時,細(xì)胞開始從培養(yǎng)皿壁脫落,見大量懸浮死細(xì)胞。
2.5 受體組織熒光表達(dá)檢測
移植后熒光顯微鏡觀察顯示骨組織內(nèi)有移植細(xì)胞存在,可見散發(fā)綠色熒光(圖5)。
2.6 不同階段細(xì)胞移植后的療效評價
未誘導(dǎo)組同誘導(dǎo)7 d和21 d組造模后第6周時骨髓腔仍未通。3 d組在細(xì)胞移植后第2周時外骨痂量較多,骨折間隙處密度開始增高,部分骨折線呈現(xiàn)較牢固連接跡象;第4周時外骨痂開始吸收,骨折線消失,被高密度的骨痂取代;第6周時外骨痂接近完全吸收,骨折處皮質(zhì)骨密度接近正常皮質(zhì)骨,骨髓腔完全再通。誘導(dǎo)7 d組和21 d組細(xì)胞移植后第2周時骨折線模糊,出現(xiàn)少量外骨痂,骨折線尚未出現(xiàn)牢固連接跡象;第4周時大量的外骨痂,骨折線出現(xiàn)牢固連接跡象,但外骨痂無吸收;至造模后第6周骨折線消失,外骨痂開始吸收,骨髓腔仍未通。對照組中有出現(xiàn)斷端硬化不愈合現(xiàn)象。
BMSCs未誘導(dǎo)組、誘導(dǎo)7 d和21 d組無明顯差異(P>0.05),且均顯著高于對照組(P<0.01),3 d 組評分高于7 d和21 d組(P<0.05),且顯著高于對照組(P<0.01)(表1)。

圖1 第三代 BMSCs(100×)Fig.1 BMSCs of passage 3(100×)
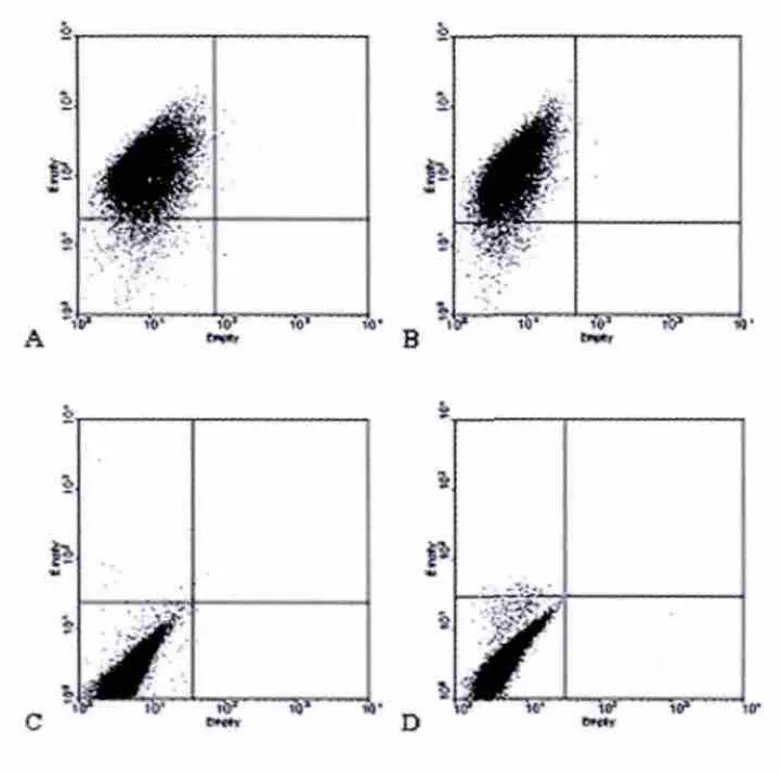
圖2 流式細(xì)胞儀檢測BMSCs表面抗原Fig.2 Surface antigen of BMSCs detected by FCM

圖3 GFP標(biāo)記的BMSCs(100×)Fig.3 GFP labeled BMSCs(100×)

圖4 BMSCs誘導(dǎo)21 d(100×)Fig.4 BMSCs after induced for 21 days(100×)
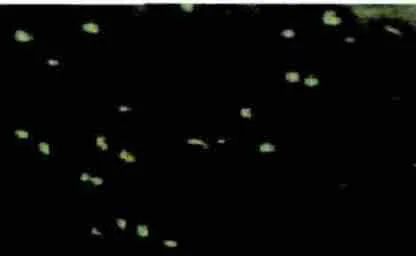
圖5 移植后骨組織切片免疫熒光檢測(20×)Fig.5 Immunofluorescence detection of bone tissue after transplantation(20×)
3 討論
骨折愈合是一個緩慢而復(fù)雜的過程,存在許多影響愈合的因素。骨折的傳統(tǒng)治療方法存在一定局限性,如治療周期長、操作復(fù)雜、醫(yī)藥費用高、不良反應(yīng)多等。近年來,隨著BMSCs研究的不斷深入,BMSCs的移植治療已有望應(yīng)用于臨床。
研究顯示,多種因素的綜合影響誘導(dǎo)了相關(guān)發(fā)育基因在序列上的改變,促使干細(xì)胞向不同組織細(xì)胞分化[10-13],并且有的研究認(rèn)為誘導(dǎo)的細(xì)胞更優(yōu)于干細(xì)胞本身[14-15]。在誘導(dǎo)劑的作用下,BMSCs來源的前體細(xì)胞或前體干細(xì)胞的功能在整個被誘導(dǎo)過程中并不是一成不變的。因此,把不同功能狀態(tài)的細(xì)胞進(jìn)行體內(nèi)移植后可能會產(chǎn)生不同的效果。本實驗將誘導(dǎo)分化不同階段的BMSCs移植入骨損傷動物模型,比較不同階段的“前體干細(xì)胞”應(yīng)用于骨損傷修復(fù)時產(chǎn)生的效果差異,從而最大程度發(fā)揮BMSCs在組織損傷修復(fù)中的作用。
X線片顯示的骨折線模糊程度,基本反應(yīng)了骨痂變化,外骨痂評分說明骨外膜形成和塑形情況。X線評分近似地反映骨折愈合過程的各個階段變化,從而有利于比較各組骨折愈合程度。通過移植細(xì)胞后2、4、6周的X線觀察及分析,未誘導(dǎo)組和誘導(dǎo)7 d和21 d組比較無明顯差異,3 d組治愈程度明顯優(yōu)于對照組,且優(yōu)于未誘導(dǎo)組和7、21 d組。從而證明了成骨誘導(dǎo)3 d較BMSCs和成體細(xì)胞更能加速骨痂形成與鈣化,加快骨塑形,提高骨折愈合速度。證明了BMSCs和BMSCs誘導(dǎo)分化的前體骨細(xì)胞在骨損傷治療上都發(fā)揮了作用,但BMSCs成骨誘導(dǎo)3 d組療效更為顯著,很有可能是最適宜移植的。
[1] Ishikawa T,Banas A,Hagiwara K,et al.Stem cells for hepatic regeneration:the role of adipose tissue derived mesenchymal stem cells[J].Curr Stem Cell Res Ther,2010,5(2):182-189.
[2] Crop MJ,Baan CC,Korevaar SS,et al.Donor-derived mesenchymal stem cells suppress alloreactivity of kidney transplant patients[J].Transplantation,2009,87(6):896-906.
[3] Song H,Song BW,Cha MJ,et al.Modification of mesenchymal stem cells for cardiac regeneration[J].Expert Opin Biol Ther,2010,10(3):309-319.
[4] Richter W.Mesenchymal stem cells and cartilage in situ regeneration[J].J Intern Med,2009,266(4):390-405.
[5] Drost AC,Weng S,Feil G,et al.In vitro myogenic differentiation of human bone marrow-derived mesenchymal stem cells as a potential treatment for urethral sphincter muscle repair[J].Ann N Y Acad Sci,2009,1176:135-143.
[6] 張立強,張林松.內(nèi)皮細(xì)胞生長因子及堿性成纖維細(xì)胞生長因子對兔橈骨骨折愈合影響的比[J].中國組織工程研究與臨床康復(fù),2008,12(33):6453-6456.
[7] 佘昶,董啟榕,周曉中.大鼠股骨開放截骨模型與閉合骨折模型制作的比較[J].中國組織工程研究與臨床康復(fù),2008,12(46):9071-9075.
[8] 王玉學(xué),李鄭民,畢鄭鋼.建立兔橈骨缺損動物模型的實驗研究[J].中國地方病防治雜志,2008,23(1):60-61.
[9] 盧敏,謝進(jìn),戴致波.小針刀對兔骨折愈合影響的實驗研究[J].湖南中醫(yī)藥大學(xué)學(xué)報,2007,27(4):70-72.
[10] Bae SH,Choi JY,Yoon SK,et al.Thy1-positive bone marrow stem cells express liver-specific genes in vitro and can mature into hepatocytes in vivo[J].Hepatol Int,2008,8(2):63-71.
[11] Cho HH,Park HT,Kim YJ,et al.Induction of osteogenic differentiation of human mesenchymal stem cells by histone deacetylase inhibitors[J].J Cell Biochem,2005,96(5):533-542.
[12] Antonitsisa P,Ioannidou-Papagiannakib E,Kaidoglou A,et al.In vitro cardiomyogenic differentiation of adult human bone marrow mesenchymal stem cells:The role of 5-azacytidine[J].Interact Cardiovas Thorac Surg,2007,6(5):593-597.
[13] Ye Y,Zeng YM,Wan MR,et al.Induction of human bone marrow mesenchymal stem cells differentiation into neural-like cells using cerebrospinal fluid[J].Cell Biochem Biophys,2011,6(7):1419-1425.
[14] Zhu Y,Liu T,Song K,et al.Adipose-derived stem cell:a better stem cell than BMSC[J].Cell Biochem Funct,2008,26(6):664-675.
[15] Connelly JT,García AJ,Levenston ME.Interactions between integrin ligand density and cytoskeletal integrity regulate BMSC hondrogenesis[J].Cell Physiol,2008,217(1):145-154.

