人β防御素-3在人工關節感染患者中的表達及其意義的實驗研究
倪衛東,羅 羲,費 軍,黃顯凱,杜順華
人工關節術后感染被稱為人工關節置換術的災難性并發癥,其中由血漿凝固酶陰性的葡萄球菌等毒力較低的細菌所致的慢性感染,常難以明確診斷并與無菌性松動鑒別[1],目前尚無統一診斷標準。筆者采用觀察人β防御素-3(human beta-defensin-3,HBD-3)在人工關節感染、假體無菌性松動、占位器治療后的假體周圍的松質骨及正常髂骨中的表達情況,初步探討其與人工關節感染的關系,為進一步探索其能否作為人工關節感染診斷及與假體無菌性松動鑒別的一種方法奠定基礎。
材料與方法
1 一般資料
自2009年11月~2010年4月及2012年7月~2012年9月,收集住院治療患者術中切取的人工關節感染患者假體周圍組織13例(男性8例,女性5例);假體無菌性松動的假體周圍組織8例(男性5例,女性3例);明確診斷為人工關節感染經清創,放置萬古霉素骨水泥占位器和抗生素等綜合治療,感染得到有效控制后行關節翻修術者的占位器周圍組織9例(男性4例,女性5例);四肢骨折患者行取髂骨植骨的正常髂骨7例(男性3例,女性4例)。按臨床診斷分別分為人工關節感染組、假體無菌性松動組、占位器治療后組及正常組。收集所有患者的術前外周血白細胞計數、ESR、CRP結果。
人工關節感染組均為術后2個月及以上始出現患肢關節持續性疼痛患者。其納入標準采用骨肌系統感染學會(musculoskeletal infection society,MSIS)2012年發布的假體周圍感染的診斷方法,如下:(1)存在與假體相通的竇道;(2)假體周圍組織兩處或多處取材或關節滑液細菌培養結果為同一病原菌;(3)以下6種情況滿足4種及以上者:① a.血沉及血清C-反應蛋白增高者;② 關節滑液白細胞計數增高者;③ 關節滑液中性粒細胞百分比增高者;④ 關節內發現膿液者;⑤ 假體周圍組織或關節滑液一次細菌培養發現細菌者;⑥ 假體周圍組織高倍鏡(400倍)下>5個中性粒細胞,至少5個獨立視野。本組13例中3例為金黃色葡萄球菌,5例為血漿凝固酶陰性的葡萄球菌,1例表皮葡萄球菌,1例銅綠假單胞菌,3例未培養出細菌。
2 切片制備和HE染色光鏡觀察
所有標本以4%多聚甲醛固定,固定后置入0.5M PH8.0的EDTA緩沖液中脫鈣,每7天更換1次相同濃度EDTA緩沖液,直至細針插入組織無阻力時為脫鈣終點。常規脫水透明及石蠟包埋,連續5μm切片。常規HE染色,光鏡下觀察各組組織切片的形態及炎性細胞浸潤情況。
3 切片免疫熒光染色和觀察
3.1 主要試劑:抗HBD-3為鼠抗人多克隆抗體(NOVUS公司)。兔抗小鼠熒光抗體(ZYMED公司)。
3.2 染色、觀察和平均光密度值測量:切片經脫蠟復水,枸櫞酸鹽抗原熱修復,3%過氧化氫封閉內源性過氧化物酶,1%BSA封閉以減少非特異性染色,4℃孵育一抗過夜。復溫后孵育TRITC染料標記的熒光二抗及DAPI染色,封片鏡檢,以PBS代替一抗作陰性對照。倒置相差熒光顯微鏡下觀察陽性細胞數目及強度,任選5個獨立視野成像,并采用Imagepro plus(IPP)7.0C圖像分析軟件,測量每個視野下陽性細胞的平均光密度值。
3.3 統計方法:采用SPSS 17.0統計學軟件進行統計學分析,統計發現不滿足t檢驗的要求(正態且方差齊),故采用兩獨立樣本的秩和檢驗進行兩組間比較,P<0.05為差異具有統計學意義。
結 果
1 各組HE染色結果
各組大體組織肉眼觀察無區別,各組HE染色結果于顯微鏡下(×200)觀察,見各組切片組織主要為骨小梁及骨髓構成,形態無明顯差別,各組均無炎性細胞浸潤(圖1)。
圖1 各組骨組織HE染色情況( ×200)
2 各組免疫熒光染色結果
免疫熒光染色于OLYMPUS-IX71倒置相差熒光顯微鏡下觀察HBD-3表達情況。如圖2所示,人工關節感染組、假體無菌性松動組及占位器治療后組均可見骨細胞的胞漿中存在HBD-3表達(綠色箭頭所示),且無明顯差異。人工關節感染組、假體無菌性松動組、占位器治療后組及正常組的骨小梁的骨內膜上均可見不同程度的HBD-3(白色箭頭所示),以感染組最多及陽性程度最高,依次為假體無菌性松動組、占位器治療后組、正常組。藍色顆粒則為被DAPI所染色的細胞核(黃色箭頭所示)。
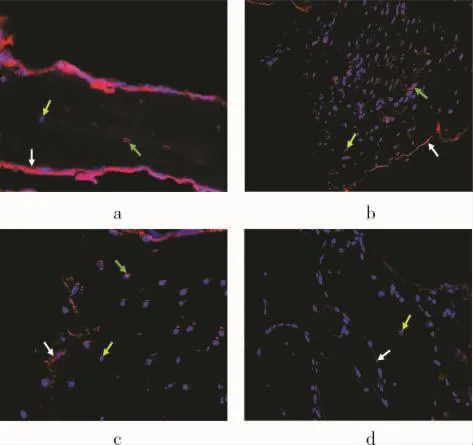
圖2 各組松質骨免疫熒光染色情況( ×200)
3 各組平均光密度值結果
表1 各組的平均光密度值±s)

表1 各組的平均光密度值±s)
images/BZ_221_233_1474_1192_1532.png 人工關節感染組13 0.473±0.017無菌性松動組 8 0.345±0.006a占位器治療后組 9 0.242±0.005bd正常組 7 0.138±0.003cde
人工關節感染組與假體無菌性松動組比較:aP<0.01;人工關節感染組與占位器治療后組比較:bP<0.01;人工關節感染組與正常組比較:cP<0.01;無菌性松動與占位器治療后組比較:dP<0.01;無菌性松動組與正常組比較:dP<0.01;占位器治療后組與正常組比較:eP<0.01
4 外周血白細胞計數、ESR、CRP結果
其中外周血白細胞計數正常參考范圍為(4~10×109);ESR正常參考范圍為(男 <15mm/h,女<20mm/h)CRP正常參考范圍為(0~0.8)。各項指標結果以各組結果以±s)的形式表示,結果如下見表2。
表2 各組白細胞計數、ESR、CRP結果(±s)
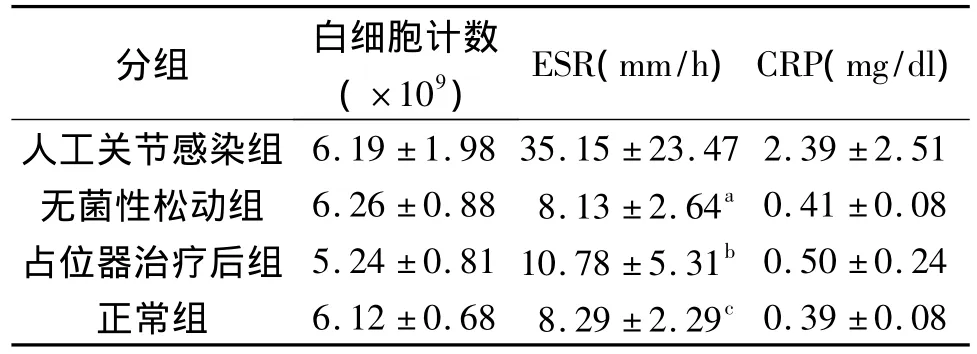
表2 各組白細胞計數、ESR、CRP結果(±s)
分組 白細胞計數(×109) ESR(mm/h)CRP(mg/dl)人工關節感染組0.39±0.08 6.19±1.98 35.15±23.47 2.39±2.51無菌性松動組 6.26±0.88 8.13±2.64a0.41±0.08占位器治療后組 5.24±0.81 10.78±5.31b0.50±0.24正常組 6.12±0.68 8.29±2.29c
外周血白細胞計數各組兩兩比較:P>0.05。ESR及CRP人工關節感染組與假體無菌性松動組比較:aP<0.01;人工關節感染組與占位器治療后組比較:bP<0.01;人工關節感染組與正常組比較:cP<0.01;無菌性松動與占位器治療后組比較,無菌性松動組與正常組比較及占位器治療后組與正常組比較:P>0.05
討 論
人工關節感染為內置物相關感染,按病程區分可分為急性感染、亞急性感染和慢性感染。其中急性感染臨床表現較為明顯,診斷多無困難。然而慢性感染則多為如血漿凝固酶陰性的葡萄球菌等毒力較低的致病菌所致的人工關節假體周圍感染,時常難以與假體無菌性松動進行有效鑒別,目前尚缺乏統一標準。其診斷方法為結合患者病史、癥狀及體征、影像學檢查及各種輔助檢查結果依靠術者經驗作出綜合判斷。然而慢性人工關節感染患者常無特異性臨床表現及體征,各種檢查方法各有其局限性,術者的經驗并不完全相同,因此現臨床應用的診斷方法并不完全可靠。
外周血白細胞計數是臨床常用的感染診斷指標,在局部感染和其他非感染性疾病時均可出現不同程度的增高,對慢性人工關節感染的診斷價值有限[2]。Di Cesare 等[3]報告患者術前外周血白細胞計數在人工關節感染與非感染間的差別沒有統計學意義,本研究中各組兩兩比較均無統計學意義,因此我們認為外周血白細胞計數在慢性人工關節感染的診斷及其與假體無菌性松動的鑒別中價值不大。但同時仍應認識到,當外周血白細胞計數升高超出正常參考范圍時,依然可以提示存在感染可能,盡管影響其升高的因素較多。
ESR及CRP是診斷感染性疾病的常用指標,但在用于單純診斷人工關節感染時,尚需排除患者同時存在其他部位感染、合并結締組織疾病或類風濕性關節炎等可導致ESR及CRP升高的情況。Della Valle等[2]的研究報道ESR對人工關節感染診斷的準確率為77%,CRP的準確率為84%。多數學者認為在排除干擾因素后,ESR及CRP在診斷人工關節感染時仍具有較高的診斷效力[2-3]。本研究中ESR和CRP在感染組與假體無菌性松動組間的差別及感染組與正常組間的差別具有統計學意義,表明ESR和CRP在人工關節感染的診斷及其與假體無菌性松動的鑒別中均具有參考價值。盡管如此,但其值正常時仍不能除外人工關節感染。
抗菌肽(antimicrobial peptides,AMPs)是一類具有廣譜抗菌性的活性小分子肽類,是多種生物機體的一線防御物質[4-5],具有高效、廣譜及不易產生耐藥性等優點。人防御素為抗菌肽中的一個家族,其中人 β防御素現主要發現有 3種[6],HBD-3比HBD-1、HBD-2具有更強的抗菌活性[7],人β防御素(HBD-3除外)的抗菌活性在生理鹽濃度下或二價陽離子存在時可受到強烈抑制[8-9],且HBD-3的表達增高與感染、腫瘤等疾病的發生具有相關性[10-11]。而 Warnke等[12]的研究表明,HBD-3 是骨組織固有免疫的一部分,在感染下顎骨中,骨小梁旁的骨內膜上及骨細胞的胞漿中均存在表達。而正常下顎骨的骨內膜上表達相對前者較弱,且骨細胞胞漿中無HBD-3表達,Stockmann等[13]對顎骨壞死的研究報告了相同的結果。但HBD-3在人工關節感染和假體無菌性松動的松質骨中的表達是否具有差異,以及其差異能否幫助判斷感染或感染與松動的區分,目前國內外尚無相關研究。
人工關節感染的治療單獨使用抗生素是很難成功治愈的,且藥物必須滿足對細菌敏感,能抑制細菌生物膜的形成以及能殺滅生物膜內的細菌[14],因此常需手術治療。人工關節感染的治療多采用Ⅱ期翻修,即取出原有假體,盡可能清除炎性組織后配合使用抗生素及放置萬古霉素骨水泥占位器等綜合治療,待感染得到有效控制后再進行翻修術的手術方式,優點在于感染清除率高,再感染率較低[15]。人工關節感染、占位器治療后、感染治愈,是人工關節感染Ⅱ期翻修治療的3個階段,現尚無HBD-3在占位器治療后的骨組織中的相關報道。
本研究分為4組,分別為人工關節感染組、假體無菌性松動組、占位器治療后組、正常組。慢性人工關節感染通常為深部感染,存在感染或炎癥反應的范圍較廣。在放置萬古霉素占位器等綜合治療后,即便感染的癥狀得到有效控制,ESR和CRP指標正常時,深部組織內仍存在炎癥反應。假體無菌性松動所產生的炎癥反應,與磨損的聚乙烯顆粒等異物刺激有關[16-17],其炎癥反應為慢性無菌性炎癥反應。在各組平均光密度值的結果中,感染組高于其余各組,無菌性松動組高于正常組,占位器治療后組高于正常組。推測感染或炎癥反應可誘導HBD-3在局部的表達增加,且與其程度具有一定相關性,在感染局部的表達可能是一種能較好反應局部炎癥程度的指標。就取材部位而言,本研究所取組織為感染局部組織,反應的是感染局部的炎癥反應的情況,僅需要除外可引起局部炎癥反應的一些疾病和情況。而臨床常用的外周血白細胞計數、ESR、CRP為取外周靜脈血所得出的結果,反應的是機體對感染等疾病作出的全身性反應的情況,可受到諸如患者其他部位存在感染或結締組織病等多種方面的影響,尚需排除可引起其增高的全身性和(或)局部性疾病等因素,所需除外的因素較多而復雜。
綜上分析我們認為,在人工關節感染的假體周圍的松質骨內,HBD-3的表達都可能能較好的反應局部感染的情況,對于人工關節感染的診斷及其與假體無菌性松動的鑒別是一種較好的參考指標或方法。對Ⅱ期翻修綜合治療后,感染是否已控制的判斷上也具有一定參考價值。
[1] Zimmerli W,Ochsner PE.Management of infection associated with prosthetic joints[J].Infection,2003,31(2):99-108.
[2] Della Valle CJ,Sporer SM,Jacobs JJ,et al.Preoperative testing for sepsis before revision total knee arthroplasty[J].J Arthroplasty,2007,22(6S2):90-93.
[3] Di Cesare PE,Chang E,Preston CF,et al.Serum interleukin-6 as a marker of periprosthetic infection following total hip and knee arthroplasty[J].J Bone Joint Surg(Am),2005,87(9):1921-1927.
[4]Beisswenger C,Bals R.Functions of antimicrobial peptides in host defense and immunity[J].Curr Protein Pept Sci,2005,6(3):255-264.
[5] Dubin A,Mak P,Dubin G,et al.New generation of peptide antibiotics[J].Acta Biochim Pol,2005,502(3):633-638.
[6] Selsted ME,Tang YQ,Morris WL,el al.Purification,primary structures,and antibacterial activities of beta-defensins,a new family of antimicrobial peptides from bovine neutrophils[J].J Biol Chem,1993,268(9):6641-6648.
[7] Paulsen F,Pufe T,Conradi L,et al.Antimicrobial peptides are expressed and produced in healthy and inflamed human synovial membranes[J].J Pathol,2002,198(3):369-377.
[8] Harder J,Bartels J,Christophers E,et al.Isolation and characterization of human beta-defensin-3.a novel human inducible peptide an tibiotic[J].J Biol Chem,2001,276(8):5707-5713.
[9] Garcia JR,Jaumann F,Sehulz S,et al.Identification of a novel,multifunctional beta-defensin(human beta-defensin3)with specific antimicrobial activity:its interaction with plasma membranes of Xenopus oeytes and the induction of maerophage chemoattraction[J].Cell Tissue Res,2001,306(2):257-264.
[10] Dressel S,Harder J,Cordes J,et al.Differential expression of antimicrobial peptides in margins of chronic wounds[J].Exp Dermatol,2010,19(7):628-632.
[11] Shuyi Y,Feng W,Jing T.Human beta-defensin-3(hBD-3)upregulated by LPS via epidermal growth factor receptor(EGFR)signaling pathways to enhance lymphatic invasion of oral squamous cell carcinoma[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2011,112(5):616-625.
[12] Warnke PH,Springer IN,Russo PA,et al.Innate immunity in human bone[J].Bone,2006,38(3):400-408.
[13] Stockmann P,Wehrhan F,Schwarz-Furlan S,et al.Increased human defensine levels hint at an inflammatory etiology of bisphosphonate-associated osteonecrosis of the jaw:an immunohistological study[J].J Transl Med,2011,15(9):135-141.
[14] Zimmerli W,Trampuz A,Ochsner PE.Prosthetic-Joint infections[J].N Engl J Med,2004,351(16):1645-1654.
[15] Haddad FS,Muirhead-Allwood SK,Manktelow AR,et a1.Two-stage uncemented revision hip arthroplasty for infection[J].J Bone Joint Surg(Br),2000,82(5):689-694.
[16]Harris WH.Wear and periproshetic osteolysis:the problem[J].Clin Orthop Relat Res,2001,12(393):66-70.
[17] Matthews JB,Besong AA,Green TR,et al.Evaluation of the response of pirmary human peirpheral blood mononuclear phagocytes to challenge with in vitro generated clinically relevant UHMWPE patricles of known size and dose[J].J Biomed Mater Res,2000,52(2):296-307.

