酸性高錳酸鹽指數測定誤差的探討
韓君君
(江蘇省濱海縣環境檢測站 江蘇 鹽城 224500)
試劑的配置
為了配置較穩定的高錳酸鉀標準溶液,需要采取二方面的措施進行控制。
(1)配置高錳酸鉀標準貯備液,所稱取的高錳酸鉀質量要稍微高于理論值,筆者據實踐經驗得出:配置貯備液的時候稱取1.580g—1.583g的高錳酸鉀溶于800ml蒸餾水中。因為:在高錳酸鉀溶液的煮沸過程中蒸餾水中所含有的微量還原性物質會消耗少量的高錳酸鉀,從而降低高錳酸鉀貯備液的濃度。
(2)將高錳酸鉀溶液加熱至沸騰,應當保持微沸狀態2min—5min,使溶液中的還原性物質充分的氧化。
1 反應體系酸度情況
酸度對氧化還原反應的影響主要有2種情況:一是H++直接參加氧化還原反應造成的影響,另一種是H++與氧化劑或者還原劑結合成難離解的化合物所產生的影響。從酸性法測定高錳酸鹽指數的原理來看,酸度的影響主要是H++直接參加氧化還原反應所造成。
反應體系的酸度既不能過高也不能過低,為保證該反應能夠有效的進行,酸性高錳酸鹽滴定法要求水樣的酸度在0.5-1.0mol/l,加入5.00ml(1+1)硫酸溶液后,水樣中的酸度應當控制在0.75mol/l。配制的(1+3)硫酸的質量濃度應在4.6mol/l。
2 水浴中的加熱時間
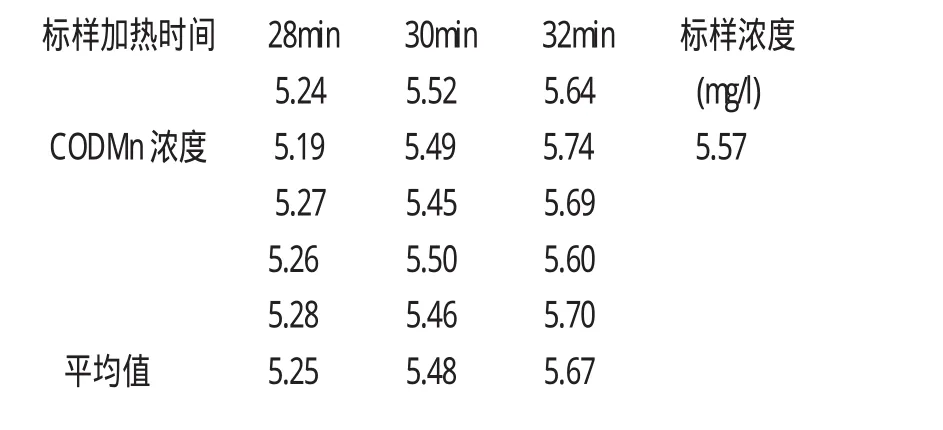
表1 加熱時間與CODMn測定值的關系
表1可以看出,加熱時間對高錳酸鹽指數的測定值影響很大,加熱時間增加,測定值偏大,反之則減小。所以對樣品經行加熱時,一是要在水浴鍋始終處于100℃沸騰狀態下才能放入樣品開始計時,嚴格控制加熱時間為30min;二是水浴中的水位始終要高于錐形瓶內水樣的水位,以保證反應的完全。
3、滴定溫度
在滴定過程中,高錳酸鉀與草酸鈉所進行的是氧化還原反應,是吸熱反應。在酸性環境中滴定溫度控制在70℃-85℃,這樣才能使反應有效進行下去。若水樣溫度過低會使反應速度變慢,滴定終點往往會出現延后,導致測定結果偏高;但是當水樣溫度大于90℃時,容易出現草酸鈉部分分解,使高錳酸鉀的消耗量降低,導致測定值偏低。
4 滴定速度
在對樣品進行滴定時,剛開始的速度不宜太快,要逐滴加入,否則KMnO4溶液會分解為MnO。當滴定至生成一定量的Mn2+時反應速度加快,因為其對反應產生了自身催化作用,體系反應的速度加快。隨著反應的進行,反應物濃度減少反應速度變慢。所以滴定速度應遵循“慢—快—慢”的原則,使滴定速度與反應速度同步。
結論
(1)高錳酸鉀標準溶液濃度的校正系數K合適的范圍是0.980—1.010之間。
(2)必須保證水浴鍋內處于沸騰狀態時放入水樣,計時時間從放置水浴鍋內算起,嚴格控制反應時間為30min。
(3)滴定溫度應控制在70℃—85℃,滴定速度遵循“慢—快—慢”的原則。
[1]國家環保總局.水和廢水監測分析方法【M】.第四版(增補本).北京.中國環境出版社2002
[2]卡林,朱伊君,王芹,測試條件對高錳酸鹽指數測定結果的影響,【J】黑龍江環境通報 2001,7
[3]劉振華,減小高錳酸鹽指數測定誤差的分析研究,【J】工業水處理2010.8
[4]蔣晶晶,印軍榮,準確測定高錳酸鹽指數的條件因素探討【J】環境污染與防治2009.6

