廢鉛酸蓄電池鉛膏脫硫工藝的研究進展
汪振忠,柯昌美,王 茜
(武漢科技大學化學工程與技術學院,湖北武漢 430081)
硫酸鉛是廢鉛酸蓄電池鉛膏的主要組成部分,其質量分數一般在50%以上。由于硫酸鉛的熔點高,完全分解溫度在1000℃以上,因此在傳統的火法冶金回收鉛過程中,需要消耗大量的煤炭作為熱源和還原劑,這也是SO2及鉛塵形成的主要原因。濕法冶煉或干濕聯合法一般都需要先進行脫硫處理,而后電解沉積或是火法冶煉,從環境保護的角度看,這類方法比單純的火法冶煉要好得多。找到合適的脫硫工藝是消除Pb粉塵和SO2污染的根本方法,同時也是提高資源利用率的有效方法。
1 廢鉛酸蓄電池鉛膏中硫含量的測定
1.1 ICP-AES 法測定硫含量[1-2]
ICP的形成就是工作氣體的電離過程。測定硫含量的基本原理是:利用S元素的原子或離子激發后躍遷回低能級(或基態)時發射的電磁輻射(線光譜)的波長及其強度對鉛膏中的S進行定量分析。每個元素一般都有幾條分析譜線,劉守廷等[1]的研究表明,應選擇波長為182.0 nm分析譜線的結果作為S含量的測定結果,一是因為這條譜線的硫較強,其二是因為鉛膏中的一些基本元素對此波長的分析譜線幾乎沒有什么干擾。將此法與硫酸鋇重量法的測定結果進行比較,發現吻合得很好。
1.2 高頻紅外吸收法測定硫含量[3]
測定原理:樣品在高頻爐內在氧氣流中燃燒,樣品中的硫全部轉化為二氧化硫氣體,釋放的二氧化硫氣體被控制成恒定的速率導向一個無分散的紅外檢測器,該紅外檢測器的輻射頻率已預先調到二氧化硫的特征吸收波長上,吸收能量的大小與其濃度成正比。根據紅外檢測器檢測到的吸收能量值,經過積分校正計算樣品中硫的含量。因為硫酸鉛的分解溫度很高,所以對高頻爐的要求也比較高。
1.3 Vario-EL元素分析儀測定硫含量[4]
測硫元素含量的原理是:經電子天平稱量的鉛膏,經過自動進樣器注入到石英燃燒管內,在高溫下充分燃燒分解,樣品中各元素分別轉化為氧化物的形式,這些混合氣體在載氣(氦氣)的推動作用下進入吸附柱中,通過吸附和解吸附作用將二氧化硫和燃燒產生的其他氣體組分分離。分離后的二氧化硫隨載氣一起進入熱導池檢測器中進行檢測,然后,再傳入與元素分析儀相連的計算機上,根據內存中標準樣品的校正曲線自動轉化為待測樣品中硫元素的質量分數。此方法對天平的精度要求比較高。
2 廢鉛酸蓄電池鉛膏脫硫工藝的研究
2.1 以碳酸鹽為脫硫劑的脫硫工藝
2.1.1 碳酸鹽轉化脫硫原理[5]
根據鉛化合物的電位-pH圖可以知道,碳酸鉛在pH為6~10時是穩定的,并且PbCO3溶度積(7.4×10-14)比 PbSO4溶度積(1.6×10-8)小 6 個數量級,因此脫硫劑碳酸鹽與鉛膏液在一定的條件下能發生碳酸化化學轉化反應,使PbSO4轉化為更難溶的PbCO3。其基本轉化原理:

根據熱力學計算公式也可以知道,此反應式的自由焓ΔG?=-28.98 kJ,其化學反應的熱力學推動力很大,反應容易發生。研究表明[6],當pH升高時,會有堿式碳酸鹽[2PbCO3·Pb(OH)2]生成,甚至形成鉛酸鹽而溶解,因此,采用碳酸鹽轉化鉛膏中的PbSO4時,須控制pH在6~10范圍內,以獲得穩定的PbCO3固相。
2.1.2 碳酸鹽轉化脫硫的研究
鉛膏的脫硫轉化是為了將鉛膏中的PbSO4轉化為較易還原處理的其他化合物形態,常用的碳酸化脫硫轉化劑有 Na2CO3、NH4HCO3、(NH4)2CO3等。目前,關于鉛氧化物及硫酸鹽的浸出研究比較多,主要區別體現在所選用的浸出劑不同。顧怡卿等[7]分別以碳酸鈉、碳酸氫銨作脫硫劑對鉛膏脫硫進行了研究,結果表明,相同條件下,Na2CO3的脫硫效果比NH4HCO3的效果要好,因為NH4HCO3的穩定性相對較差,原料易損失,轉化率較低,而Na2CO3作脫硫劑時存在的問題是其副產物Na2SO4經濟價值不高。針對此類問題,俞小花等[8]嘗試用碳酸氫銨和氨水作脫硫劑,研究表明,轉化后的副產物為硫酸銨,其可以作為化肥銷售,有一定的市場;同時對轉化過程的動力學過程進行了分析,認為此種脫硫劑反應過程完成得比較快,但進行得不夠徹底,其原因是在此過程中生成的碳酸鉛固體會包裹硫酸鉛原料,阻礙了反應的進行。
2.2 檸檬酸法脫硫
M.S.Sonmez 等[9]發現,若將檸檬酸三鈉、檸檬酸與硫酸鉛按一定比例在合適的溫度下反應一段時間,能有效回收硫酸鉛,得到類似檸檬酸鉛的白色晶體,同步完成脫硫轉化并得到副產物硫酸鈉。根據SEM和TG-DSC等分析結果,推測出其反應式為:
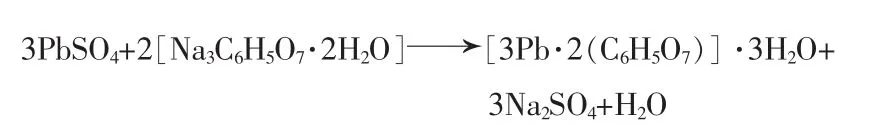
朱新鋒等[10]用分析純的硫酸鉛為原料,與檸檬酸/檸檬酸鈉混合溶液反應,也得到了鱗片狀結構的類似檸檬酸鉛的白色晶體,對此產物進行焙燒,分析發現焙燒后的產物主要為PbO。采用此種方法可直接制備電池極板的活性物質超細PbO粉體,這為廢舊鉛蓄電池的回收提供了新思路。Yang Jiakuan等[11]在檸檬酸體系中加入乙二醇,以硫酸鉛為起始原料,合成出納米級活性材料氧化鉛,通過熱重分析可以看到,加了乙二醇的檸檬酸鉛更具耐熱性,這可能與乙二醇自身合并使得聚合物鏈更加穩定有關。
2.3 以尿素與醋酸為脫硫劑轉化脫硫
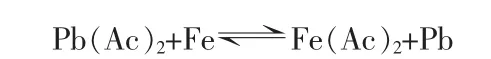
由于硫酸鉛能溶于乙酸銨,根據這一特性,M.Volpe等[12]將尿素與醋酸混合,得到含有乙酸銨的混合溶液,將鉛膏加入到此溶液中,可以得到難溶的醋酸鉛,同步完成脫硫轉化,生成硫酸銨。純的乙酸銨在水溶液中呈中性,而此反應后續處理需要用到鐵作置換劑,所以pH需維持在一個較低的值,以防生成氫氧化鐵影響后續處理,但反應的pH又不能低于3,因為在脫硫反應過程中需要維持自由醋酸根離子在一個較高的濃度,因此以尿素及醋酸為脫硫劑時,pH的調整尤為重要。其脫硫反應式如下:

鐵置換反應式:
2.4 以NaOH為脫硫劑轉化脫硫
硫酸鉛能溶于NaOH等強堿溶液,陳維平[13]研究了以NaOH為脫硫劑回收鉛膏。脫硫過程如下:
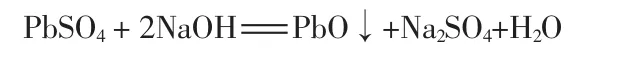
當NaOH過量且濃度較高時,部分按下式反應進行:
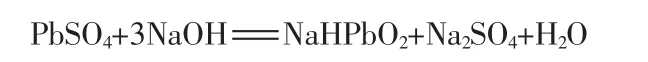
用NaOH溶液浸取鉛膏,硫酸鉛脫硫轉化成PbO[或 Pb(OH)2]固體。 過濾后,濾餅中含有 PbO,PbO2,Pb等;濾液中含有 Na2SO4、少量 NaOH和NaHPbO2。將第一次用過的脫硫液對下一批料進行預脫硫,預脫硫后的溶液中幾乎不含Pb,將濾液濃縮可得純度較高的Na2SO4。馬旭等[14]用固相電解法回收鉛,通過NaOH進行脫硫,實驗結果表明,脫硫后的電解液較純凈,幾乎不含,有利于獲得高純度的電沉積鉛粉。N.K.Lyakov等[15]分別用NaOH和Na2CO3進行鉛膏脫硫實驗,研究發現,脫硫效果與脫硫劑濃度、液固比、脫硫時間及溫度等有關;NaOH的脫硫速率比Na2CO3高;用Na2CO3脫硫后的濾液中錫比鉛的濃度高,而用NaOH脫硫后的濾液剛好相反,錫的質量濃度不足0.1 mg/L。
2.5 生物法脫硫
生物法脫硫是指引入一種脫硫細菌 (硫酸鹽還原菌),將鉛膏中的鉛化合物轉化為硫化鉛,再用Fe(BF4)3氧化浸出 PbS,把 S2-氧化為單質 S,或通過堿法煉鉛,將 PbS 還原成 Pb。 Jan Weijma 等[16]研究了生物法脫硫工藝,在實驗過程中,需要添加硫單質或硫酸鹽作為補充,若缺少硫源,還原菌會由于pH的降低而失去活性;此外還需要氫氣作為還原過程中的電子供體。研究表明:經處理后的鉛膏,PbS的質量分數在96%以上,還含有少量的Pb和PbO2;脫硫細菌處理鉛膏的硫化速率能穩定在17 kg/(m3·d)以上。生物轉化反應式為:
2.6 氯鹽法脫硫
用鹽酸浸出鉛膏時,鉛膏中PbSO4不與酸反應,其他含鉛組分均可轉化成PbCl2,同時這兩種鉛鹽在水中的溶解度都很小,嚴重影響鉛膏中鉛的浸出;但這兩種鹽在熱的NaCl溶液中都有較高的溶解度。所以在較高溫度下,向氯化鈉水溶液中加入適量鹽酸,使鉛膏中硫酸鉛溶解于氯化鈉溶液中,金屬鉛及鉛的氧化物在鹽酸與氯化鈉溶液的作用下轉化為氯化鉛從鉛膏中浸出。與此同時,向其中加入一定量的CaCl2,使其與作用產生CaSO4沉淀,生成的NaCl補充了其在浸出過程的消耗。齊美富等[17]對此工藝動力學進行了研究,推斷出鉛膏在HCl-NaCl-CaCl2體系中的浸出過程是液固兩相化學反應,浸出過程屬于固膜(內)擴散控制;王玉[18]對此法進行了研究,結果表明,該工藝效果較好,產物純度較高,工藝清潔無污染,具有較好的環境效益和經濟效益。
3 結束語
與火法冶煉相比,濕法回收鉛具有污染小、回收率高、能耗較低等優點,脫硫是濕法冶金的第一步,尋找到一種方法上可行、具有良好可操作性、經濟收益高的脫硫工藝是當前濕法冶煉的一大難題。目前的工業生產中,Na2CO3脫硫效果較為良好,但脫硫后的副產物硫酸鈉經濟價值不高,較難處理。科研工作者必須進一步加大技術創新力度,努力尋找到環保、無污染的封閉式的回收廢舊鉛膏的新工藝。
[1]劉守廷,蔣天成,羅平,等.CID-ICP-AES法測定廢蓄電池硫酸鉛及其脫硫后沉淀物中硫含量[C]//2008年全國化學與光譜分析會議論文集,2008:105-107.
[2]趙清.ICP-AES測定濕法磷酸萃取料漿中液相三氧化硫含量[J].磷肥與復肥,2006,21(6):62-64.
[3]文海初.高頻紅外吸收法快速測定碳酸鋇中的硫[J].無機鹽工業,2005,37(1):48-49.
[4]應衛.Vario-EL元素分析儀測定含硫配合物的改進方案及應用[J].實驗室科學,2011,14(1):164-167.
[5]胡輝,王文超,王珊珊,等.鉛膏脫硫及其濾液中硫酸鈉回收利用的影響因素實驗研究[C]//中國環境科學學會學術會議論文集,2009:725-729.
[6]劉建斌,黃志明,許明,等.廢鉛酸蓄電池渣泥濕法脫硫和還原新工藝研究[J].無機鹽工業,2004,36(1):47-49.
[7]顧怡卿,劉曉榮,梁曉蓉,等.鉛膏碳酸化脫硫轉化工藝研究[J].上海應用技術學院學報,2008,8(3):169-173.
[8]俞小花,楊大錦,謝剛,等.含硫酸鉛物料的碳酸鹽轉化試驗研究[J].中國稀土學報,2010,28:457-460.
[9]Sonmez M S,Kumar R V.Leaching of waste battery paste components.Part 2:Leaching and desulphurization of PbSO4by citric acid and sodium citrate solution[J].Hydrometallurgy,2009,95(1/2):82-86.
[10]朱新鋒,劉萬超,楊海玉,等.以廢鉛酸電池鉛膏制備超細氧化鉛粉末[J].中國有色金屬學報,2010,20(1):132-136.
[11]Yang Jiakuan,Zhu Xinfeng,Kumar R V.Ethylene glycol-mediated synthesis of PbO nanocrystal from PbSO4:A major component of lead paste in spent lead acid battery[J].Materials Chemistry and Physics,2011,131(1/2):336-342.
[12]Volpe M,Oliveri D,Ferrara G,et al.Metallic lead recovery from lead-acid battery paste by urea acetate dissolution and cementation on iron[J].Hydrometallurgy,2009,96(1/2):123-131.
[13]陳維平.一種濕法回收廢鉛酸蓄電池填料的新技術[J].湖南大學學報,1996,23(6):111-116.
[14]馬旭,王順興,李曉燕.固相電解法從廢鉛酸蓄電池中回收鉛[J].材料研究與應用,2008,2(2):141-144.
[15]Lyakov N K,Atanasova D A,Vassilev V S,et al.Desulphurization of damped battery paste by sodium carbonate and sodium hydroxide[J].Journal of Power Sources,2007,171(2):960-965.
[16]Jan Weijma,Klaas de Hoop,Wobby Bosma,et al.Biological conversion of anglesite (PbSO4) and lead waste from spent car batteries to galena (PbS)[J].Biotechnol.Prog.,2002,18(4):770-775.
[17]齊美富,鄭園芳,桂雙林.廢鉛酸蓄電池中鉛膏氯鹽體系浸取鉛的動力學研究[J].礦冶工程,2010,30(6):61-64.
[18]王玉.廢鉛蓄電池鉛膏濕法回收制取鉛品新工藝的研究[D].合肥:合肥工業大學,2010:24-25.

