頭孢克肟膠囊微生物限度檢查法方法學驗證
北京市豐臺區藥品檢驗所(100071)呂崢崢
頭孢克肟適用于敏感菌所致的咽炎、扁桃體炎、急性支氣管炎和慢性支氣管炎急性發作、中耳炎、尿路感染、單純性淋病(宮頸炎或尿道炎)等。頭孢克肟為第三代口服頭孢菌素,通過抑制細菌細胞壁合成而起殺菌作用,對多數β內酰胺酶穩定,許多產青霉素酶和頭孢菌素酶菌株仍對本品敏感。本品對葡萄菌抗菌作用差,對銅綠假單胞菌、腸桿菌屬、脆弱擬桿菌、梭菌屬等無抗菌作用。
按照《中國藥典》2010年版二部附錄微生物限度檢查法中常規法進行預檢驗[1],5種驗證菌的回收率均小于70%。采用培養基稀釋法(0.2mL/皿),白色念珠菌、黑曲霉回收率大于70%。由于本品為抗生素,對細菌具有很強的抑菌作用,試用離心沉淀法與薄膜過濾法聯用,同時將稀釋液改為含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液,離心沉淀后取1∶100的供試液1mL采用薄膜過濾法,細菌類驗證菌的回收率仍小于70%。因本品為脂溶性抗生素,經試驗發現,以pH 7.0無菌氯化鈉-蛋白胨緩沖液作為稀釋液配制供試品儲備液,離心沉淀后加入十四烷酸異丙酯,充分振搖,以500r/min離心3min,使水油完全分離,棄去油層,將水層混勻,作為1∶10的供試液,最終以1∶100的稀釋液為最低稀釋級,采用薄膜過濾法,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液作為沖洗液。當沖洗量為500mL時,細菌類驗證菌的回收率均大于70%。用常規法和培養基稀釋法(培養基的量為500mL)對本品進行大腸埃希菌檢查,陽性菌未生長,說明本品在該條件下對大腸埃希菌有抑菌作用,采用細菌計數項下供試液,取供試液5mL薄膜過濾,陽性對照菌生長正常。經驗證,此法適用于本品的微生物限度檢查,效果良好。
1 實驗用品
1.1 供試品 頭孢克肟膠囊(批號:091001;規格:0.25g)。
1.2 培養基 營養肉湯培養基、改良馬丁培養基、營養瓊脂培養基、玫瑰紅鈉瓊脂培養基、膽鹽乳糖培養基、4-甲基傘形酮葡糖苷酸培養基(MUG)。均按照《中國藥典》2010年版二部附錄要求配制。
1.3 稀釋液 pH 7.0無菌氯化鈉-蛋白胨緩沖液;十四烷酸異丙酯。
1.4 沖洗液 含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液(注:含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液的配制方法:按照《中國藥典》2010年版二部附錄要求配制pH 7.0無菌氯化鈉-蛋白胨緩沖液,將3g的蛋黃卵磷脂用30g的聚山梨酯80溶解后,加入上述緩沖液1000mL中,混勻、分裝、滅菌。)。
1.5 菌種 枯草芽孢桿菌[CMCC(B)63501];金黃色葡萄球菌[CMCC(B)26003];大腸埃希菌[CMCC(B)44102];白色念珠菌[CMCC(F)98001];黑曲霉[CMCC(F)98003]。均符合《中國藥典》2010年版二部附錄要求。
2 微生物限度檢查法草案
取本品10g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100mL,振搖至供試品分散均勻,制成1∶10的供試品儲備液,取供試品儲備液50mL,以500r/min離心3min,取上清液,加入十四烷酸異丙酯30mL,充分振搖,再以500r/min離心3min,棄去油層,取水層振搖混勻,制成1∶10的供試液,取1∶10的供試液 1mL加入含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液9mL中,制成1∶100的供試液。細菌計數,取1∶100的供試液1mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾法處理,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液,每次100mL,共沖洗5次,取濾膜,依法檢查(中國藥典2010年版二部附錄ⅩⅠJ)。霉菌和酵母菌計數,取1∶10的供試品儲備液1mL,注入5個平皿中,每皿0.2mL,依法檢查(《中國藥典》2010年版二部附錄ⅩⅠJ)。大腸埃希菌檢查,取1∶10的供試液5mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾法處理,沖洗方式同細菌計數項下,取濾膜,加至膽鹽乳糖培養基100mL中,共制備2份,依法檢查(《中國藥典》2010年版二部附錄ⅩⅠJ)。
3 方法學驗證
按照《中國藥典》2010年版二部附錄中要求對上述擬定方法草案進行驗證。
3.1 細菌、霉菌及酵母菌計數方法的驗證[2][3]
3.1.1 菌液制備 ①接種金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌的新鮮培養物至10mL營養肉湯中,33℃培養24h;接種白色念珠菌的新鮮培養物至10mL改良馬丁培養基中,25℃培養24h。上述培養物用0.9%無菌氯化鈉溶液制成每1mL含菌數為50cfu~100cfu的菌懸液。②接種黑曲霉的新鮮培養物至改良馬丁瓊脂斜面培養基上,25℃培養7天,加入3mL含0.05%(mL/mL)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫。過濾菌絲吸出孢子懸液至無菌試管內,用含0.05%(mL/mL)聚山梨酯80的0.9%無菌氯化鈉溶液制成每1mL含孢子數50cfu~100cfu的孢子懸液。
3.1.2 培養基適用性檢查 取上述制備好的大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌菌液各1mL(50cfu~100cfu),分別注入無菌平皿中,立即傾注營養瓊脂培養基,每株試驗菌平行制備2個平皿,混勻,凝固,置33℃培養48h,計數;取上述制備好的白色念珠菌、黑曲霉菌液各1mL(50cfu~100cfu),分別注入無菌平皿中,立即傾注玫瑰紅鈉瓊脂培養基,每株試驗菌平行制備2個平皿,混勻,凝固,置25℃培養72h,計數;同時,用相應的對照培養基替代被檢培養基進行上述試驗。若被檢培養基上的菌落平均數不小于對照培養基上的菌落平均數的70%,且菌落形態大小與對照培養基的菌落一致,判該培養基的適用性檢查符合規定,見附表1。
3.1.3 供試液的制備 取本品10g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100mL,振搖至供試品分散均勻,制成1∶10的供試品儲備液,取供試品儲備液50mL,以500r/min離心3min,取上清液,加入十四烷酸異丙酯30mL,充分振搖,再以500r/min離心3min,棄去油層,取水層振搖混勻,制成1∶10的供試液,取1∶10的供試液 1mL加入含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液9mL中,制成1∶100的供試液。
3.1.4 驗證試驗
3.1.4.1 菌液組 分別取菌液1mL,采用平皿計數法,測定上述制備好的菌液中每毫升的活菌數,測定結果見附表2。
3.1.4.2 供試品對照組 取1∶100的供試液1mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,采用薄膜過濾法,沖洗液為含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液,每次100mL,沖洗5次,測定供試品本底的細菌數,見附表3。取1∶10的供試品儲備液1mL,注入5個平皿中,每皿0.2mL,測定供試品本底的霉菌和酵母菌數,結果見附表3。
3.1.4.3 試驗組 取1∶100的供試液1mL,按供試品對照組同法操作,在第5次沖洗液中加入上述細菌菌液1mL(50cfu~100cfu試驗菌),進行細菌計數,測定結果見附表4。計算回收率見附表5。取1∶10的供試品儲備液0.2mL和上述真菌菌液1mL(50cfu~100cfu試驗菌),分別注入同一平皿中,進行霉菌和酵母菌計數,測定結果見附表4,計算回收率見附表5。
3.1.4.4 稀釋劑對照組 取上述細菌菌液50mL(2500cfu~5000cfu試驗菌),500r/min離心3min,取上清液,加入十四烷酸異丙酯30mL,充分振搖,再以500r/min離心3min,棄去油層,取水層振搖混勻,即為稀釋劑對照液,取1mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,采用薄膜過濾法,沖洗液為含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液,每次100mL,沖洗5次,測定細菌菌數,測定結果見附表6,計算回收率見附表7。霉菌和酵母菌數未采用特殊的方法處理,故稀釋劑對照組可不進行驗證。
將上述用于細菌計數的濾膜,貼于營養瓊脂培養基平板上,置33℃培養3天,逐日觀察結果,霉菌和酵母菌計數傾注玫瑰紅鈉瓊脂培養基,待凝固后,置25℃培養5天,逐日觀察結果。
經上述實驗驗證,采用擬定草案中的方法,可消除本品對細菌的抑菌作用,使細菌類驗證菌的回收率能夠達到要求;采用培養基稀釋法即可使真菌類驗證菌的回收率達到要求,方法可行。
3.2 控制菌檢查方法的驗證
3.2.1 菌液制備 接種大腸埃希菌、金黃色葡萄球菌的新鮮培養物至 10mL營養肉湯中, 33℃培養24h。用0.9%無菌氯化鈉溶液9mL制成每1mL含菌數為10cfu~100cfu菌懸液。
3.2.2 控制菌(大腸埃希菌)檢查用培養基適用性檢查
3.2.2.1 膽鹽乳糖培養基促生長能力和抑制能力檢查 接種不大于100cfu的大腸埃希菌于被檢培養基和對照培養基中,在33℃培養24h,結果顯示,與對照培養基管比較,被檢培養基管試驗菌生長良好,符合規定。接種不少于100cfu的金黃色葡萄球菌于膽鹽乳糖培養基中,在33℃培養24h,結果顯示,未有菌生長,符合規定。
3.2.2.2 4-甲基傘形酮葡糖苷酸培養基(MUG)促生長能力和指示能力檢查 接種不大于100cfu的大腸埃希菌于被檢培養基和對照培養基中,在33℃培養5h,結果顯示,與對照培養基管比較,被檢培養基管試驗菌生長良好,符合規定。與對照培養基管比較,被檢培養基管熒光及指示劑反應一致,符合規定。
3.2.3 供試液的制備 取本品10g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100mL,振搖至供試品分散均勻,制成1∶10的供試品儲備液,取供試品儲備液50mL,以500r/min離心3min,取上清液,加入十四烷酸異丙酯30mL,充分振搖,再以500r/min離心3min,棄去油層,取水層振搖混勻,制成1∶10的供試液。
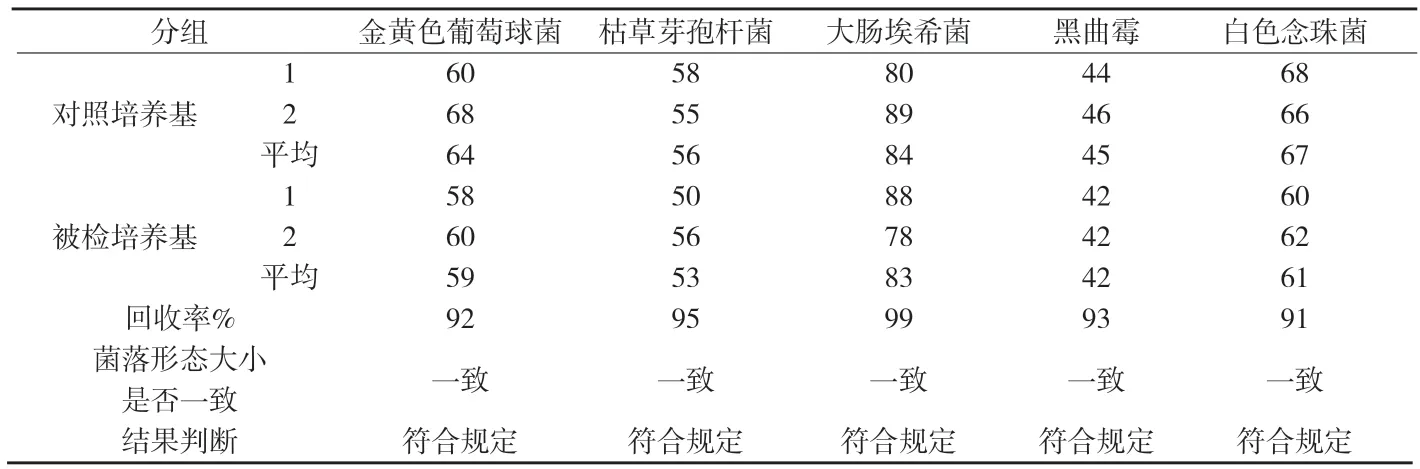
附表1 培養基適用性檢查結果

附表2 菌液組菌落計數(cfu)

附表3 供試品組菌落計數(cfu/皿)

附表4 試驗組菌落計數(cfu/皿)
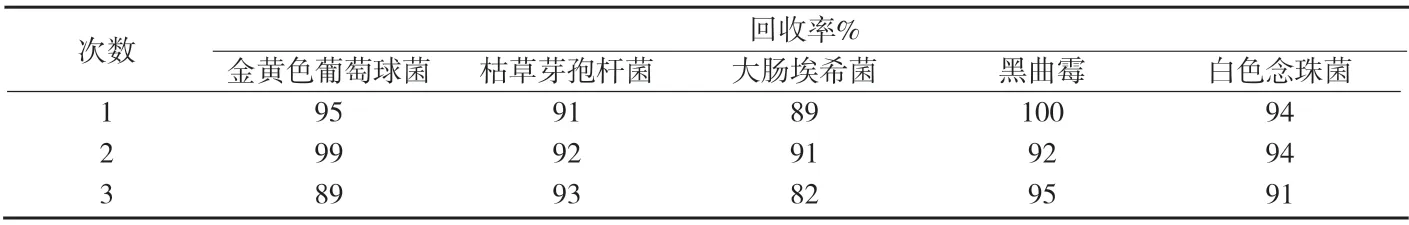
附表5 試驗組回收率測定結果
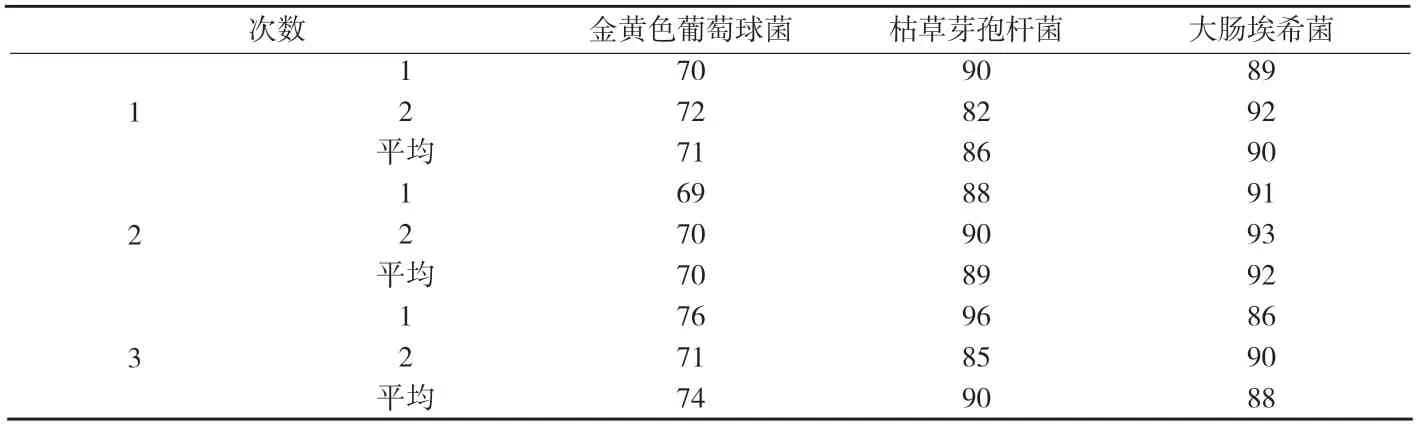
附表6 稀釋劑對照組菌落計數(cfu)

附表7 稀釋劑組回收率測定結果表
3.2.4 大腸埃希菌檢查方法的驗證
3.2.4.1 供試品組 取供試液5mL加至含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾器過濾,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液,每次100mL,共沖洗5次,取濾膜,加至膽鹽乳糖培養基100mL中,置 33℃培養24h,共制備2份。
3.2.4.2 陰性對照組 取稀釋液10mL,加至含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾器過濾,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液,每次100mL,共沖洗5次,取濾膜,加至膽鹽乳糖培養基100mL中,置 33℃培養24h。
3.2.4.3 陽性對照組 取供試液5mL,加至含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾器過濾,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液,每次100mL,共沖洗5次,取濾膜,加至膽鹽乳糖培養基100mL中,加入上述大腸埃希菌菌液1mL(10cfu~100cfu),置33℃培養24h。
取上述培養物各0.2mL,分別加入含5mL的4-甲基傘形酮葡糖苷酸培養基(MUG)試管中,置33℃培養24h,觀察結果,見附表8。結果顯示,陽性對照菌生長良好,表明本品在該條件下對大腸埃希菌無抑菌作用或其抑菌作用可以忽略不計。說明采用該法進行本品的大腸埃希菌檢查可行。
總之,前述擬定的方法草案可行。
4 方法學驗證結論
微生物限度:取本品10g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100mL,振搖至供試品分散均勻,制成1∶10的供試品儲備液,取供試品儲備液50mL,以500r/min離心3min,取上清液,加入十四烷酸異丙酯30mL,充分振搖,再以500r/min離心3min,棄去油層,取水層振搖混勻,制成1∶10的供試液,取1∶10的供試液 1mL加入含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液9mL中,制成1∶100的供試液。細菌計數,取1∶100的供試液1mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾法處理,以含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液,每次100mL,共沖洗5次,取濾膜,依法檢查(《中國藥典》2010年版二部附錄ⅩⅠJ)。霉菌和酵母菌計數,取1∶10的供試品儲備液1mL,注入5個平皿中,每皿0.2mL,依法檢查(《中國藥典》2010年版二部附錄ⅩⅠJ)。大腸埃希菌檢查,取1∶10的供試液5mL,置含3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液100mL中,用薄膜過濾法處理,沖洗方式同細菌計數項下,取濾膜,加至膽鹽乳糖培養基100mL中,共制備2份,依法檢查(《中國藥典》2010年版二部附錄ⅩⅠJ)。但1g供試品中,細菌數不得過1000cfu,霉菌和酵母菌數不得過100cfu,大腸埃希菌不得檢出。

附表8 大腸埃希菌檢查結果

附表9 供試品微生物限度檢查結果
5 供試品的檢查
按照上述確定的微生物限度檢查方法檢驗供試品,結果符合規定,見附表9。
6 討論
頭孢克肟是具有較強抑菌活性的藥物,在微生物限度檢驗中應采用適當方法消除其抑菌作用。本法采用3%聚山梨酯80和0.3%蛋黃卵磷脂的pH 7.0無菌氯化鈉-蛋白胨緩沖液作為稀釋液,離心沉淀后,加入十四烷酸異丙酯,充分振搖,以500r/min離心3min,使水油完全分離,棄去油層,將水層混勻,作為1∶10的供試液,最終以1∶100的稀釋液為最低稀釋級,分別運用培養基稀釋法和薄膜過濾法制得供試品溶液,經驗證,驗證菌株均生長良好,適用本品的微生物限度檢查。

