細胞連接在慢性鼻竇炎中的表達及意義
李 穎 范爾鐘 伯銘羽 王向東 張 羅*
(1.首都醫科大學附屬北京同仁醫院耳鼻咽喉頭頸外科,北京100005;2.北京市耳鼻咽喉科研究所,耳鼻咽喉頭頸科學教育部重點實驗室,鼻病研究北京市重點實驗室,北京100005)
呼吸道的黏膜上皮細胞構成了機體與外界環境的第一道屏障,上皮黏膜細胞與細胞之間通過各種細胞連接緊密聯系在一起,包括緊密連接(tight junctions,TJs)、黏附連接(adherens junctions,AJs)、縫隙連接(gap junctions)以及橋粒(desmosomes)[1]。當在感染、炎性反應等條件下,細胞連接被擾亂,上皮屏障功能被破壞。本研究通過免疫組織化學方法檢測緊密連接蛋白(zonular occludens-1,ZO-1)、黏附連接蛋白(E-cadherin)和橋粒連接蛋白(desmoglein-1,dsg-1)在不同類型慢性鼻竇炎中的表達,旨在探究細胞連接蛋白表達的改變與上皮屏障功能的破壞及上皮組織重塑的關系,和其在慢性鼻竇炎發病機制中的作用。
1 材料與方法
1.1 研究對象
選取2010年12月至2012年8月在首都醫科大學附屬北京同仁醫院行鼻內鏡手術的患者標本60例。不伴鼻息肉的慢性鼻竇炎(chronic rhinosinusitis without nasal polyps,CRSsNP)患者(CRSsNP 組)15例,伴鼻息肉的慢性鼻竇炎(chronic rhinosinusitis with nasal polyps,CRSwNP)患者(CRSwNP 組)30 例,對照鼻中隔偏曲患者(control組)15例。所有患者術前2周均未應用糖皮質類固醇激素及抗生素,并排除有變應性真菌性鼻-鼻竇炎、原發性不動纖毛綜合征、囊性纖維化疾患的患者。CT提示CRSsNP組患者無鼻息肉性疾病,對照組患者無鼻竇炎性疾病。術中取CRSsNP組患者鉤突或鼻竇黏膜組織、CRSwNP組患者息肉組織和對照組患者中鼻甲黏膜組織。所有患者術前均簽署知情同意書,本研究經過首都醫科大學附屬北京同仁醫院倫理委員會批準。
1.2 蘇木精-伊紅(HE)染色
所有標本均用10%中性甲醛固定,石蠟包埋,切片厚4 μm對石蠟切片常規脫蠟、水化后,蘇木精染色10 min,分化、返藍,伊紅染色3 min,脫水、透明、封片。HE染色切片用于組織形態學觀察和對組織的總炎性細胞、嗜酸性粒細胞進行計數。每張切片隨機選取10個高倍視野計數并計算嗜酸性粒細胞占總炎性細胞的百分比,根據文獻[2]將本研究中對照組嗜酸性粒細胞的平均百分比與兩倍標準差之和(2.58%+2×1.55%=5.68%,約為6%)作為區分嗜酸性粒細胞性鼻息肉(Eos CRSwNP)和非嗜酸性粒細胞性鼻息肉(non-Eos CRSwNP)兩個亞型的標準,>6%為嗜酸性粒細胞性鼻息肉,否則為非嗜酸性粒細胞性鼻息肉,兩組各15例。
1.3 免疫組織化學染色
切片常規脫蠟至水,高壓抗原熱修復,3%H2O2阻斷內源性過氧化物酶,5%脫脂奶粉封閉非特異性染色,兔抗多克隆抗體 ZO-1(1∶500,購自美國 Invitrogen公司)、鼠抗單克隆抗體E-cadherin(工作液,購自北京中杉金橋生物技術有限公司)、兔抗多克隆抗體 dsg-1(1 ∶500,購自美國 Santa Cruz Blotechnology公司)4℃過夜。通用型二抗PV-6000(工作液,購自北京中杉金橋生物技術有限公司)室溫40 min,DAB顯色,蘇木精復染,脫水、透明、封片。以PBS代替一抗作為陰性對照。陽性染色細胞為胞膜或胞質內清晰的棕黃色顆粒。
1.4 結果判定
將染色結果在OlympusBX51顯微鏡下進行半定量分析。采用免疫組織化學評分(immunohistochemical score,IHS)方法[3],結合陽性細胞百分比和陽性細胞染色強度2個方面評分:a為陽性細胞百分比(無陽性細胞為0分,陽性細胞占1% ~10%為1分,11% ~50%為2分,51% ~80%為3分,81% ~100%為4分);b為陽性細胞染色強度(陰性為0分,弱陽性為1分,中度陽性為2分,強陽性為3分),a和b兩項乘積即為該例組織的IHS。3種連接蛋白表達情況以IHS表示,每張切片高倍鏡下選取上皮組織中5個不重復視野,取這5個視野的均數,并做統計分析。
1.5 統計學方法
應用SPSS 18.0進行統計分析。實驗結果以均數±標準差(ˉ±s)表示,組間比較采用單因素方差分析和LSD法。以P<0.05為差異有統計學意義。
2 結果
2.1 樣本特征
60例樣本中,CRSsNP組鼻黏膜標本15例,其中男12例,女3例,患者年齡17~70歲,平均年齡(43.5±16.6)歲;CRSwNP組鼻息肉標本30例,其中男23例,女7例,患者年齡14~67歲,平均年齡(45.6±15.8)歲;對照組15例,其中男7例,女8例,患者年齡14~53歲,平均年齡(37.0±11.2)歲。
2.2 細胞連接的表達
3種細胞連接在不同組別鼻黏膜上皮中均可見陽性表達,表現為胞膜或胞質內有棕黃色顆粒沉積,且在上皮的上、中、下層均有表達。但各組的表達強弱和多少存在不同程度的差異。
在ZO-1的表達中,只有Eos CRSwNP組與對照組相比有明顯下降(P<0.05);non-Eos CRSwNP組和CRSsNP組與對照組兩兩相比雖有下降,但差異無統計學意義(P>0.05);兩個CRSwNP亞型之間,CRSw-NP亞型與CRSsNP組之間兩兩相比,差異均無統計學意義(P>0.05,表 1,圖1)。

表1 不同組別鼻黏膜上皮中細胞連接的表達結果Tab.1 The expression of cell junction proteins from nasal epithelial cells under different conditions
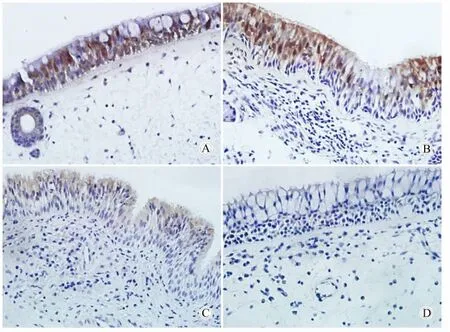
圖1 緊密連接蛋白在不同組別鼻黏膜上皮中的表達情況(二步法免疫組織化學染色)Fig.1 The expression of ZO-1 from nasal epithelial cells(two-step immunohistochemical staining results)(400×)
在E-cadherin的表達中,兩個CRSwNP亞型以及CRSsNP組與對照組兩兩相比呈明顯上調表達(P<0.05),兩個 CRSwNP亞型之間,CRSwNP亞型與CRSsNP組之間兩兩相比,差異無統計學意義(表1,圖2)。
在 dsg-1的表達中,兩個 CRSwNP亞型以及CRSsNP組與對照組兩兩相比明顯下調(P<0.05),并且兩個CRSwNP亞型與CRSsNP組兩兩相比也有明顯下調(P<0.05),但兩個CRSwNP亞型之間差異無統計學意義(表1,圖3)。
3 討論
上皮屏障是通過鄰近的細胞間由緊密連接(TJs)、黏附連接(AJs)、橋粒和縫隙連接組成的連接復合體緊密地聯系在一起來維持的[4]。TJs位于上皮細胞間連接的最頂部,是維持黏膜通透性的重要組成部分[5]。TJs由多種蛋白組成[6],ZO-1(zonular occludens-1)是 1986 年發現的與 TJ 相關的蛋白[7]。其與維持和調節上皮籬笆和屏障功能有關,還參與調節細胞物質轉運、維持上皮極性、細胞增生分化、腫瘤細胞轉移等重要過程。ZO-1是最具特征的胞質緊密連接蛋白[8]。以膜結合蛋白丟失為特點的TJs的破壞,導致貫通上皮電阻的顯著減少和貫通上皮滲透性的明顯增加[9]。貫通上皮電位差的存在,表明鼻息肉患者屏障功能的改變[10]。
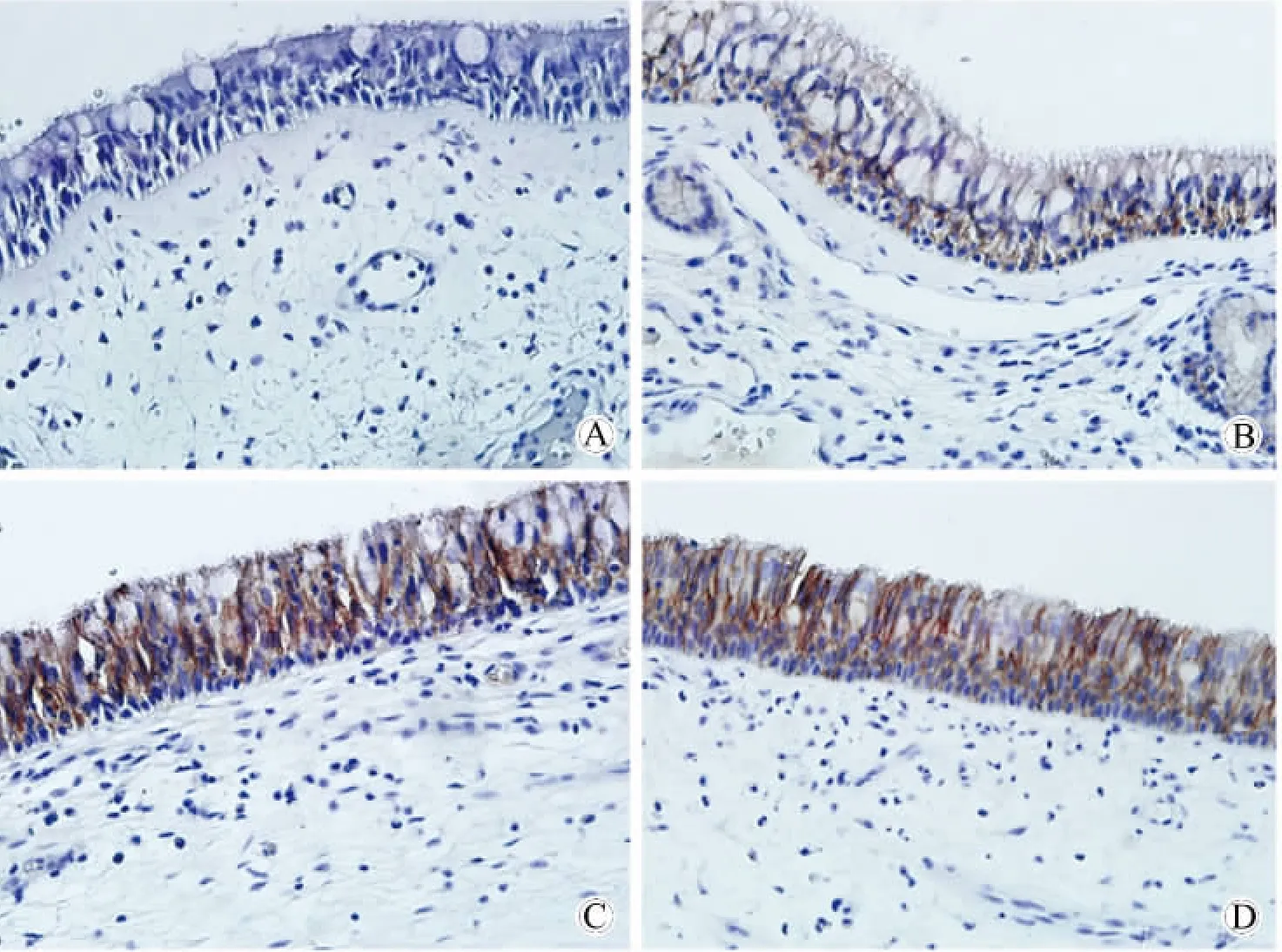
圖2 黏附鏈接蛋白在不同組別鼻黏膜上皮中的表達情況(二步法免疫組織化學染色)Fig.2 The expression of E-cadherin from nasal epithelial cells(two-step immunohistochemical staining results)(400×)
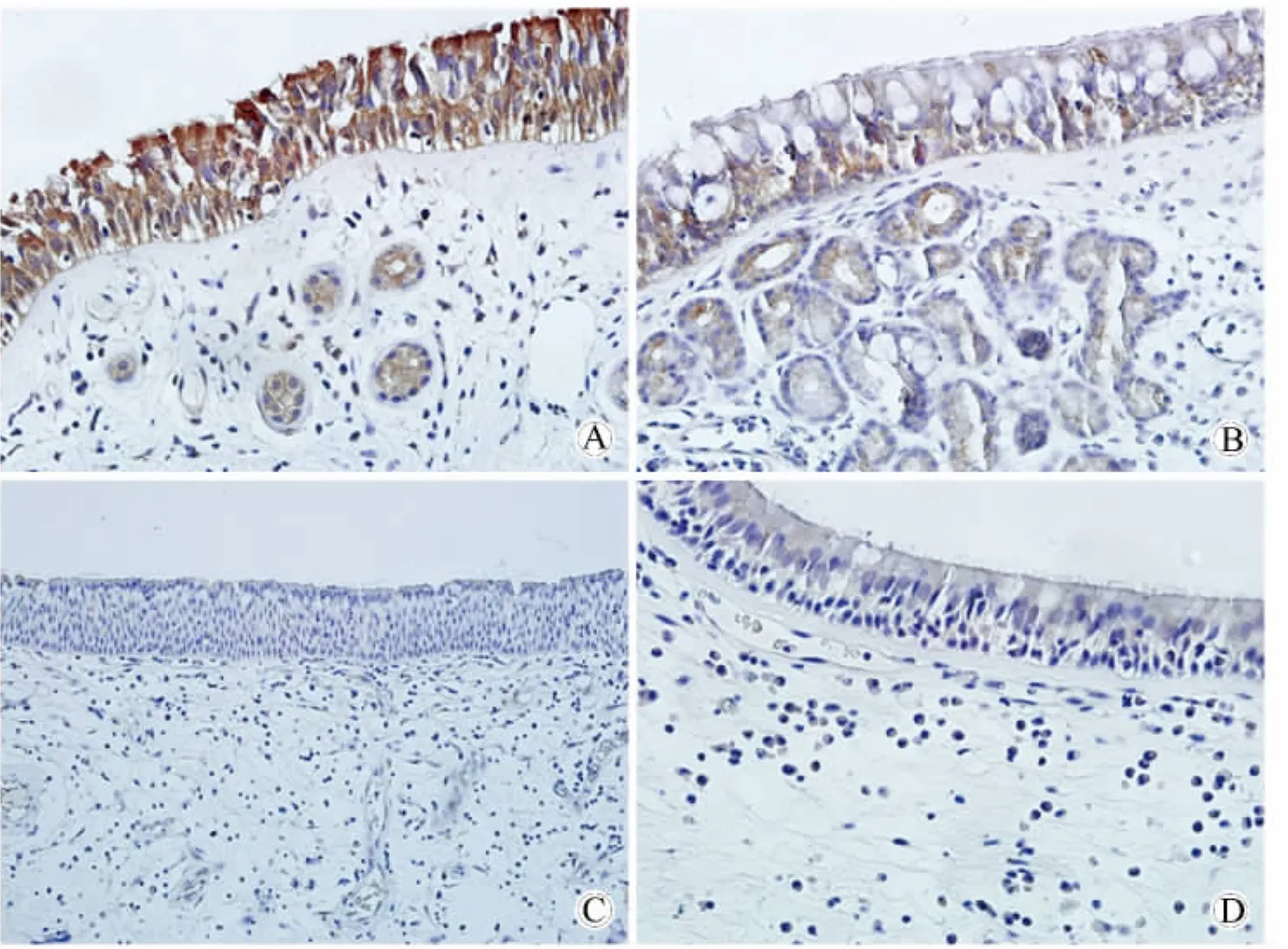
圖3 橋粒連接蛋白在不同組別鼻黏膜上皮中的表達情況(二步法免疫組織化學染色)Fig.3 The expression of dsg-1 from nasal epithelial cells(two-step immunohistochemical staining results)(400×)
AJs在上皮細胞間起著加強細胞間連接的功能。其中上皮鈣黏素(E-cadherin)是一類鈣依賴性跨膜糖蛋白,是AJ的主要成分。它與形態分化和細胞增生的控制、特定位置基因表達、形態發生、免疫功能、細胞運動、傷口愈合和炎性反應有密切關系[11]。
橋粒存在于所有的上皮細胞以及某些特化的組織。其主要由兩類蛋白組成:一類是跨膜蛋白,主要由橋粒芯糖蛋白(desmoglein,dsg)和橋粒膠蛋白(desmocollin,dsc)構成;另一類為細胞質內的蛋白,主要成分為橋粒斑蛋白(desmoplakin)和橋粒斑珠蛋白(plakoglobin)。其也起加強連接的作用。Dsg是橋粒的主要跨膜蛋白,是構成細胞間橋粒的主要糖蛋白,分為 dsg-1、dsg-2 和 dsg-3。dsg-1 為 160 000 糖蛋白。一般認為,dsg-1主要分布于正常表皮細胞的上部,被認為系落葉性天皰瘡的主要靶抗原。Dsg-1的表達下調可能在角質形成細胞的分化及腫瘤的發生中有一定的作用[12]。Spindler等[13]認為,在正常表皮細胞的中、下部也可有dsg-1的明顯表達。
本研究探討了3種細胞連接在不同類型的慢性鼻竇炎上皮組織中的表達情況,發現TJs蛋白ZO-1和橋粒連接蛋白dsg-1與對照組相比呈下調表達,而AJs蛋白E-cadherin呈上調表達。Jang等[14]的研究顯示,在鼻息肉組織中,ZO-1隨上皮細胞增生和鱗狀化生程度的增加呈下調表達,而E-cadherin隨上皮細胞增生和鱗狀化生程度的增加呈上調表達。在本研究中,ZO-1的表達只有Eos CRSwNP組與對照組相比下降的程度差異有統計學意義,其中non-Eos CRSwNP組與對照組相比,差異也較明顯。因此,筆者將兩個CRSwNP亞型之和的總鼻息肉組與對照組進行了比較,結果差異亦有統計學意義。說明在CRSsNP中,還不足以引起ZO-1表達的顯著變化。只有在鼻息肉組織中,才使ZO-1的表達產生明顯變化,Eos CRSw-NP的ZO-1表達比non-Eos CRSwNP更低一些,提示嗜酸性粒細胞可能在其中發揮一定作用,但由于每組例數較少(只有15例),且2個CRSwNP亞型間差異無統計學意義,還不足以說明問題,有待在今后的研究中探討詳盡機制。鼻息肉上皮中E-cadherin相對于正常黏膜的表達上調可以被認為是一種補償現象,是為維持在炎性反應條件下的正常細胞結構[15]。本研究結果也證實了這一現象,除了鼻息肉組的E-cadherin表達上調,CRSsNP組的E-cadherin表達也明顯上調,說明E-cadherin的表達與鼻黏膜的炎性反應程度和組織重塑程度呈正相關性。與對照組相比,dsg-1在鼻息肉組和 CRSsNP組的表達均明顯下調,且CRSwNP組也與CRSsNP組相比有明顯下降趨勢,但兩個CRSwNP亞型之間差異無統計學意義,說明隨黏膜炎性反應程度的加劇,對dsg-1蛋白的破壞也逐漸增強,但嗜酸性粒細胞的浸潤并沒有對其產生明顯影響。
在 Zuckerman 等[16]的研究中顯示,dsg-2、dsg-3 蛋白在人鼻息肉中的表達明顯低于正常鼻黏膜,而ZO-1和E-cadherin在這兩組中的表達卻沒有明顯區別。這可能與其病例的篩選和分組不同有關。在Zuckerman的研究中,將產生上皮鱗狀化生的鼻息肉組織排除在外,鼻息肉組包括有Samter’s三聯征患者,囊性纖維變性患者和變應性真菌性鼻竇炎患者,其中有5人有已知過敏和2人接受了通常的免疫治療,且所有患者在手術前都接受了5天的類固醇激素治療。在另一研究[17]中,哮喘和過敏性疾病中可有橋粒表達的減弱,提示變態反應對橋粒的表達是有影響的。但是也有研究[18]顯示,過敏性鼻炎的鼻黏膜中,緊密連接的蛋白表達、結構和功能被很好地維持。
有研究證明在炎性腸疾病[19],過敏性炎性反應[20-22]和病毒感染中[23],TJs和 AJs 的破壞在其發病機制中發揮重要作用。由于每個研究者的研究角度、分類方法和所采用的檢測指標及手段不同,研究結果也有一定差異。但對于上述原因可導致上皮屏障功能的破壞與改變,還是得到大多數研究的支持。關于上氣道炎性反應疾病尤其是慢性鼻竇炎中細胞連接的作用報道較少,且多數研究者僅對鼻息肉與正常鼻黏膜進行了比較。筆者在此項研究中,按組織的炎性反應程度進行了更為細致的分組,且將3種主要細胞連接中最具代表性的連接蛋白進行了檢測。通過對其表達改變情況的觀察和相互關系的分析,對鼻黏膜不同炎性反應狀態下,細胞連接的改變有了更進一步的了解,以期對慢性鼻竇炎發病機制的研究提供新的認識。
[1]Chang E H,Pezzulo A A,Zabner J.Do cell junction pro-tein mutations cause an airway phenotype in mice or humans?[J].Am J Respir Cell Mol Biol,2011,45(2):202-220.
[2]Cao P P,Li H B,Wang B F,et al.Distinct immunopathologic characteristics of various types of chronic rhinosinusitis in adult Chinese[J].J Allergy Clin Immunol,2009,124(3):478-484.
[3]Soslow R A,Dannenberg A J,Rush D,et al.COX-2 is expressed in human pulmonary, colonic, and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[4]Liu Y,Nusrat A,Schnell F J,et al.Human junction adhesion molecule regulates tight junction resealing in epithelia[J].J Cell Sci,2000,113(Pt13):2363-2374.
[5]Pizzuti D,Bortolami M,Mazzon E,et al.Transcriptional downregulation of tight junction protein ZO-1 in active coeliac disease is reversed after a gluten-free diet[J].Dig Liver Dis,2004,36(5):337-341.
[6]K?hler K,Zahraoui A.Tight junction:a co-ordinator of cell signalling and membrane trafficking[J].Biol Cell,2005,97(8):659-665.
[7]Stevenson B R,Siliciano J D,Mooseker M S,et al.Identification of ZO-1:a high molecular weight polypeptide associated with the tight junction(zonula occludens)in a variety of epithelia[J].J Cell Biol,1986,103(3):755-766.
[8]Jesaitis L A,Goodenough D A.Molecular characterization and tissue distribution of ZO-2,a tight junction protein homologous to ZO-1 and the Drosophila discs-large tumor suppressor protein[J].J Cell Biol,1994,124(6):949-961.
[9]Klingler C,Kniesel U,Bamforth S D,et al.Disruption of epithelial tight junctions is prevented by cyclic nucleotidedependent protein kinase inhibitors[J].Histochem Cell Biol,2000,113(5):349-361.
[10]Bernstein J M,Gorfien J,Noble B,et al.Nasal polyposis:immunohistochemistry and bioelectrical findings(a hypothesis for the development of nasal polyps)[J].J Allergy Clin Immunol,1997,99(2):165-175.
[11]Harrington K J,Syrigos K N.The role of E-cadherin-catenin complex:more than an intercellular glue?[J].Ann Surg Oncol,2000,7(10):783-788.
[12]Harada H,Iwatsuki K,Ohtsuka M,et al.Abnormal desmoglein expression by squamous cell carcinoma cells[J].Acta Derm Venereol,1996,76(6):417-420.
[13]Spindler V,Drenckhahn D,Zillikens D,et al.Pemphigus IgG causes skin splitting in the presence of both desmoglein 1 and desmoglein 3[J].Am J Pathol,2007,171(3):906-916.
[14]Jang Y J,Kim H G,Koo T W,et al.Localization of ZO-1 and E-cadherin in the nasal polyp epithelium[J].Eur Arch Otorhinolaryngol,2002,259(9):465-469.
[15]Demetter P,De Vos M,Van Damme N,et al.Focal upregulation of E-cadherin-catenin complex in inflamed bowel mucosa but reduced expression in ulcer-associated cell lineage[J].Am J Clin Pathol,2000,114(3):364-370.
[16]Zuckerman J D,Lee W Y,DelGaudio J M,et al.Pathophysiology of nasal polyposis:the role of desmosomal junctions[J].Am J Rhinol,2008,22(6):589-597.
[17]Shahana S,Jaunmuktane Z,Asplund M S,et al.Ultrastructural investigation of epithelial damage in asthmatic and non-asthmatic nasal polyps[J].Respir Med,2006,100(11):2018-2028.
[18]Takano K,Kojima T,Go M,et al.HLA-DR-and CD11cpositive dendritic cells penetrate beyond well-developed epithelial tight junctions in human nasal mucosa of allergic rhinitis[J].J Histochem Cytochem,2005,53(5):611-619.
[19]Fries W,Mazzon E,Squarzoni S,et al.Experimental colitis increases small intestine permeability in the rat[J].Lab Invest,1999,79(1):49-57.
[20]Kobayashi N,Terada N,Hamano N,et al.Transepithelial migration of activated eosinophils induces a decrease of E-cadherin expression in cultured human nasal epithelial cells[J].Clin Exp Allergy,2000,30(6):807-817.
[21]Takeuchi K,Kishioka C,Ishinaga H,et al.Histamine alters gene expression in cultured human nasal epithelial cells[J].J Allergy Clin Immunol,2001,107(2):310-314.
[22]Wan H,Winton H L,Soeller C,et al.Quantitative structural and biochemical analyses of tight junction dynamics following exposure of epithelial cellsto house dust mite allergen Der p 1[J].Clin Exp Allergy,2000,30(5):685-698.
[23]Dickman K G,Hempson S J,Anderson J,et al.Rotavirus alters paracellular permeability and energy metabolism in Caco-2 cells[J].Am J Physiol Gastrointest Liver Physiol,2000,279(4):G757-G766.

