鼠源T細胞受體單克隆抗體對Ⅱ型膠原誘導DBA/1小鼠關節炎的治療作用
韓春光,黃火高,王 瓊,高志清,彭明麗,承京霞,劉永學
(1.軍事醫學科學院放射與輻射醫學研究所藥理學與毒理學研究室,北京 100850;2.中國人民解放軍海軍總醫院干部保健科,北京 100037)
類風濕性關節炎(rheumatoid arthritis,RA)是一種慢性進行性的自身免疫性疾病,以關節滑膜炎和對稱性、破壞性的關節病變為主要特征。近年來,免疫分子在RA發病中的作用越來越受到人們重視。抗原提呈細胞通過T細胞受體(T cell receptors,TCR)與T細胞識別,后者在B7共刺激因子的作用下被活化,活化的T細胞再激活巨噬細胞,由巨噬細胞產生多種炎性細胞因子,這些炎性細胞因子進一步作用于巨噬細胞、成纖維細胞、T細胞和成骨細胞,通過細胞基質金屬蛋白酶和NF-κB受體激活物的配基等導致軟骨和骨破壞[1]。由此提示,TCR抗體對RA可能具有一定的治療作用。本研究制備DBA/1小鼠Ⅱ型膠原誘導性關節炎(collagen induced arthritis,CIA)小鼠模型,觀察鼠源 TCR(mouse TCR,mTCR)單抗對RA的治療作用。
1 材料與方法
1.1 動物、藥物、試劑和儀器
DBA/1小鼠,體質量20~24 g,18周齡,雄性,購自上海藥物研究所,SPF級飼養,動物合格證號:中科動管會第001號。地塞米松磷酸鈉注射液,天津金耀氨基酸有限公司;mTCR單抗,美國Gene Tex公司。牛Ⅱ型膠原和完全弗氏佐劑,美國Chondrex公司。Luminex200型多功能流式液相芯片分析儀,美國Millipore公司。
1.2 動物分組、模型制備和給藥
將DBA/1小鼠隨機分為正常對照、模型、地塞米松0.5 mg·kg-1和 mTCR 單抗25 mg·kg-1治療組,每組6只。CIA小鼠模型的制備按照文獻[2]進行。除正常對照組外,將牛Ⅱ型膠原和完全弗氏佐劑充分混合,制成膠原乳劑,含Ⅱ型膠原2 g·L-1,每只小鼠尾根部皮內1次注射100 μl,將注射當日記為第1天,于第21天加強誘導1次。地塞米松治療組于第29~41天皮下注射地塞米松磷酸鈉注射液,隔日一次;mTCR單抗治療組分別于第0和第21天皮下注射給藥1次;正常對照和模型對照組皮下注射等體積生理鹽水。
1.3 體質量和足掌厚度測量、關節炎評分及CIA發生率計算
以電子天平動態稱量小鼠體質量,每周2次。以游標卡尺測量小鼠足掌厚度。關節炎炎癥指數評分標準:0分,關節正常;1分,關節輕微紅腫;2分,關節紅腫嚴重,累及整個關節;3分,足爪或關節功能障礙,關節僵硬。每只小鼠的關節炎癥的總評分為四肢評分的總和,每只小鼠的最高分值為12分,關節總評分大于1的小鼠為建模成功小鼠[3]。
1.4 踝關節組織病理變化觀察
連續觀察到給藥后第60天實驗結束,處死小鼠,取踝關節進行組織切片,HE染色,鏡下觀察組織病理改變,包括關節組織炎癥細胞浸潤和骨骼破壞。
1.5 血清細胞因子測定
連續觀察到給藥后第60天實驗結束,取血清,通過Luminex200液晶芯片分析平臺,測定小鼠血清 γ 干擾素(interferon-γ,IFN-γ)、腫瘤壞死因子 α(tumor necrosis factor-α,TNF-α)和白細胞介素 4(interleukin-4,IL-4)的含量。
1.6 統計學分析
2 結果
2.1 mTCR單抗對CIA模型小鼠體質量和足腫脹度的影響
實驗過程中,各組小鼠體質量無明顯變化。CIA發生發展過程中,小鼠的受累關節首先表現為腫脹,足掌厚度明顯增加(P<0.01)。與模型組比較,第31~59天,地塞米松和mTCR單抗治療組足掌厚度明顯降低(P<0.01)(圖1)。
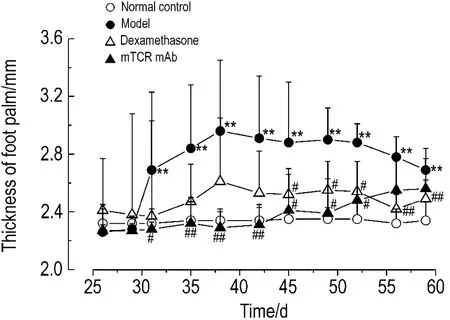
Fig.1 Effect of mouse monoclonal antibody of T cell receptors(mTCR mAb)on thickness of foot palm of collagen typeⅡinduced arthritis(CIA)model mice.On the 1st and 22nd day,bovine typeⅡcollagen and complete Freund adjuvant emulsion was injected intradermally in order to prepare the CIA mouse model.From the 29th to 41st day,dexamethasone sodium phosphate injection 0.5 mg·kg -1was sc given to the mice of dexamethasone treatment group every other day.The mice of mTCR mAb group were sc injected mTCR mAb 25 mg·kg -1on the 0(before model preparation)and 21st day,respectively.After administration for 60 d,the thickness of foot palm was mearsured.±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.2 mTCR單抗對CIA模型小鼠關節炎指數的影響
如圖2所示,自第28天發病開始,CIA模型組小鼠關節炎指數逐漸增加(P<0.01)。與模型組比較,地塞米松和mTCR單抗治療組小鼠的炎癥指數明顯減小(P<0.05,P<0.01)。
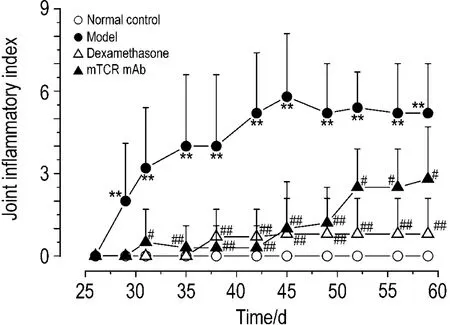
Fig.2 Effect of mTCR mAb on joint inflammatory index in CIA model mice.See Fig.1 for the mouse treatment.±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.3 mTCR單抗對CIA模型小鼠CIA發生率的影響
從第29天開始,模型組小鼠逐漸出現關節紅腫和關節活動受限等典型的CIA病變。第42天,模型組CIA發生率已達6/6,地塞米松和mTCR單抗治療組分別為2/6和1/6;第49天,模型組和地塞米松治療組CIA發生率維持不變,mTCR單抗治療組升高為5/6(表1)。
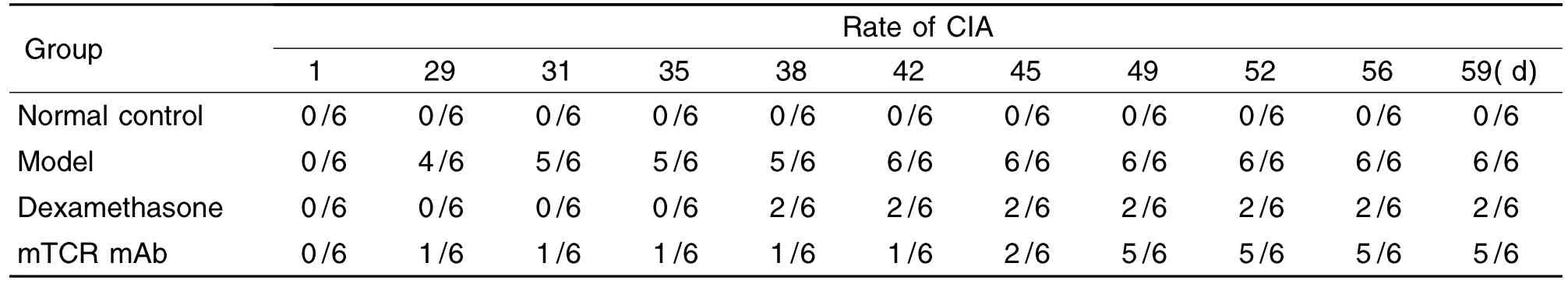
Tab.1 Effect of mTCR mAb on incidence of CIA in DBA/1 mice
2.4 mTCR單抗對CIA模型小鼠踝關節組織病理變化的影響
與正常組(圖3A)相比,模型組小鼠踝關節表現為大量炎癥細胞浸潤,骨侵蝕明顯(圖3B);與模型組比較,地塞米松和mTCR單抗治療組小鼠僅有少量炎癥細胞浸潤,而且骨侵蝕不明顯(圖3C,D)。
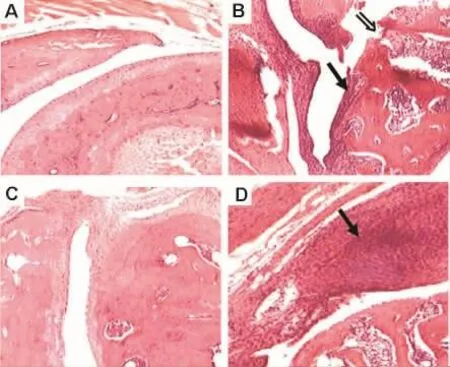
Fig.3 Effect of mTCR mAb on pathological changes of ankle joints in CIA model mice(200 ×).See Fig.1 for the mouse treatment.A:normal control;B:model;C:dexamethasone;D:mTCR mAb.?:bony erosion;↑:inflammatory cells infiltrate.
2.5 mTCR單抗對 CIA模型小鼠血清 IFN-γ,IL-4和TNF-α含量的影響
表2結果顯示,與正常組相比,模型組小鼠血清IL-4含量明顯降低(P<0.05),TNF-α 含量明顯增加(P<0.01);與模型組相比,地塞米松和mTCR單抗治療組小鼠IL-4含量顯著增加(P<0.05),TNF-α明顯降低(P<0.05);各組小鼠血清 IFN-γ含量無明顯變化。
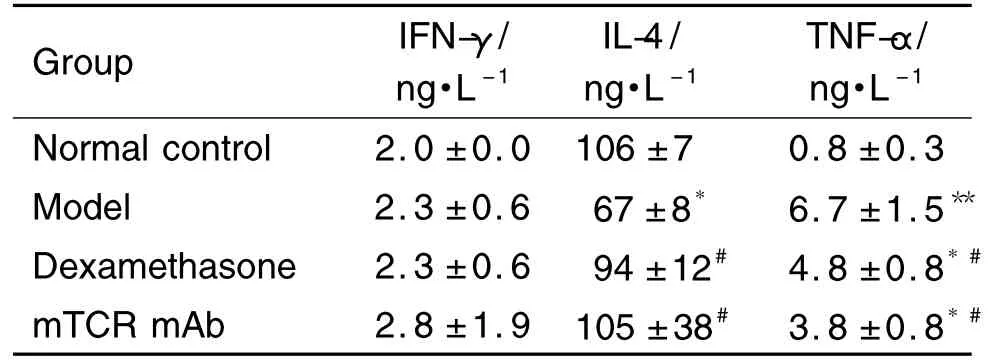
Tab.2 Effect of mTCR mAb on serum concentration of interferon-γ(IFN-γ),interleukin-4(IL-4)and tumor necrosis factor-α(TNF-α)in CIA model mice
3 討論
RA是一種常見的自身免疫性疾病。T細胞介導的免疫調節紊亂是其發病機制之一。據報道,RA受累關節局部T細胞數量明顯增加,而且病變程度與T細胞聚集程度密切相關[4],提示T細胞及其有關的免疫炎癥反應參與了RA的發生發展過程。因此,免疫反應與炎癥細胞、炎癥介質和細胞因子等各自作用和相互關系已成為目前治療RA研究的重要內容之一[5]。
RA涉及的細胞免疫反應主要與某些特定的T細胞亞群有關。TCR是成熟T細胞的特征性標志,與人類白細胞抗原(human leukocyte antigen,HLA)形成HLA-抗原-TCR復合物,并激活T細胞,是T細胞表面特異性識別抗原和介導免疫應答的分子,也是TCR單抗有望成為RA防治藥物的理論基礎[6]。
本研究結果發現,mTCR單抗可以降低CIA的發生率,明顯減輕足掌腫脹度,降低關節炎癥指數,明顯降低炎癥細胞浸潤和骨破壞。由此提示,mTCR單抗對CIA具有一定的治療作用,也進一步證實T細胞參與RA的發病過程。但自給藥后第45天開始,mTCR單抗治療組足掌厚度和炎癥指數有所升高;第49天以后CIA發生率升高,接近模型組;上述結果提示本研究mTCR單抗的給藥方案需進一步改進,如增加給藥次數等。
RA發病過程中 T輔助細胞1(T helper 1,Th1)和Th2平衡失調[7],它們主要通過分泌不同的細胞因子影響RA的發展過程。Th1細胞產生IFN-γ,IL-2和TNF-α等,參與細胞免疫反應;Th2細胞產生IL-4和IL-10等,參與體液免疫反應。本研究結果表明,模型組小鼠血清TNF-α水平顯著高于正常對照組,IL-4水平低于正常對照組;與模型組相比,地塞米松和mTCR單抗治療組血清TNF-α含量明顯降低,IL-4含量明顯升高,提示CIA模型小鼠Th1/Th2平衡失調,地塞米松和mTCR單抗均可恢復其平衡,mTCR單抗對CIA的治療作用可能與調節細胞因子水平、恢復Th1/Th2平衡有關。
[1]Xi ZD, Zhang DQ, Zhang YY, Zang JW.Research advances on collagen-induced arthritis in mice[J].Nat Mag(自然雜志),2003,25(1):46-41.
[2]Cheng JX,Han CG,Wang Q,Xu JP,Liu YX.Characterization of collagen induced arthritis in DBA/1 mice[J].Pharm J Chin PLA(解放軍藥學學報),2007,23(2):94-96.
[3]Aerts NE,Dombrecht EJ,Ebo DG,Bridts CH,Stevens WJ,De Clerck LS. Activated T cells complicate the identification of regulatory T cells in rheumatoid arthritis[J].Cell Immunol,2008,251(2):109-115.
[4]Boissier MC,Assier E,Biton J,Denys A,Falgarone G,Bessis N.Regulatory T cells(Treg)in rheumatoid arthritis[J].Joint Bone Spine,2009,76(1):10-14.
[5]Kato I, Endo-Tanaka K, Yokokura T. Suppressive effects of the oral administration of Lactobacillus casei on typeⅡ collagen-induced arthritis in DBA/1 mice[J].Life Sci,1998,63(8):635-644.
[6]Cush JJ, Lipsky PE. Phenotypic analysis of synovial tissue and peripheral blood lymphocytes isolated from patients with rheumatoid arthritis[J].Arthritis Rheum,1988,31(10):1230-1238.
[7]Raychaudhuri S. Recentadvances in the genetics of rheumatoid arthritis[J].Curr Opin Rheumatol,2010,22(2):109-118.

