塑化劑DEHP與植物雌激素GEN孕期暴露對雄性子代大鼠發育影響
西安交通大學醫學院第二附屬醫院泌尿外科(西安710004)李和程 張連棟 高 明 王 磊 鄧 騫 種 鐵 王子明
環境內分泌干擾物(Environmental endocrine disruptors,EED)暴露對生態環境和人類健康的影響一直是人們關注的焦點。近20余年來,大量文獻報道認為胚胎期或圍出生期環境內分泌干擾物暴露是近50余年來男性精子密度下降以及隱睪、尿道下裂和睪丸腫瘤發病率增高的重要原因[1]。具有抗雄激素作用的鄰苯二甲酸(2-乙基己基)酯(DEHP)暴露對子代有較為確切的生殖毒性。染料木黃酮(GEN)攝入量與人類精子密度負相關,體外試驗證實低劑量GEN可以增強精子頂體反應,對其他環境內分泌干擾物造成的損傷有拮抗作用。本研究通過建立妊娠期大鼠同時暴露于DEHP與GEN動物模型,探討兩者對雄性子代發育是否具有協同亦或是拮抗作用。
材料與方法
1 試劑與儀器 鄰苯二甲酸(2-乙基己基)酯購自天津科密歐化學試劑有限公司;染料木黃酮購自西安陜西慧科植物開發公司;Mettler AG285電子天平(瑞士Mettler-Toledo公司);游標卡尺(杭州錢塘江工具量具有限公司)。
2 實驗動物處置 健康成年SPF級SD雌性大鼠30只(體重200±20g)和雄性15只(體重300±30g)由西安交通大學動物實驗中心提供并飼養,自然晝夜節律采光,室溫18~24℃,飼料不含豆類以及苜蓿(Soy-and alfalfa-free diet,SAFD),自由飲用凈化水。
3 實驗方法 SPF級雌性SD大鼠30只,雄鼠15只,雌性大鼠按2∶1與雄性大鼠同籠交配,次日晨將雌鼠逐一陰道涂片鏡檢,發現精子當日記為孕期零天(GD0)。發現精子后取出雄鼠,雌鼠每籠一只,將所獲30只孕鼠隨機分到以下5組,每組6只。A組為對照組,僅灌胃花生油(2ml/kg);B組為 DEHP(250mg/kg)組;C 組為 DEHP(250mg/kg)+低劑量 GEN(50mg/kg)組;D 組為 DEHP(250mg/kg)+高劑量GEN(400mg/kg)組;E組為高劑量 GEN(400mg/kg)組。在親代雌鼠的孕3d(GD3)至孕20d(GD20),每天按分組方案灌胃。于出生后第1天(Postnatal day 1,PND1)時,計數各組子代雌雄幼鼠活產只數、雌雄比例,對子代雄鼠稱重的稱重同時測量肛門生殖器距離(AGD),計算 AGD/體重1/3,并記錄母鼠體重變化。
4 統計學處理 全部數據采用統計分析軟件SPSS13.0進行處理,計量資料均以均數±標準差(±s)表示,組間比較首先檢驗資料的正態性和方差齊性,多組間比較采用單因素方差分析(One-way ANOVA),組間兩兩比較采用LSD檢驗法,以P<0.05為有顯著性差異,P<0.01為有極顯著性差異。
結 果
1 PND1各組子代大鼠發育情況 見附表。30只雌鼠順利產仔,PND1各組幼鼠每窩活產只數、雌雄比例無顯著性差異。雄性子代大鼠體重C組較A組有顯著性降低(P<0.05),D組較A組有極顯著性差異(P<0.01),D組較B、C、E組均有顯著性降低(P<0.05)。各組AGD/體重1/3無顯著性差異(P>0.05)。
附表 PND1各組子代大鼠指標(±s)
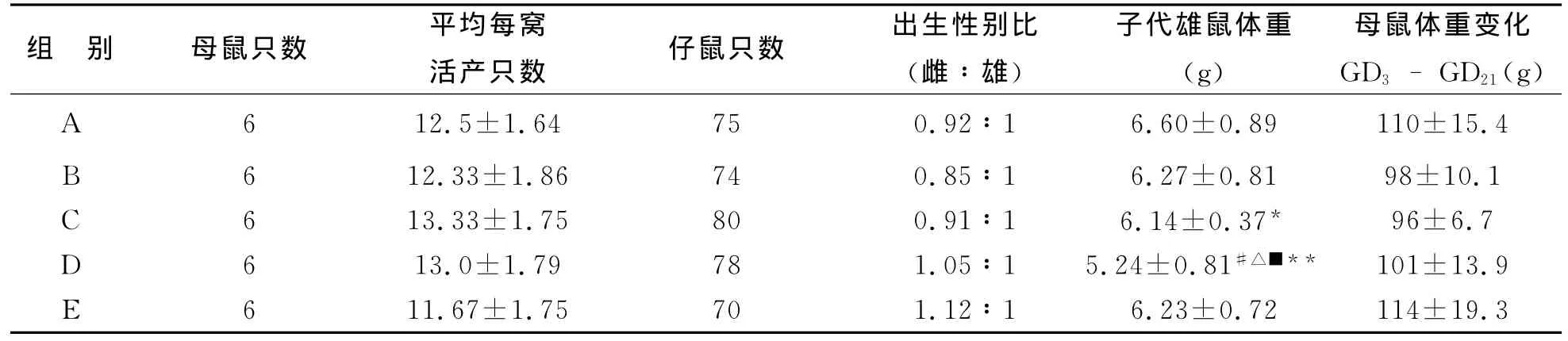
附表 PND1各組子代大鼠指標(±s)
注:* 與A組比較,P<0.05;** 與A組比較,P<0.01;# 與B組比較,P<0.05;△ 與C組比較,P<0.05;■ 與E組比較,P<0.05
組 別 母鼠只數 平均每窩活產只數 仔鼠只數 出生性別比(雌∶雄)子代雄鼠體重(g)母鼠體重變化GD3-GD21(g)A 6 12.5±1.64 75 0.92∶1 6.60±0.89 110±15.4 B 6 12.33±1.86 74 0.85∶1 6.27±0.81 98±10.1 C 6 13.33±1.75 80 0.91∶1 6.14±0.37* 96±6.7 D 6 13.0±1.79 78 1.05∶1 5.24±0.81#△■** 101±13.9 E 6 11.67±1.75 70 1.12∶1 6.23±0.72 114±19.3
2 PND1各組子代雄性大鼠AGD/體重1/3見附圖。于PND1測量各組子代雄鼠體重及肛門生殖器距離,計算 AGD/體重1/3。各組 AGD/體重1/3無顯著性差異(P>0.05),但D組較對照組有下降趨勢。
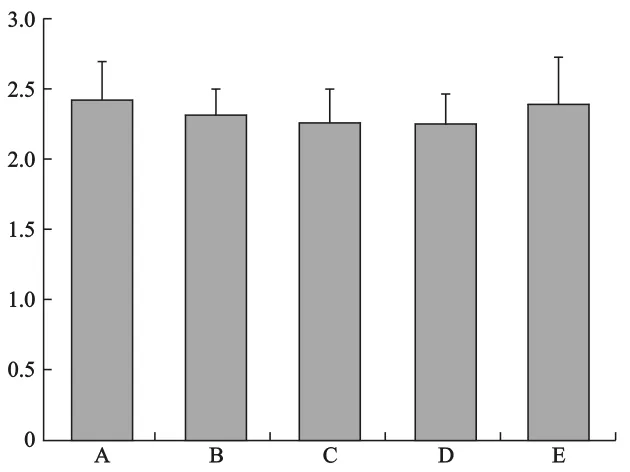
附圖 PND1各組子代雄性大鼠AGD/體重1/3
討 論
人類及動物發育及成熟的關鍵時期,一般包括三個階段:胚胎期及新生兒發育期、青春期前后。胚胎期暴露于內分泌干擾物,由于內分泌干擾物具有可以穿過胎盤的特性(如DEHP等),會對胚胎造成不可逆的損傷,如可以造成雌雄比例改變;性別特征改變,主要表現為AGD及肛門生殖器指數(AGI)減小、乳頭保留、尿道下裂、隱睪和附睪發育不全等[2],而一旦受損則往往會明顯影響到以后的解剖結構、生理功能及行為,且很難逆轉。
以DEHP為代表的鄰苯二甲酸酯類在化學染料、個人護理用品及化妝品(指甲油、防曬霜、發膠、洗發水等)、醫療用品(輸液管、輸血袋等)中均大量存在,該類物質常被用作聚氯乙烯塑料(PVC)的塑化劑,以增強彈性以及柔韌性。該類物質可通過胎盤屏障進入胎兒體內,并可在出生后經乳汁及嬰兒用品進入體內[3,4]。流行病學調查示:臍血MEHP(DEHP代謝產物)水平與懷孕期縮短正相關,間接證據也提示該類物質在圍生期發揮抗雄激素作用,同時母親尿液中DEHP代謝產物的濃度與嬰兒睪丸下降不全以及AGD降低正相關[5,6]。DEHP目前受關注最高,每年消耗量約有200萬噸以上,已成為全球最廣泛的污染物之一。
自2011年5月臺灣爆出“塑化劑風波”,該類物質引起廣泛關注。
植物性雌激素如染料木黃酮(Genistein,GEN)、黃豆苷元(Daidzein,DAI)等,因在食品中廣泛接觸,其對雄性生殖系統的影響亦引起廣泛的關注。有流行病學研究注意到大豆類食品因其含有的主要組分染料木黃酮,其攝入量增加往往出現精子密度下降,同時導致肛門生殖器距離(Anogenital distance,AGD)縮短,睪酮水平下降以及雄性雌性化等,并呈現劑量-效應關系[7,8]。同時有體外實驗證實染料木黃酮低劑量可促進頂體反應以及睪酮分泌,高劑量則是抑制作用[9]。有文獻報道低劑量染料木黃酮(2mg/kg BW)對氯氰菊酯(Cypermethrin)所致新西蘭大白兔精子質量下降有改善作用。
目前對于環境內分泌干擾物的研究,多集中于單種環境內分泌干擾物不同劑量對雄性生殖系統的影響,包括體外及體內試驗。環境內分泌干擾物合用的研究較少。而環境中接觸的環境雌激素并非單一,因而對兩種或多種環境內分泌干擾物合用的研究亦是該領域的一個重點,可以進一步發現環境內分泌干擾物在合用的情況下是否具有協同,疊加亦或是拮抗作用,從而為孕期暴露對雄性子代的生殖毒性提供實驗依據。
本實驗較系統地研究了孕期母鼠暴露于單種及兩種常見內分泌干擾物(DEHP及GEN)對子代雄鼠近期毒性作用。結果發現:孕期單一暴露于DEHP(250mg/kg)及GEN(400mg/kg)并未造成平均每窩活產只數、仔鼠只數、出生時性別比、子代雄鼠體重、AGD/體重1/3較對照組的顯著性變化。說明兩者孕期單一暴露對子代發育、性分化等無顯著影響。但其遠期效應值得進一步觀察,特別是成年后生殖系統發育、生精功能及睪酮水平等。近幾年的研究證實:隱睪、尿道下裂與AGD減低有相關性[10];圍生期母親尿液中PAEs代謝物與所生男嬰AGD減少有關,從而提示圍生期暴露于PAEs有去雄性化效應(Demasculinizing effect)[11]。而AGD/體重1/3作為修正 AGI,可排除體重的影響,具有較高的敏感性,可以更好的反映去雄性化效應。
孕期同時暴露于 DEHP(250mg/kg)及低劑量GEN(50mg/kg),子代雄鼠體重較對照組出現顯著下降,但平均每窩活產只數、仔鼠只數、出生時性別比、母鼠孕期體重變化等指標較對照組的并無顯著性變化,AGD/體重1/3較對照組也未出現顯著性下降。說明在此暴露水平,已對子代雄鼠發育產生一定影響,但其遠期效應,包括睪酮水平,成年后生精功能值得進一步觀察。
孕期同時暴露于 DEHP(250mg/kg)及高劑量GEN(400mg/kg),平均每窩活產只數、仔鼠只數、出生時性別比等指標較對照組的亦無顯著性變化,AGD/體重1/3雖較對照組的亦無顯著性變化,但有下降趨勢,同時子代雄鼠體重較其余四組出現顯著性下降。說明兩者孕期同時暴露,對子代雄鼠發育造成較為明顯的影響,其效應較 DEHP(250mg/kg)及高劑量GEN(400mg/kg)單一暴露亦出現明顯加重的傾向,較DEHP(250mg/kg)與低劑量GEN(50mg/kg)同時暴露更為明顯,提示 DEHP(250mg/kg)及高劑量GEN(400mg/kg)同時暴露存在著協同作用,其遠期效應如成年后睪丸、附睪、前列腺、精囊腺的發育,睪酮水平及睪酮合成相關基因的表達、睪丸下降情況等值得進一步觀察。
本研究完成了不同劑量GEN與DEHP兩種環境內分泌干擾物在孕期暴露對雄性子代系統發育方面研究的空白,為下一步的深入研究奠定了基礎。同時提示小劑量GEN與DEHP同時暴露,雄性化指標有減弱趨勢,大量攝入GEN與DEHP暴露,雄性化指標明顯減弱。同時有必要觀察其遠期效應,進一步明確其生殖毒性,同時有必要從信號轉導途徑進一步闡明機制。另外,由于種屬差異,我們的研究結果仍需要在其他種屬動物中進一步重復進而充分得到驗證;同時,對于環境內分泌干擾物的流行病學調查有必要深入開展,明確人群中暴露情況及對生殖系統影響。通過孕期暴露于兩種常見環境內分泌干擾物的研究,探討了單種和多種內分泌干擾物暴露所致效應的關系,同時為評估孕期暴露于內分泌干擾物的安全性及風險提供了實驗依據,具有一定的理論意義及臨床應用前景。
[1]Casals-Casas C,Desvergne B.Endocrine disruptors:from endocrine to metabolic disruption [J].Annu Rev Physiol,2011,73(2):135-162.
[2]Roy J R,Chakraborty S,Chakraborty T R.Estrogen-like endocrine disrupting chemicals affecting puberty in humans-a review [J].Med Sci Monit,2009,15(6):137-145.
[3]Heudorf U, Mersch-Sundermann V,Angerer J.Phthalates:toxicology and exposure[J].Int J Hyg Environ Health,2007,210(5):623-634.
[4]Kamrin M A.Phthalate risks,phthalate regulation,and public health:a review[J].J Toxicol Environ Health B Crit Rev,2009,12(2):157-174.
[5]Culty M,Thuillier R,Li W,et al.In utero exposure to di-(2-ethylhexyl)phthalate exerts both short-term and long-lasting suppressive effects on testosterone production in the rat[J].Biol Reprod,2008,78(6):1018-1028.
[6]Swan S H,Liu F,Hines M,et al.Prenatal phthalate exposure and reduced masculine play in boys[J].Int J Androl,2010,33(2):259-269.
[7]Ball E R,Caniglia M K,Wilcox J L,et al.Effects of genistein in the maternal diet on reproductive development and spatial learning in male rats[J].Horm Behav,2010,57(3):313-322.
[8]Cederroth C R,Auger J,Zimmermann C,et al.Soy,phyto-oestrogens and male reproductive function:a review [J].Int J Androl,2010,33(2):304-316.
[9]朱鋒榮,王勇剛,陳 潔,等.植物雌激素對體外培養的大鼠睪丸間質細胞分泌睪酮的作用[J].中華男科學雜志,2009,15(3):207-211.
[10]Mh H,Bn B,Ml E,et al.Associations among hypospadias,cryptorchidism,anogenital distance,and endocrine disruption[J].Curr Urol Rep,2008,9(2):137-142.
[11]Lottrup G,Andersson A M,Leffers H,et al.Possible impact of phthalates on infant reproductive health[J].Int J Androl,2006,29(1):172-185.

