RNA干擾抑制HOXA7表達能逆轉白血病U937細胞多藥耐藥
尹寶慧,賈秀紅,李建廠
濱州醫學院附屬醫院兒科,山東 濱州 256603
白血病的發病率在兒童惡性腫瘤中占首位,對其治療主要是以化療為主的綜合治療,但多藥耐藥(multidrug resistance,MDR)常導致化療失敗。MDR是腫瘤細胞對某一化療藥物產生耐藥性后,對其他化學結構及作用機制不同的化療藥物也產生交叉耐藥的現象。凋亡誘導的耐藥是白血病復雜的耐藥機制之一,某些基因過表達通過改變白血病細胞執行程序性死亡的能力或改變細胞凋亡通路而誘導耐藥。研究表明,在白血病發生中,同源盒基因(homeobox gene,HOX)A7過表達能抑制白血病細胞凋亡,且HOXA7過表達與白血病患者對化療的抵抗性有關[1,2]。因此預測,抑制HOXA7過表達有望提高白血病對化療的敏感性,在一定程度上逆轉白血病MDR。RNA干擾(RNA interference,RNAi)是近年來發展起來的能高效、特異性沉默靶基因的技術。本研究運用RNAi抑制白血病U937細胞中HOXA7表達后,檢測U937細胞對化療藥物阿糖胞苷(cytarabine,Ara-C)和高三尖杉酯堿(homoharringtonine,HHT)敏感性的變化,為探討RNAi逆轉白血病MDR提供實驗依據。
1 材料與方法
1.1 主要材料與試劑 人單核細胞白血病細胞株U937由濱州醫學院腫瘤分子生物學重點實驗室提供;RPMI 1640培養液和胎牛血清購自美國Hyclone公司;X-tremeGENE HP DNA轉染試劑購自德國Roche公司;反轉錄試劑盒購自加拿大Fermentas公司;RNAiso Plus總RNA提取試劑和PCR檢測試劑盒購自日本TaKaRa公司;MTT細胞增殖及細胞毒性檢測試劑盒、RIPA裂解液和BCA蛋白濃度測定試劑盒購自碧云天生物技術研究所;細胞凋亡檢測試劑盒購自南京凱基生物科技發展有限公司;兔抗人β-actin多克隆抗體購自南京巴傲得生物科技有限公司;辣根過氧化物酶標記山羊抗兔IgG購自北京中杉金橋生物技術有限公司;兔抗人HOXA7多克隆抗體購自武漢博士德生物工程有限公司;HOXA7和內參β-actin引物由上海賽百盛基因技術有限公司合成;靶向HOXA7基因的特異性小發夾RNA(small hair RNA,shRNA)及陰性對照RNA和空載體質粒pGPU6/GFP/Neo均由上海吉瑪制藥技術有限公司設計合成或提供;注射用Ara-C購自哈爾濱博萊制藥有限公司;注射用HHT購自北京協和藥廠;其余試劑均為國產分析純。
1.2 U937細胞培養 人白血病細胞株U937在含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL鏈霉素雙抗的完全培養液中,置于37 ℃、CO2體積分數為5%的培養箱中培養。根據細胞生長狀況,2~3 d傳代一次,取對數生長期細胞進行后續實驗。
1.3 U937細胞轉染及分組 本課題前期實驗中根據HOXA7基因序列,設計并合成3對靶向HOXA7基因的特異性shRNA,并篩選出對HOXA7表達抑制效率最佳的1對shRNA(引物序列:正義鏈5’-CCTCCTACGACCAAAACAT-3’,反義鏈5’-ATGTTTTGGTCGTAGGAGG-3’),由此shRNA序列設計并合成靶向HOXA7基因的特異性真核表達載體pGPU6/GFP/Neo-shHOXA7;同時設計并合成陰性對照載體pGPU6/GFP/Neo-shNC,作為陰性對照。轉染前取對數生長期U937細胞,用含10%胎牛血清的RPMI 1640培養液懸浮后,以6×105個/孔的細胞密度接種于6孔板。根據X-tremeGENE HP DNA轉染試劑說明書,優化轉染條件。pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC分別用不含抗生素和血清的RPMI 1640培養液稀釋,混勻后取X-tremeGENE HP DNA轉染試劑加入到稀釋好的重組載體中,混勻后室溫孵育30 min,小心將混合物加到U937細胞中,置于37 ℃、CO2體積分數為5%的培養箱中繼續培養。轉染24 h后加G418(800 μg/mL)進行陽性細胞篩選,4周后用G418(400 μg/mL)維持培養,得到穩定表達pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC的U937細胞。實驗重復3次。后續實驗分3組:實驗組(穩定表達pGPU6/GFP/Neo-shHOXA7的U937細胞)、陰性對照組(穩定表達pGPU6/GFP/Neo-shNC的U937細胞)和空白對照組(未轉染的U937細胞),即收集以上3組細胞進行后續實驗。
1.4 RT-PCR檢測各組細胞中HOXA7 mRNA表達情況 分別收集各組細胞,運用RNAiso Plus提取細胞總RNA,測定RNA純度及濃度。兩步法進行RT-PCR檢測HOXA7 mRNA的表達情況。所用引物序列如下:HOXA7正義鏈為5’-ACCGACACTGAAAGCTGCCG-3’,反義鏈為 5’-AGGTCCTGAAGACCGCATCC-3’,擴增產物長度為410 bp;β-actin正義鏈為5’-CTCCATCCTGGCCTCGCTGT-3’,反義鏈為 5’-GCTGTCACCTTCACCGTTCC-3’,擴增產物長度為268 bp。按下列條件進行RTPCR擴增:95 ℃預變性5 min;95 ℃變性30 s,55 ℃退火45 s,72 ℃延伸30 s,共進行35個循環;最后72 ℃延伸10 min。實驗獨立重復3次。PCR產物經1%瓊脂糖凝膠電泳鑒定,采用Tanon Gel凝膠圖像分析軟件,在mRNA水平計算各組細胞中HOXA7的相對表達量。HOXA7 mRNA相對水平=HOXA7灰度值/β-actin灰度值×100%。
1.5 蛋白質印跡法檢測各組細胞中HOXA7蛋白表達情況 分別收集各組細胞,應用RIPA+PMSF裂解液抽提細胞總蛋白,BCA法檢測蛋白質濃度。蛋白與5×SDS-PAGE上樣緩沖液混合(體積比為5:1)后,95 ℃煮樣10 min,取40 μg蛋白進行10%SDS-PAGE分離,然后將蛋白電轉移至硝酸纖維素膜上,加入含7%脫脂奶粉的TBST封閉液并置于搖床上封閉2.5 h。加入兔抗人HOXA7多克隆抗體(稀釋比例為1:100),4 ℃搖床過夜,經TBST充分漂洗(10 min/次,共洗3次),再加辣根過氧化酶標記的山羊抗兔二抗(稀釋比例為1:5000),室溫搖床上放置2 h后洗膜,化學發光法顯色。用兔抗人β-actin多克隆抗體(稀釋比例為1:3000)作為內參。實驗獨立重復3次。采用Chemiscope軟件分析圖像,在蛋白質水平計算各組細胞中HOXA7的相對表達量。HOXA7蛋白相對表達量=HOXA7灰度值/β-actin灰度值×100%。
1.6 MTT法檢測各組細胞對Ara-C和HHT的敏感性 取對數生長期的各組細胞,以3×104個/孔的細胞密度接種于96孔板上,調整培養液終體積為200μL。分別將不同濃度的Ara-C(終質量濃度分別為 0、0.1、1、10、100和 1000 μg/mL)和HHT(終質量濃度分別為0、0.05、0.5、5、50和500 μg/mL)加入各組細胞培養液中,每組設3個平行孔。加藥48 h后,每孔加入MTT 20μL(5 mg/mL),繼續置于 37 ℃、CO2體積分數為5%的培養箱中培養4 h,離心并小心吸出孔中培養液,加入DMSO 150μL/孔,搖床上避光振蕩15~20 min。酶標儀檢測各孔在560 nm處的吸光度(D560)值,分別計算Ara-C和HHT對各組細胞的半數抑制濃度(half-inhibitory concentration,IC50)。實驗獨立重復3次。
1.7 FITC-PI標記的FCM法檢測各組細胞的凋亡情況 取對數生長期的各組細胞,以6×105個/孔的細胞密度接種于6孔板,調整培養液終體積為1.5 mL。每組中再設未加藥組(加等量完全培養液)、Ara-C組(終質量濃度為10 μg/mL)和HHT組(終質量濃度為0.5 μg/mL),加藥48 h后離心收集細胞(2000 r/min離心5 min),PBS洗滌細胞 2次(2000 r/min離心5 min),再加入500μL Binding Buffer懸浮細胞,然后加AnnexinⅤ-FITC和碘化丙啶(propidium iodide,PI)各5μL,室溫避光反應15 min后,上流式細胞儀檢測各組細胞的凋亡率。實驗獨立重復3次。
1.8 統計學方法 采用SPSS 13.0統計學軟件進行數據處理。結果數據以表示,多組間比較采用單因素方差分析,多組間兩兩比較采用LSD檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 熒光顯微鏡下觀察各組細胞的轉染效率 經G418穩定篩選后,熒光顯微鏡下觀察各組細胞。因重組質粒載體pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC均帶有綠色熒光蛋白(green fluorescent protein,GFP)基因,因此如預期,觀察發現實驗組和陰性對照組細胞均有綠色熒光,轉染效率在70%以上,而空白對照組細胞未見綠色熒光(圖1)。
2.2 pGPU6/GFP/Neo-shHOXA7轉 染 能 有 效抑制HOXA7 mRNA和蛋白的表達 RT-PCR檢測各組細胞中HOXA7 mRNA的相對水平分別如下:實驗組(23.910±1.662)%,陰性對照組(81.579±0.310)%,空白對照組(82.232±0.511)%。實驗組明顯低于陰性對照組和空白對照組(P<0.05),而陰性對照組和空白對照組細胞中HOXA7 mRNA相對水平無明顯差異(P>0.05,圖 2A)。
蛋白質印跡法檢測各組細胞中HOXA7蛋白的相對表達量,結果顯示:實驗組HOXA7蛋白相對表達量為(25.980±1.651)%,明顯低于陰性對照組的(72.885±0.762)%和空白對照組的(73.669±1.066)%,差異均有統計學意義(P<0.01);而陰性對照組和空白對照組細胞中HOXA7蛋白相對表達量比較的差異無統計學意義(P>0.05,圖2B)。
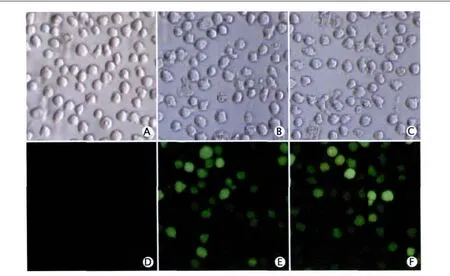
Fig.1 The leukemia U937 cells after different transfections were selected by G418 and observed under a light microscope(A-C) and a fluorescence microscope (D-F) (×200).A and D: U937 cells without transfection as a blank control group;B and E: U937 cells transfected with pGPU6/GFP/Neo-shNC (a negative control small-hair RNA) vector as a negative control group; C and F: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 (a small-hair RNA targeting HOXA7 gene) vector as a experimental group.The results showed that GFP (green fluorescent protein) displaying green fuorescence in U937 cells after transfection with pGPU6/GFP/Neo-shNC and pGPU6/GFP/Neo-shHOXA7, and the transfection efficiencies of the two groups were more than 70%.圖1 顯微鏡下觀察經G418穩定篩選后各組白血病U937細胞的轉染效率
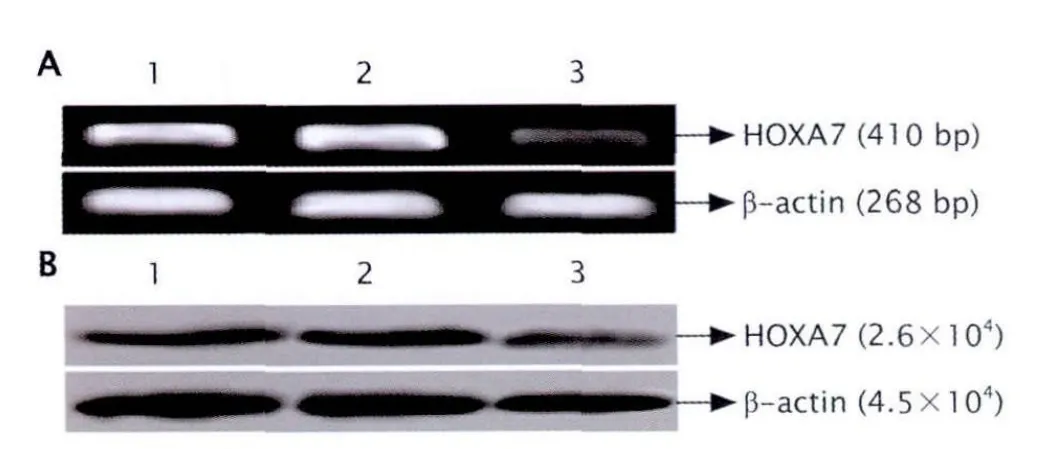
Fig.2 The expressions of HOXA7 mRNA and protein in U937 cells transfected with shHOXA7 (small-hair-RNA targeting HOXA7 gene) were detected by RT-PCR (A)and Western blotting (B), respectively.1: Blank control group (U937 cells without transfection); 2: Negative control group (U937 cells transfected with pGPU6/GFP/Neo-shNC vector); 3: Experimental group (U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector).The results showed that both HOXA7 mRNA and protein expressions were significantly decreased in the U937 cells transfected with shHOXA7 (P<0.05, P<0.01, n=3).圖2 RT-PCR和蛋白質印跡法檢測穩定轉染HOXA7基因特異性shRNA的U937細胞中HOXA7 mRNA和蛋
以上結果提示,穩定轉染含有HOXA7基因特異性shRNA的重組表達質粒pGPU6/GFP/Neo-shHOXA7的U937細胞系構建成功,該載體能在mRNA和蛋白水平有效抑制HOXA7基因的表達,而陰性對照質粒pGPU6/GFP/NeoshNC不能抑制HOXA7表達。因此,選取實驗組細胞進行后續實驗。
2.3 MTT法檢測RNAi抑制HOXA7表達后細胞對Ara-C和HHT的敏感性變化 MTT結果(圖3)顯示:在不同濃度的Ara-C和HHT作用下,實驗組、陰性對照組和空白對照組的細胞增殖均受到抑制,且隨著藥物濃度增加,細胞增殖抑制率增加;相同藥物濃度下,實驗組細胞增殖抑制率高于2個對照組;實驗組中Ara-C的IC50為(3.063±0.570)μg/mL,明顯低于陰性對照組的(10.863±0.740)μg/mL和空白對照組的(11.282±1.733)μg/mL(P< 0.05),而后兩組比較的差異無統計學意義(P>0.05);實驗組中HHT的IC50為(0.059±0.031)μg/mL,明顯低于陰性對照組的(0.514±0.035)μg/mL和空白對照組的(0.564±0.098)μg/mL(P<0.05),而后兩組比較的差異無統計學意義(P>0.05);實驗組Ara-C和HHT的IC50與對照組相比,分別降低了3.5倍和8.5倍。以上結果表明,RNAi抑制HOXA7表達后,實驗組細胞對Ara-C和HHT的敏感性明顯增加。
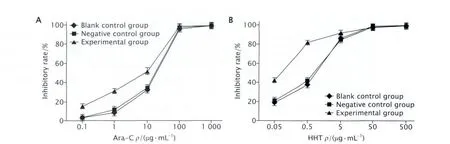
Fig.3 The inhibitory effects of Ara-C (cytarabine, in Fig.3A) and HHT (homoharringtonine, in Fig.3B) on the proliferation of U937 cells transfected with shHOXA7 (small-hair RNA targeting HOXA7 gene) were detected by MTT method.Blank control group: U937 cells without transfection; Negative control group: U937 cells transfected with pGPU6/GFP/Neo-shNC vector; Experimental group: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector.The results showed that the inhibition effect of cellular proliferation in each group after treatment with Ara-C or HHT was gradually enhanced in a dose-dependent manner.The inhibition rate of the U937 cells transfected with shHOXA7 was significantly higher than that of the control cells exposed to the same concentration of Ara-C or HHT (P<0.05, n=3).圖3 MTT法檢測HOXA7基因特異性shRNA轉染后U937細胞對Ara-C和HHT的敏感性變化
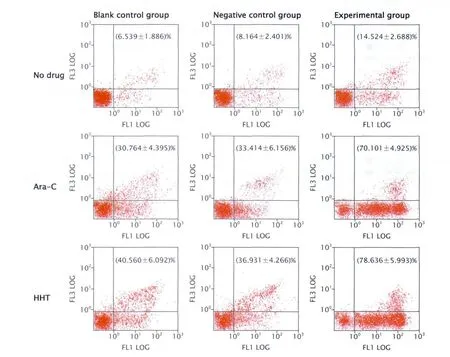
Fig.4 The apoptosis of U937 cells transfected with shHOXA7 (small-hair RNA targeting HOXA7 gene) after treatment with Ara-C (cytarabine) or HHT (homoharringtonine) was detected by FCM (flow cytometry).Blank control group:U937 cells without transfection; Negative control group: U937 cells transfected with pGPU6/GFP/Neo-shNC vector;Experimental group: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector.The results showed that Ara-C or HHT could induce the apoptosis of U937 cells transfected with shHOXA7, as compared with those in the blank control and the negative control groups (P<0.05,n =3).圖4 FCM法檢測HOXA7基因特異性shRNA轉染后U937細胞在Ara-C或HHT作用下的凋亡情況
2.4 FCM法檢測RNAi抑制HOXA7表達后細胞的凋亡情況 FCM法檢測結果(圖4)顯示:未加化療藥物時,實驗組細胞凋亡率與陰性對照組和空白對照組相比,差異均有統計學意義(P<0.05),而后兩組比較無明顯差異(P>0.05),表明RNAi抑制HOXA7表達能在一定程度上促進U937細胞凋亡;加化療藥物Ara-C和HHT作用后,實驗組細胞凋亡率明顯高于陰性對照組和空白對照組(P<0.05),后兩組比較差異無統計學意義(P>0.05)。以上結果說明,RNAi抑制HOXA7表達后,能在一定程度上促進U937細胞凋亡,且能增強Ara-C和HHT對U937細胞的凋亡誘導作用。
3 討 論
HOX基因在控制胚胎發育和造血細胞增殖、分化過程中發揮了重要的調控作用,其異常表達與腫瘤發生、發展及預后密切相關。Gaspar等[3]在兒童高分化神經膠質瘤研究中發現,HOX基因高表達與患者預后差有關,且其高表達可作為患者對替莫唑胺耐藥的有效預測指標。HOXA7是HOX基因家族中的重要一員,其異常表達與白血病的關系近年來受到廣泛關注。白血病致病相關基因MLL和NUP98等可與多種易位基因形成融合蛋白,通過上調HOXA7基因表達,從而導致白血病的發生。在慢性粒細胞白血病急淋變過程中,白血病細胞惡性克隆常伴有HOXA7基因的異常高表達,說明其作為原癌基因在白血病發生和發展過程中發揮了重要作用。另外,HOXA7異常表達與白血病的治療和預后也密切相關。Drabkin等[1]研究證明,HOXA7過表達與急性骨髓性白血病患者對化療的反應差及預后不佳有關。Afonja等[4]研究發現,HOXA7高表達的白血病患者表現為對化療藥物誘導凋亡的抵抗增強,而HOXA7低表達或無表達的患者對化療藥物反應好,提示HOXA7高表達在白血病MDR中發揮了重要作用。
有關HOXA7高表達導致白血病MDR的機制,目前國內外研究較少。許多化療藥物通過誘導白血病細胞凋亡達到治療目的,而細胞周期相關基因p53等異常表達能通過改變細胞凋亡通路,拮抗外來信號誘導細胞凋亡作用,從而誘導耐藥,這種凋亡誘導的耐藥是白血病MDR的重要機制之一[5]。有研究表明,HOXA7能調控細胞周期相關基因p53的表達,提示HOXA7高表達可能通過抑制白血病細胞凋亡,從而誘導耐藥[6]。因此,抑制HOXA7高表達有望通過促進白血病細胞凋亡,提高白血病對化療藥物的敏感性,最終逆轉MDR。但有關該方面的研究,目前國內外尚無相關報道。
目前,逆轉白血病MDR的方法主要有以下2類:(1)經典的MDR逆轉劑,即針對MDR發生環節的特異性逆轉藥物,如鈣離子通道阻滯劑、鈣調蛋白抑制劑、免疫調節劑、激素類化合物、谷胱甘肽轉移酶和拓撲異構酶Ⅱ抑制劑等;(2)以生物治療劑作為逆轉劑,如某些細胞因子、單克隆抗體、核酶、中藥制劑、反義寡核苷酸和小干擾RNA為基礎的RNAi,其中RNAi沉默靶基因具有特異性高、操作簡單、快速和無毒等優點[7],是目前國內外最先進的抑制靶基因表達的方法。因此,基于RNAi的新型逆轉白血病MDR的治療手段是目前白血病治療的熱點。Rumpold等[8]運用RNAi技術抑制白血病MDR相關基因P-gp表達后,發現慢性粒細胞白血病細胞株恢復了對化療藥物甲磺酸伊馬替尼和多柔比星的敏感性。Zhou等[9]研究發現,在多柔比星誘導的白血病MDR細胞株K562/A02和白血病患者中均存在sorcin高表達,靶向sorcin的小干擾RNA通過抑制sorcin表達,逆轉白血病MDR。本課題組前期實驗證明,RNAi抑制HOXA9表達后能增強U937細胞對長春新堿和柔紅霉素的敏感性[10],逆轉白血病MDR。以上研究結果表明,RNAi可通過抑制白血病MDR相關基因表達來逆轉白血病MDR。
本研究將前期構建的靶向HOXA7基因的特異性真核表達載體pGPU6/GFP/Neo-shHOXA7穩定轉染至U937細胞,RT-PCR和蛋白質印跡法分別鑒定該載體對HOXA7表達的抑制作用,結果顯示:實驗組細胞中HOXA7在mRNA和蛋白水平的相對表達量均明顯低于陰性對照組和空白對照組,表明穩定表達pGPU6/GFP/NeoshHOXA7的U937細胞系構建成功,該載體在mRNA和蛋白水平均能有效抑制HOXA7表達。在此基礎上,本研究運用MTT法檢測各組細胞對Ara-C和HHT的敏感性變化,結果顯示:實驗組RNAi抑制HOXA7表達后,細胞對化療藥物的敏感性明顯提高,實驗組Ara-C和HHT的IC50與對照組相比,分別降低了3.5倍和8.5倍,這說明RNAi抑制HOXA7表達后能增強U937細胞對化療藥物的敏感性。Orlovsky等[11]在NOD/SCID小鼠中研究發現,抑制HOXA7表達能阻礙白血病細胞在骨髓中的植入,并抑制白血病細胞在小鼠體內的增殖。本研究也發現,相同濃度的Ara-C和HHT作用時,實驗組細胞增殖抑制率高于對照組,說明RNAi抑制HOXA7表達能抑制白血病細胞增殖,這與Orlovsky等[11]的研究結論相同。本研究還運用FCM法檢測各組細胞凋亡情況,結果顯示:未加化療藥物時,實驗組細胞出現一定程度的凋亡,加入化療藥物Ara-C或HHT后,實驗組細胞因RNAi抑制了HOXA7的表達,其凋亡率明顯高于陰性對照組和空白對照組,該結果說明RNAi抑制HOXA7表達后能通過促進U937凋亡或增強化療藥物對U937細胞的誘導凋亡作用,逆轉U937細胞MDR。
綜上所述,HOXA7高表達與白血病MDR密切相關,本研究構建的穩定表達pGPU6/GFP/Neo-shHOXA7的U937細胞能有效抑制HOXA7表達;在此基礎上,RNAi抑制HOXA7表達后能通過增強化療藥物Ara-C和HHT對U937細胞的增殖抑制及凋亡誘導作用,在一定程度上逆轉白血病MDR。因此,提示RNAi抑制HOXA7表達有望成為逆轉白血病MDR的新方法。
[1]DRABKIN H A, PARSY C, FERGUSON K, et al.Quantitative HOX expression in chromosomally defined subsets of acute myelogenous leukemia[J].Leukemia, 2002, 16(2):186-195.
[2]WANG G G, CAI L, PASILLAS M P, et al.NUP98-NSD1 links H3K36 methylation to Hox-A gene activation and leukaemogenesis[J].Nat Cell Biol,2007, 9(7):804-812.
[3]GASPAR N, MARSHALL L, PERRYMAN L, et al.MGMT-independent temozolomide resistance in pediatric glioblastoma cells associated with a PI3-kinase-mediated HOX/stem cell gene signature[J].Cancer Res, 2010, 70(22):9243-9252.
[4]AFONJA O, SMITH JE J R, CHENG D M, et al.MEIS1 and HOXA7 genes in human acute myeloid leukemia[J].Leuk Res, 2000, 24(10):849-855.
[5]CAVALCANTI G B Jr, VASCONCELOS F C, PINTO de FARIA G,et al.Coexpression of p53 protein and MDR functional phenotype in leukemias : the predominant association in chronic myeloid leukemia[J].Cytometry B Clin Cytom, 2004, 61(1):1-8.
[6]MISHRA B P, ANSARI K I, MANDAL S S.Dynamic association of MLL1, H3K4 trimethylation with chromatin and Hox gene expression during the cell cycle[J].FEBS J, 2009, 276(6):1629-1640.
[7]OLIVIERI D, SYKORA M M, SACHIDANANDAM R,et al.An in vivo RNAi assay identifies major genetic and cellular requirements for primary piRNA biogenesis in Drosophila[J].EMBO J, 2010,29(19):3301-3317.
[8]RUMPOLD H, WOLF A M, GRUENEWALD K, et al.RNAi-mediated knockdown of P-glycoprotein using a transposon-based vector system durably restores imatinib sensitivity in imatinibresistant CML cell lines[J].Exp Hematol, 2005,33(7):767-775.
[9]ZHOU Y, XU Y, TAN Y, et al.Sorcin, an important gene associated with multidrug-resistance in human leukemia cells[J].Leuk Res, 2006,30(4):469-476.
[10]朱立平, 賈秀紅, 李建廠.靶向HOXA9基因RNAi慢病毒載體增加人急性單核細胞白血病U937細胞的藥物敏感性[J].腫瘤, 2013, 33(1):21-27.
[11]ORLOVSKY K, KALINKOVICH A, ROZOVSKAIA T,et al.Down-regulation of homeobox genes MEIS1 and HOXA in MLL-rearranged acute leukemia impairs engraftment and reduces proliferation[J].Proc Natl Acad Sci U S A, 2011,108(19):7956-7961.