苜蓿黃酮提取富集工藝的研究
孫海峰,賈秀娟
(黑龍江中醫藥大學,黑龍江 哈爾濱 150040)
紫花苜蓿(Medicago sativa L.)簡稱苜蓿,為1年生或多年生的草本植物,屬豆科草類,國內外均有分布,是草原地帶栗鈣土和暗栗鈣土的典型植物[1]。《本草綱目》謂其能“安中利人,可久食。利五臟,輕身健體,洗去脾胃間邪熱之氣,通小腸諸惡熱毒”[2]。苜蓿黃酮類化合物是一種天然的抗氧化劑,具有多種生物活性。在抗衰老、抗菌、抗病毒、抗癌、抗腫瘤、護肝、抑制高血壓、高血脂、調節內分泌系統、增強機體免疫力、預防心血管疾病及止痛鎮痛等方面都具有良好的作用[4-6]。隨著人們醫療保健意識的增強,具有多功能的苜蓿黃酮有廣闊應用前景,但目前苜蓿黃酮提取工藝落后,因此,本研究采用均勻設計法安排實驗,優化苜蓿總黃酮提取富集工藝,為苜蓿黃酮開發利用奠定基礎。
1 儀器與試劑
1.1 儀器
SP-722E型可見分光光度計(上海光譜儀器有限公司);FA1004N型電子天平(上海精密科學儀器有限公司);旋轉蒸發儀(上海亞榮生化儀器廠);電熱套(天津市泰斯特儀器有限公司);恒溫水浴箱(江蘇金壇市醫療儀器廠);植物微型粉碎機(天津泰斯特儀器有限公司);K-Q500E型醫用超聲清洗儀器(昆山市超聲儀器有限公司)。
1.2 試劑
蘆丁對照品(成都思科華生物技術有限公司,純度98%);亞硝酸鈉(分析純,天津市化學試劑六廠三分廠);硝酸鋁(分析純,天津市科密歐化學試劑有限公司);氫氧化鈉(分析純,天津市恒興化學試劑制造有限公司);95%乙醇(分析純,北京化工廠);AB-8,HPD-600,D101 大孔樹脂(南開大學化工廠)。
2 方法與結果
2.1 黃酮的含量測定
2.1.1 最大吸收波長的確定
對照品溶液與供試品溶液在200~700nm處進行掃描,發現在265nm或357nm附近有最大吸收峰,且357nm最穩定可靠,因此實驗中選擇該波長。
2.1.2 標準曲線制備
取蘆丁對照品溶液 0、1、2、3、4、5ml,分別置 10ml容量瓶中,加 5%亞硝酸鈉溶液 0.3ml,搖勻,放置6min,加 10%硝酸鋁溶液 0.3ml,搖勻,放置 6min,加1mol/l氫氧化鈉4.0ml,用甲醇稀釋至刻度,搖勻,放置15min后于選定的測定波長處測吸光度,以濃度C為縱坐標,吸光度值A為橫坐標進行線性回歸,得方程。標準曲線 Y=12.997X-0.0054,R=0.9997。
2.1.3 供試品溶液的制備
取苜蓿10g,精密稱量,置圓底燒瓶中,加入乙醇120ml,回流提取1h,共2次,過濾,冷卻后取部分溶液離心5min,取藥液0.5ml置10mL容量瓶中,加70%乙醇稀釋至刻度。
2.1.4 精密度實驗
取蘆丁對照品溶液(0.1mg/ml)適量,連續測定6次,RSD為=0.47%,表明精密度良好。
2.1.5 穩定性實驗
取供試品溶液,分別于 0、10、30、60、90、120min 測定,RSD為1.00%,表明穩定性良好。
2.1.6 重復性實驗
分別取同一批次的苜蓿提取物,平行取樣6份,制成供試品溶液,依法測定,RSD為1.04%,表明重現性好。
2.1.7 加樣回收實驗
精密稱取已知含量的藥材粉末6份,每份約50mg分別加入一定的蘆丁對照品溶液,按供試品溶液制備項下操作制備樣品溶液,與510nm處測定吸收率,計算回收率為98.91%,RSD為1.74%。
2.2 提取方法的考察
稱取10g苜蓿粉末3份,加入120ml 70%的乙醇,分別用加熱回流萃取、冷浸提取、超聲萃取的方法提取2次,每次1h,冷卻后取部分溶液離心5min,再取0.5ml稀釋到10ml測吸光度,回流提取制備液吸光度值最大,結果表明,回流提取方法最好。
2.3 提取工藝的優化
采用均勻設計法,按U6(63)選用固液比(A),乙醇濃度(B),提取時間(C)三個因素,每個因素6個水平,共進行6個處理,每個處理重復3次,每份10g。從節省原料的角度考慮選擇70%的乙醇。見表1、表2。
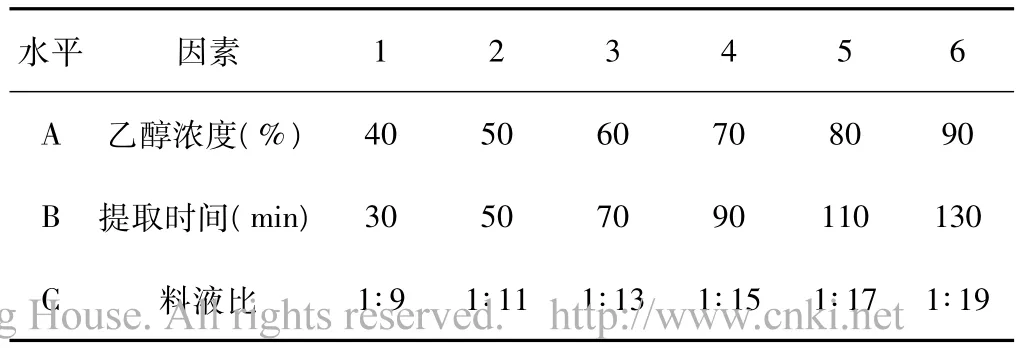
表1 提取因素水平表
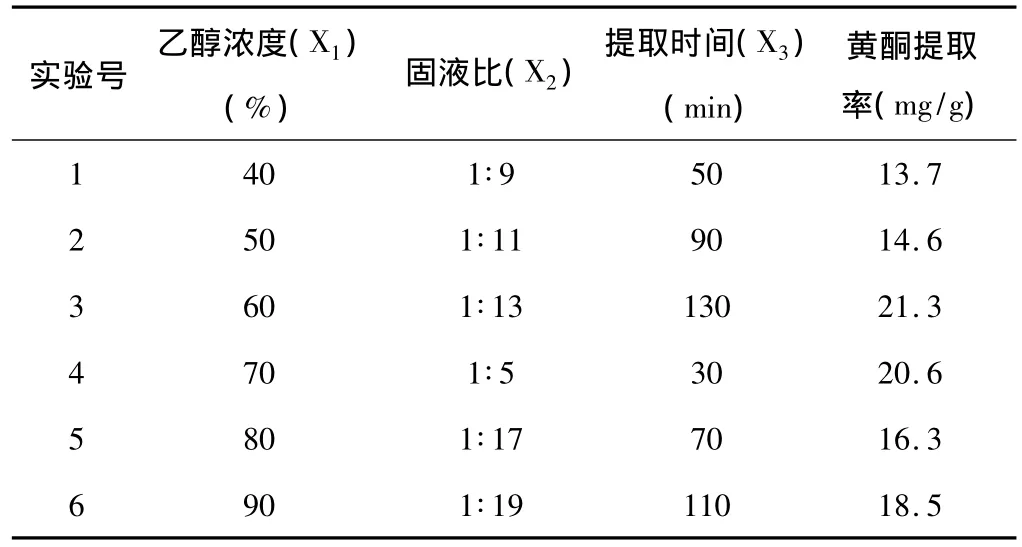
表2 均勻實驗結果 (n=3)
經多元回歸分析得回歸方程:Y=37.0523-0.9449X1+0.0030X2×X2-0.0072X1×X2+0.0592X1×X3。
經檢驗,復相關系數 R=0.9998;F=4000.9,F>F0.1(4.1),表明方程顯著,黃酮提取率和各因素間有很好的線性關系。對方程進行優化求極大值,在檢驗精度 α=0.05 條件下,得出優化參數 X1=71.0、X2=128.1、X3=19。即醇濃度 71%料液質量比為1∶19,提取時間128min,此時提取率預測值為34.2mg/g。經實驗測定能達到這個預測值,表明所優化的條件為最優水平。
2.4 大孔吸附樹脂富集工藝條件優化
2.4.1 上樣方法考察
分別采用干法和濕法上樣,樹脂選用D101,干法上樣取大孔樹脂20g,精密稱70%乙醇提取物1.0g,拌入10g樹脂中,揮干溶劑,干法加樣于裝好的樹脂柱中,依次用6BV蒸餾水,10BV 95%乙醇洗脫,控制流速為1ml/min,收集水和乙醇洗脫液,回收溶劑至干。濕法上樣取預處理好的D101 大孔樹脂30g,裝柱待用。精密稱取醇提物1g,用10mL蒸餾水超聲加熱溶解,加樣于裝好的樹脂柱中,飽和24h,其它條件同干法上樣。測定大孔樹脂D101對總黃酮的比吸附率和解吸率。結果見表3。
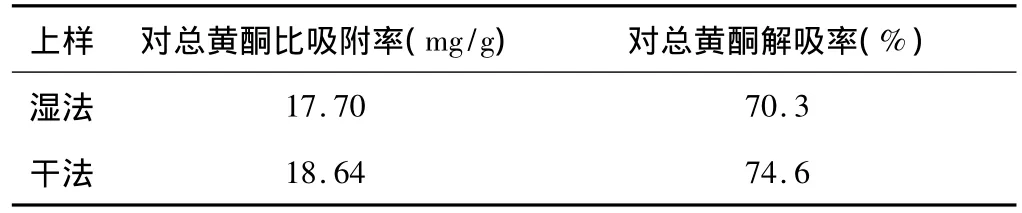
表3 上樣方法的考察
結果表明干法上樣優于濕法上樣。
2.4.2 樹脂型號考察
取處理好的 AB-8(弱極性),D101(非極性),HPD(極性)三種型號大孔樹脂各20g,采用2.4.1 干法上樣法,測定總黃酮含量,計算樹脂的比吸附率和解吸率。結果見表4。

表4 樹脂型號考察結果
結果表明,D101 樹脂比吸附率(18.6mg/g)和解吸率(74.6%)較高,因而選擇D101 樹脂。
2.4.3 最佳拌樣比
將預處理好的大孔樹脂各15g裝于四根徑高比一致的柱子中待用,按樹脂(g):生藥量(g)為1∶0.4,1∶0.7,1∶1,1∶1.5 的比例依次稱取 4 份,采用 2.4.1干法上樣法,測定各組有效成分的含量。結果見表5。
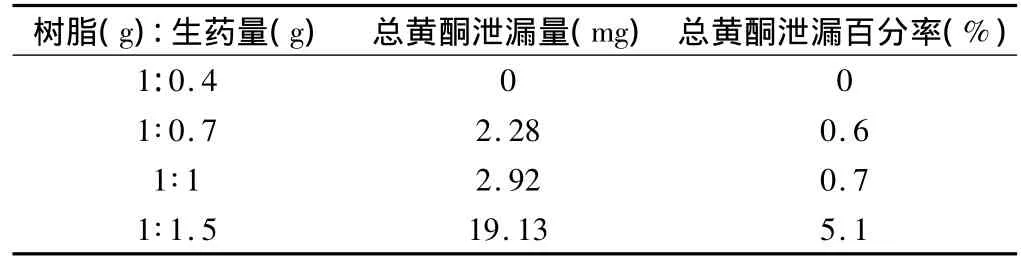
表5 最佳拌樣比結果
結果表明,最佳拌樣比1∶1 時總黃酮泄漏量較小,效果好。
2.4.4 上樣量考察
取預處理好的樹脂10g,15g,20g,25g分別裝于四根徑高比一致的柱子中,采用2.4.1 干法上樣法,測定總黃酮泄漏量和總黃酮泄漏百分率。結果見表6。

表6 上樣量考察結果
上樣量考察結果表明,1∶20 時總黃酮泄漏量小,效果較佳。
2.4.5 水洗脫體積考察
取預處理好的D101 大孔樹脂20g裝柱待用,采用2.4.1 干法上樣法,用蒸餾水洗脫,每BV(30ml)為一個考察單位,控制流速為1ml/min,各自收集洗脫液,檢測有效成分泄漏量。結果見表7。
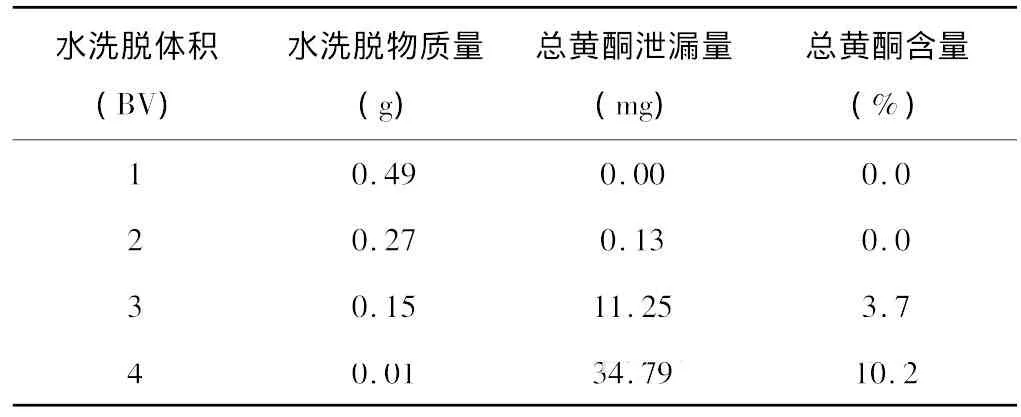
表7 水洗脫體積考察
結果表明,在節約資源的前提下,2倍水洗脫體積泄漏量較低,總黃酮含量最高,因此,選擇2倍水體積。
2.4.6 乙醇洗脫濃度的考察
精密稱取提取物1.0g,采用2.4.1 干法上樣法,分別用30%,50%70%,95%的乙醇洗脫,測定所得干膏中黃酮含量,有效成分解析率。結果見表8。

表8 乙醇洗脫濃度考察結果
結果表明,70%乙醇洗脫總黃酮含量、解析率最高,因此,70%乙醇洗脫效果最佳。
2.4.7 乙醇洗脫體積的考察
取處理好的大孔吸附樹脂,采用2.4.1 干法上樣法,用70%乙醇洗脫,每1BV為一個考察單位,收集4份,回收溶劑至干,稱重,測定干膏中總黃酮的含量和總黃酮累計轉移率。結果見表9。
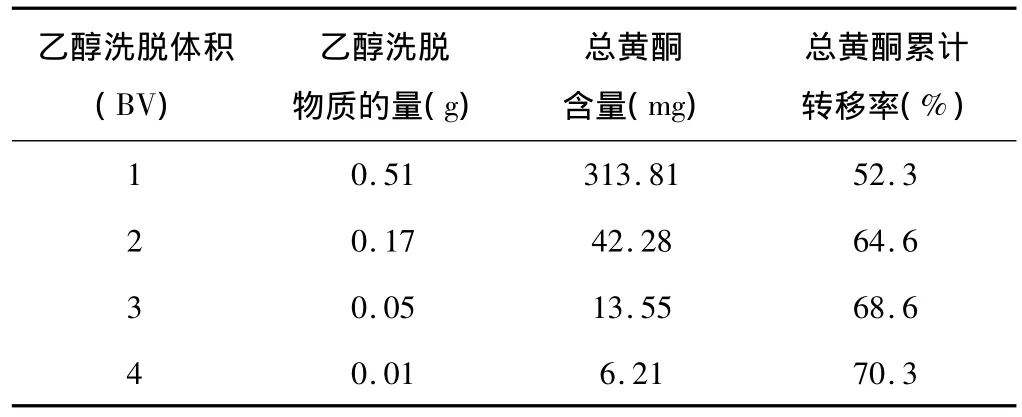
表9 乙醇洗脫體積考查
結果表明,本著節約原則3倍乙醇洗脫總黃酮含量累積較高,轉移率68.6%,因此,3倍乙醇洗脫體積最優。
2.4.8 洗脫流速考察
取處理好的大孔吸附樹脂20g 4份,分別裝于相同規格的四根柱中,采用2.4.1 干法上樣法,分別用3BV 的水洗脫,然后分別以 1、2、3、4 ml/min流速,用70%乙醇洗脫,測定得到干膏中總黃酮的含量,計算總黃酮轉移率,分別為 82.4%、84.6%、79.7%、71.0%。結果表明,總黃酮轉移率在流速控制在2ml/min,由洗脫流速和樹脂柱截面積的關系得出,洗脫流速為0.325ml/cm2/min總黃酮轉移率最高。
3 討論
目前,對苜蓿黃酮的提取有冷浸提取、微波提取和超聲提取法,但提取率不高。如張詠梅[6]的微波提取苜蓿黃酮的最佳工藝為:40%乙醇濃度,1∶30 固液比,微波500w功率下作用60s;在此工藝條件下,黃酮提取量的理論值為 4.92mg/g,接近于實際測定值4.88mg/g。朱宇[7]的苜蓿黃酮最佳提取條件為乙醇濃度60%,料液比1∶35,提取溫度50℃,提取時間1.5h,在此最佳條件下苜蓿異黃酮的提取率為17.12mg/g。本實驗的提取率高于前人的結果,提取率預測值為34.21mg/g。進一步對大孔樹脂富集工藝進行優化,對于紫花苜蓿總黃酮以D101 樹脂效果較好,得最佳富集工藝為,拌樣比1∶1,上樣量1∶20,2倍水體積洗脫洗滌,70%醇洗脫,3倍乙醇洗脫體積,流速控制在2ml/min。在此條件下得到的紫花苜蓿總黃酮收率為4.9%,富集物總黃酮含量為51%,有效成分轉移率86.5%,對紫花苜蓿總黃酮的開發利用奠定基礎。
正交設計法在黃酮類化合物在提取純化優化的實驗研究中采用的較多,該種方法相對完全實驗減少了實驗次數,使實驗條件得到優化,但是該方法的優化結果是從實驗設計有限的因素水平中得到的結果,由于水平少,不能得到最佳水平。然而均勻設計法彌補了這一不足,通過增加水平數,建立線性回歸方程求極值,計算出最佳水平,本實驗在均勻設計的條件下得到的數據結果科學合理。
[1] 王勇,劉學義.我國苜蓿研究現狀、存在問題及對策[J].內蒙古農業科技,2004(6):6-7.
[2] 高微微,何春年,佟建明.我國苜蓿屬植物資源及應用概況[J].時珍國醫國藥,2006,17(5):680-681.
[3] 胡明,盧德勛,牛文藝,等.苜蓿皂甙及其生物活性[J].中國畜牧獸醫,2007,34(1):9-12.
[4] 何春年,李展,高微微,等.紫花苜蓿化學成分的研究[J].天然產物研究與開發,2008,20(6):1005-1011.
[5] 何云,劉圈煒,王成章.紫花苜蓿活性成分研究進展[J].飼料工業,2005,26(17):52.
[6] 張詠梅,晏石娟,曹致中,等.微波輔助提取苜蓿黃酮方法的研究[J].草地學報,2008,16(1):76-80.
[7] 朱宇旌,李新華,張勇,等.花苜蓿中總異黃酮提取研究[J].沈陽農業大學學報,2007,38(6):856-859.

