小議2012年諾貝爾化學(xué)獎(jiǎng)

摘要:介紹了2012年諾貝爾化學(xué)獎(jiǎng)獲得者——美國(guó)杜克大學(xué)教授羅伯特·洛夫科維茨和斯坦福大學(xué)教授布萊恩·克比爾卡,在G蛋白偶聯(lián)受體領(lǐng)域的開創(chuàng)性貢獻(xiàn)和引領(lǐng)性研究。分析了兩位科學(xué)家成功的因素,闡述了這一研究成果的價(jià)值和發(fā)展前景。
關(guān)鍵詞:諾貝爾化學(xué)獎(jiǎng);G蛋白偶聯(lián)受體;羅伯特·洛夫科維茨;布萊恩·克比爾卡
文章編號(hào):1005—6629(2013)1—0003—04 中圖分類號(hào):G633.8 文獻(xiàn)標(biāo)識(shí)碼:B
1 引言
2012年10月10日,諾貝爾委員會(huì)宣布將本年度化學(xué)獎(jiǎng)授予兩位美國(guó)生物學(xué)家羅伯特·洛夫科維茨(Robert.Lefkowitz)和布萊恩·克比爾卡(Brian.Kobilka),以表彰他們?cè)诎l(fā)現(xiàn)G蛋白偶聯(lián)受體(G-Protein-CoupledReceptors,縮寫為GPCRs)及其工作機(jī)制探索方面所做出的杰出貢獻(xiàn)。筆者作為一名長(zhǎng)期從事藥物化學(xué)研究的科研人員,在獲知這一消息時(shí)首先感到一些不解,詫異于本年度化學(xué)獎(jiǎng)會(huì)授予兩位醫(yī)生出身的生物學(xué)家。筆者正是帶著這樣的困惑,從_個(gè)化學(xué)工作者的角度去理解今年諾貝爾化學(xué)獎(jiǎng)的工作及意義,并在此與大家分享。
我們知道,應(yīng)激反應(yīng)是生命體區(qū)別于非生物體的一個(gè)重要特征,生物體從而可以對(duì)外界環(huán)境的各種變化(如光、溫度、聲音及氣味等)做出動(dòng)態(tài)反應(yīng)。細(xì)胞作為人體最基本的結(jié)構(gòu)和功能單位,其表面被一種“磷脂雙層”結(jié)構(gòu)的細(xì)胞膜所包裹,以阻止外來有害物質(zhì)的入侵,確保其內(nèi)部生化環(huán)境的相對(duì)穩(wěn)定。然而細(xì)胞并非是“閉關(guān)鎖國(guó)”孤立存在的,而是通過某種信號(hào)傳導(dǎo)機(jī)制,與外界時(shí)刻進(jìn)行著信息傳遞,以保證各種生理過程的正常進(jìn)行。細(xì)胞所具有的這種信息傳遞系統(tǒng)便是由位于細(xì)胞膜上的G蛋白偶聯(lián)受體作為主體通訊蛋白所構(gòu)成的,它們就像是細(xì)胞的“信號(hào)接收器”,接收外界信號(hào)并傳導(dǎo)到細(xì)胞內(nèi)部。
2 發(fā)現(xiàn)G蛋白偶聯(lián)受體家族
G蛋白偶聯(lián)受體是聯(lián)系細(xì)胞內(nèi)外環(huán)境的橋梁。然而在20世紀(jì)60-70年代以前,人們并不了解細(xì)胞感知外部環(huán)境的具體機(jī)制,甚至許多資深科學(xué)家都懷疑細(xì)胞表面是否真的存在著某種受體。到了上世紀(jì)60年代末期,年輕的洛夫科維茨加入了美國(guó)國(guó)立衛(wèi)生研究院(NIH)的醫(yī)生研究實(shí)習(xí)計(jì)劃,嘗試使用放射性同位素標(biāo)記技術(shù)這一經(jīng)典的化學(xué)手段對(duì)一些激素分子進(jìn)行標(biāo)記,以期尋找到這些激素分子的受體。激素分子被放射性同位素標(biāo)記后,就如同被裝置了信號(hào)發(fā)射器,通過檢測(cè)放射信號(hào),就可以對(duì)被標(biāo)記激素分子的生理過程進(jìn)行動(dòng)態(tài)跟蹤。1970年他使用放射性碘-125標(biāo)記促腎上腺素(Adrenocorticotropic Hormone,簡(jiǎn)稱ACTH,一種多肽激素),初步證明在細(xì)胞的表面可能存在著某種受體。
第二年,洛夫科維茨使用放射性氫-3標(biāo)記去甲腎上腺素(Norepinephrine),發(fā)現(xiàn)在狗心肌細(xì)胞中可能存在著受體。他還設(shè)計(jì)發(fā)明了使用親和層析柱的方法用于分離純化受體。他在瓊脂糖的側(cè)鏈上引入一個(gè)小的糖鏈,并通過該糖鏈人工引入去甲腎上腺素或者腎上腺素這類激素分子,這樣改造后的瓊脂糖柱就可以選擇性地吸附受體。到了1983年,他把純化后的可以與腎上腺素分子結(jié)合的受體蛋白轉(zhuǎn)入到不響應(yīng)腎上腺素的細(xì)胞,發(fā)現(xiàn)細(xì)胞的表現(xiàn)與具有腎上腺素受體的細(xì)胞相同,讓人們真正相信了在細(xì)胞的表面確實(shí)存在著受體。
由于蛋白質(zhì)是被基因(DNA)所編碼,然后再翻譯成蛋白質(zhì)的。因此要想真正了解腎上腺素受體,還需要在龐大的人類基因組中尋找到編碼該蛋白的基因,即其DNA序列,并實(shí)現(xiàn)該基因的正確表達(dá),即克隆。起始工作異常困難,采用已有方法反復(fù)試驗(yàn)均告失敗,此時(shí)在洛夫科維茨實(shí)驗(yàn)室做博士后的克比爾卡發(fā)揮了關(guān)鍵性作用,他大膽地提出了新的試驗(yàn)方案。經(jīng)組內(nèi)熱烈討論后,洛夫科維茨最終同意了這一近乎“瘋狂”的研究方案。新方法很快獲得了成功,在1986年首次實(shí)現(xiàn)了編碼倉鼠B2腎上腺素受體基因的正確克隆。
隨后在對(duì)該受體蛋白的氨基酸序列進(jìn)行分析時(shí),他們發(fā)現(xiàn)B2腎上腺素受體的氨基酸序列與1984年報(bào)道的牛的“光受體”視紫質(zhì)蛋白(Rhodopsin)具有顯著的相似性,二者都具有七次跨膜結(jié)構(gòu)。洛夫科維茨和克比爾卡推斷視紫質(zhì)蛋白和腎上腺素受體很可能屬于同一蛋白家族,有著相似的工作機(jī)制,同時(shí)這一家族還包含了很多重要的激素受體。就是這靈光一閃的推斷最終導(dǎo)致了G蛋白偶聯(lián)受體超家族的發(fā)現(xiàn)。目前已經(jīng)發(fā)現(xiàn)了約1000多個(gè)受體蛋白成員。
3 G蛋白偶聯(lián)受體的工作機(jī)制研究
不同于化學(xué)小分子,G蛋白偶聯(lián)受體是一類生物大分子,是由350~1200個(gè)氨基酸殘基通過肽鍵首尾鏈接而成的一類細(xì)胞膜蛋白質(zhì)。它們通過其特征性的七次跨膜螺旋“錨定”在細(xì)胞膜的磷脂雙層中,并由此組成了橫跨細(xì)胞膜的胞外和胞內(nèi)兩個(gè)部分。外界環(huán)境中的各種信號(hào)分子(如嗅覺分子)可與其胞外部分結(jié)合,引起G蛋白偶聯(lián)受體空間形態(tài)發(fā)生改變,促使細(xì)胞內(nèi)部分與G蛋白三聚體(Gα、Gβ和Gγ的復(fù)合物)結(jié)合并釋放出被激活的Gα蛋白,后者進(jìn)一步激活相關(guān)酶,引發(fā)一系列級(jí)聯(lián)放大反應(yīng),最終表現(xiàn)為各種生理反應(yīng)如嗅覺、視覺等。由于七次跨膜螺旋結(jié)構(gòu)是該類蛋白的一個(gè)共有特征,因此人們傾向于將C蛋白偶聯(lián)受體稱為“七螺旋跨膜受體”,其工作機(jī)制如圖1所示。
然而要想在分子水平上研究腎上腺素受體的工作的具體細(xì)節(jié),還需要獲得該蛋白的單晶,并通過晶體解析的方法獲得受體在原子水平上的空間形態(tài)信息。與視紫質(zhì)蛋白不同,大部分的G蛋白偶聯(lián)受體在細(xì)胞內(nèi)的含量很少,且具有復(fù)雜而柔韌的七次跨膜結(jié)構(gòu),有著多種空間形態(tài),在培養(yǎng)單晶的過程中容易被降解或者變性失活。因此培養(yǎng)G蛋白偶聯(lián)受體的單晶是一項(xiàng)巨大的挑戰(zhàn),在很長(zhǎng)的一段時(shí)間里,人們一直無法獲得除視紫質(zhì)蛋白以外的其他家族成員的單晶。
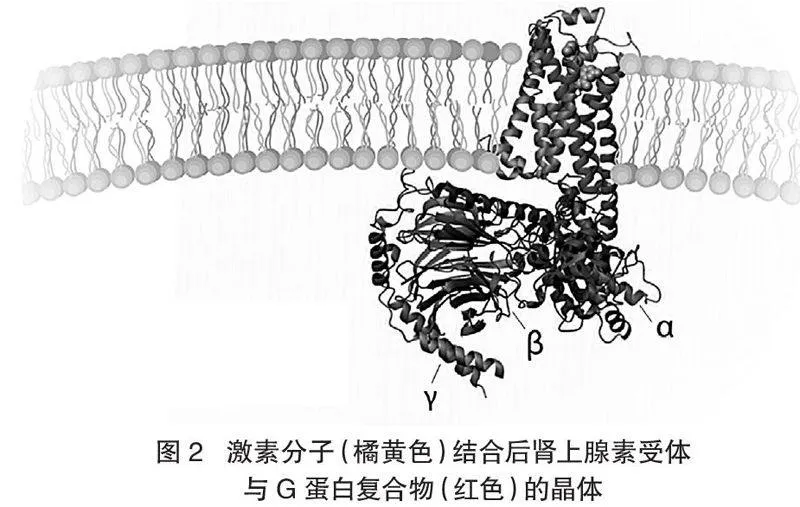
在發(fā)現(xiàn)腎上腺素受體以后,洛夫科維茨就已經(jīng)著手嘗試結(jié)晶腎上腺素受體,而克比爾卡在成功獲得腎上腺素受體編碼基因后,也把解析腎上腺素受體的晶體結(jié)構(gòu)作為自己未來的科研目標(biāo)。1989年克比爾卡離開洛夫科維茨實(shí)驗(yàn)室,經(jīng)過了近20年孜孜不倦和艱苦卓越的研究,終于在2007年實(shí)現(xiàn)了除視紫質(zhì)蛋白以外的首個(gè)非活性的G蛋白偶聯(lián)受體-β2腎上腺素受體的晶體結(jié)構(gòu)解析。2011年初,克比爾卡實(shí)驗(yàn)室又成功獲得了第一個(gè)處于活性狀態(tài)的β2腎上腺素受體結(jié)晶,很快又獲得了第一個(gè)處于活性狀態(tài)的腎上腺素受體與G蛋白結(jié)合后的蛋白復(fù)合物的晶體結(jié)構(gòu)(見圖2)。這是一項(xiàng)振奮人心的科研成就,是人們第一次在原子水平上觀察到了G蛋白偶聯(lián)受體與G蛋白結(jié)合的詳細(xì)細(xì)節(jié),此時(shí)腎上腺素受體的胞外部分與小分子結(jié)合,胞內(nèi)部分則與G蛋白結(jié)合。其情形就像是扣動(dòng)了手槍的扳機(jī)后,槍栓推動(dòng)子彈正要發(fā)射的瞬間。作為今年化學(xué)獎(jiǎng)的皇冠之作,諾貝爾評(píng)審委員會(huì)說,這一圖像是“分子水平上的杰作”,是幾十年研究的結(jié)晶,對(duì)于在分子水平上理解細(xì)胞的信號(hào)傳導(dǎo)機(jī)制具有重要而深遠(yuǎn)的意義。
4 成功的秘訣
筆者認(rèn)為洛夫科維茨和克比爾卡的成功是多種因素作用的必然結(jié)果,概括起來主要有以下五點(diǎn):
(1)早期建立了大規(guī)模分離純化腎上腺素受體蛋白的技術(shù)平臺(tái)。在1979年洛夫科維茨實(shí)驗(yàn)室利用腎上腺素受體親和層析以及抗體等技術(shù)手段,已經(jīng)能夠在較大規(guī)模上分離純化腎上腺素受體,后期又實(shí)現(xiàn)了受體基因編碼的成功克隆,這些都保證了開展研究所需的蛋白來源。
(2)蛋白晶體學(xué)領(lǐng)域相關(guān)的結(jié)晶新方法以及高靈敏度晶體解析新技術(shù)的發(fā)展。1997年Maekinon用蛋白抗體的方法成功獲得了離子通道的晶體,脂立方技術(shù)的運(yùn)用則使得結(jié)晶膜蛋白成為可能。
(3)知己知彼,百戰(zhàn)不殆。盡管腎上腺素受體結(jié)構(gòu)復(fù)雜,空間形態(tài)多樣,但通過長(zhǎng)期的研究中發(fā)現(xiàn),受體蛋白某些位點(diǎn)上的結(jié)構(gòu)改動(dòng)并不會(huì)影響其整體形態(tài)的變化及其功能的正常發(fā)揮。因此他們想到可以先借助外力將受體蛋白“鎖定”在某種形態(tài),然后對(duì)形態(tài)穩(wěn)定后的蛋白進(jìn)行結(jié)晶。使用小分子化合物與受體結(jié)合后,通過在腎上腺素受體的第三個(gè)細(xì)胞內(nèi)環(huán)上插入溶菌酶以及與抗體共結(jié)晶這兩種技術(shù)手段,克比爾卡實(shí)驗(yàn)室在2007年成功解析了β2腎上腺素受體的兩種晶體結(jié)構(gòu)。此后關(guān)于G蛋白偶聯(lián)受體晶體解析的研究開始日趨活躍,特別是運(yùn)用溶菌酶插入技術(shù),已成功解析了許多G蛋白偶聯(lián)受體的晶體結(jié)構(gòu)。
(4)興趣推動(dòng)的勤奮與堅(jiān)持。醫(yī)生在美國(guó)是受人羨慕的職業(yè),兩位獲獎(jiǎng)?wù)叨荚鲞^醫(yī)生,但出于對(duì)科學(xué)的熱愛,他們最終與G蛋白偶聯(lián)受體結(jié)緣并為之樂此不疲。特別是克比爾卡,他在離開洛夫科維茨實(shí)驗(yàn)室后的前十幾年里_直沒有重大的突破,以至于霍華德休斯醫(yī)學(xué)研究所(一個(gè)有名的擅長(zhǎng)支持長(zhǎng)期高風(fēng)險(xiǎn)研究的機(jī)構(gòu))都失去了信心,并在2003年停止了研究經(jīng)費(fèi)的資助。在那段艱難的時(shí)間里,克比爾卡沒有條件招收博士后,就只能自己親手做實(shí)驗(yàn)繼續(xù)他的研究,最終獲得了成功。克比爾卡自言,他的堅(jiān)持是基于一種盲目的樂觀“問題總歸會(huì)解決的”,即我們所說的“車到山前必有路”。
(5)人格魅力。在克比爾卡的博士后學(xué)生杜洋眼中,他不僅是一個(gè)純粹的科學(xué)家,而且是一個(gè)接近于完美的人,做事低調(diào),性格溫和,為人謙虛,堅(jiān)韌執(zhí)著,是非常合格的導(dǎo)師、丈夫和父親。他總是能顧及其他人的感受,從來不會(huì)對(duì)學(xué)生語氣生硬,更別說生氣。克比爾卡—直非常肯定眾多合作者的貢獻(xiàn),給予公平的承認(rèn),讓每個(gè)合作者都心悅誠(chéng)服。唯一的缺點(diǎn)可能就是他不太擅長(zhǎng)和別人談?wù)摽蒲幸酝獾脑掝},對(duì)媒體的采訪也很不適應(yīng),甚至于會(huì)覺得緊張。清華大學(xué)生命科學(xué)學(xué)院院長(zhǎng)施一公教授說,克比爾卡是一個(gè)真正的科學(xué)英雄。
5 展望
作為細(xì)胞的“聰明受體”,G蛋白偶聯(lián)受體與我們的生活息息相關(guān)。它們廣泛參與了人類的感知、生殖、生長(zhǎng)發(fā)育、神經(jīng)和情感等多種生理過程和生命活動(dòng),與心臟病、糖尿病、腫瘤、免疫、感染性疾病以及精神類疾病等多種疾病的發(fā)生、發(fā)展和治療密切相關(guān),半數(shù)以上的現(xiàn)代藥物都是通過G蛋白偶聯(lián)受體發(fā)揮作用的。但是G蛋白偶聯(lián)受體家族龐大,目前也只是開發(fā)了30%左右的G蛋白偶聯(lián)受體用于藥物開發(fā),因此我們目前所獲得知識(shí)還只是冰山一角。隨著認(rèn)識(shí)的深入以及新技術(shù)的發(fā)展,G蛋白偶聯(lián)受體的研究將會(huì)獲得更大的發(fā)展,并使整個(gè)制藥工業(yè)受益。
或許中科院生物物理研究所的王江云老師很早就悟出了今年諾貝爾化學(xué)獎(jiǎng)的玄機(jī),他在2012年10月23日的博文中這樣寫道:2012年諾貝爾化學(xué)獎(jiǎng)?lì)C給兩位生物學(xué)家,一方面是表彰兩位科學(xué)家在G蛋白偶聯(lián)受體領(lǐng)域奠基性的貢獻(xiàn),同時(shí)也是對(duì)藥物化學(xué)家和有機(jī)化學(xué)家的褒獎(jiǎng),正是由于化學(xué)家們創(chuàng)造出了這么多非常有效的藥物,才使得洛夫科維茨和克比爾卡的基礎(chǔ)研究得以真正造福人類。也許,這才符合諾貝爾本人設(shè)立諾貝爾獎(jiǎng)的初衷,即表彰那些能夠真正造福人類的重大發(fā)現(xiàn)和發(fā)明。

