高血壓腦出血模型大鼠不同時間段腦損傷程度與NO 含量和C9 表達的關系
徐 莉
(武漢市中南干休所醫務室,湖北 武漢 430071)
近年來的研究表明腦出血(intracerebral hemorrhage,ICH)后血腫四周存在明顯的炎癥反應,炎癥反應在腦出血繼發性腦損傷中起著十分重要的作用[1]。研究發現,補體系統在腦損傷炎癥反應過程中起著重要作用[2]。本實驗通過觀察不同時間段高血壓腦出血大鼠腦組織含水量、腦組織C9 表達和NO 水平,以探討其與腦損傷程度的關系。
1 材料與方法
1.1 實驗材料
1.1.1 動物分組與造模
大鼠由湖北省動物實驗中心提供,合格證號:SCXK(鄂)2011~012;分組:將96 只大鼠隨機分為均等的3 部分(每部分32 只),分別用于腦組織含水量測定、腦組織NO 水平測定和C9 表達檢測。每部分又隨機分為假手術組、模型組共2組,每組16 只;每個小組16 只大鼠再4 個為一組,分別觀察術后2h、12、24、72h 四個時間點各項指標,各組飼養條件相同。
高血壓模型及腦出血模型的制備是通過應用雙腎雙夾法來復制腎性高血壓大鼠(RHR)模型。剔除飼養過程期間出現腦卒中癥狀和體征的大鼠。雙腎雙夾術后2~3 月體質量300~350g/只的高血壓大鼠參照Rosenberg[3]的方法,術前禁食,可自由飲水,大鼠用戊巴比妥(0.1ml/100g)注射液腹腔麻醉后俯臥位固定于立體定位儀上,據圖譜調整立體定位儀于注射點,頭皮正中常規消毒后矢狀位切開約1.5cm,暴露前囟點,用骨鉆鉆顱打孔(直徑約1mm)后,用微量進樣器吸取膠原酶2μl 迅速插入鉆好的孔內,進針5mm,注射時間不少于15min,且留針10min 后緩慢退針,鉆孔處用骨蠟封閉,局部消毒后,縫合皮膚。
1.1.2 藥品與儀器
注射用尿激酶(03290,南京南大藥業有限責任公司),配制成200IU/L 的溶液;兔抗大鼠C9 免疫組化試劑盒(上海恒遠生化試劑有限公司);NO試劑盒來自南京建成生物工程研究所。儀器:大鼠腦立體定位儀,微量注射儀購于北京智鼠多寶生物科技有限責任公司;電子天平(SARTOR2US,BP211D),德國生產;8021 離心機(上海手術器械廠);752 分光光度儀(上海精密儀器儀表有限公司);半自動免疫組化儀(常州市郝思琳醫用儀器有限公司);計算機病理圖像管理系統4.10(北航圖像中心)。
1.2 方法
分別于術后第2、12、24 及72h,用10%水合氯醛麻醉大鼠后,迅速取出全腦,并用濾紙吸干腦表面液體和血跡,一部分置于中性福爾馬林內固定作HE 染色和免疫組化染色。另一部分用于腦組織含水量測定。
1.2.1 腦組織含水量測定[4]
將樣本小塑料封口袋密閉,置-20 ℃冰箱內5~10 min 微凍硬后取出,置于薄膜隔開的干冰上,用薄刀片切取離膠原酶注入點4mm 以外的2mm 厚冠狀腦片,分離出血側皮質及基底節,置濃硫酸處理過的稱量杯內。用電子天平稱取濕重后,置小玻璃瓶中,再放入105℃烤箱內烘烤24~48h,直到稱重為恒重。根據Eliott 公式可以計算腦組織含水量(Water Content,WC)
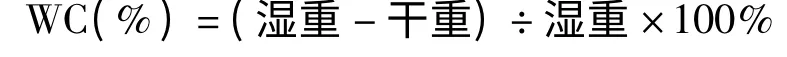
1.2.2 腦組織C9 表達測定
分別于第2、12、24、72h 手術,取腦組織,固定:C9 著色于細胞漿和細胞膜。采用兔抗大鼠C9 免疫組化試劑合,按試劑盒要求檢測。在免疫組化陽性細胞胞漿及胞膜可見棕黃色顆粒。緊貼血腫周圍但不包括血腫區切片,每張切片隨機取4 個不重復高倍視野(400 倍),計數每個高倍視野下陽性細胞數。所有切片均在同等強度下、同等放大倍數下分析,取每一時間點高倍視野下的陽性細胞數平均數,結果用表示。
1.2.3 NO 測定
分別于第2、12、24、72h 手術,微凍硬后取出,置薄膜隔開的干冰上,分離出血側皮質及基底節,4℃下用預冷的勻漿介質制備成10%的腦勻漿置3000r/min 離心15min 后,取腦勻漿上清液,按硝基還原酶法測定NO 的含量,嚴格按照試劑盒說明書進行操作。
1.3 統計方法
2 結果
2.1 大鼠腦組織含量變化
從表1 可見,與假手術組相比,ICH組腦組織含水量從2h 開始增加,12h 增加較為明顯(P <0.05),24~72h 增加最明顯(P <0.01)。
表1 大鼠腦組織含水量(,%)
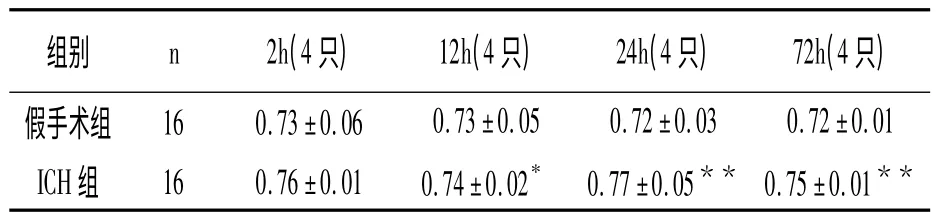
表1 大鼠腦組織含水量(,%)
與假手術組比較,* P <0.05、**P <0.01
2.2 大鼠腦組織C9 表達結果
腦出血后2h 血腫周圍可見少量C9 表達,陽性細胞為小膠質細胞(P >0.05),腦出血后12h增加明顯,24h 達到高峰(P <0.01),主要為小膠質細胞和少量的神經元細胞,血管內皮細胞亦可表達,一直持續到72h。可見,腦出血后24~72h,C9 的表達處于高峰,與假手術組比較有顯著性差異。見表2。
表2 大鼠腦組織補體C9 表達(,個)
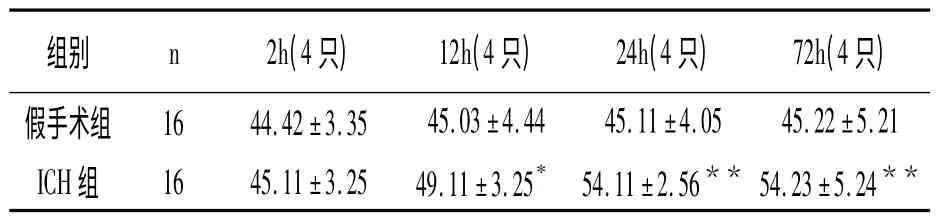
表2 大鼠腦組織補體C9 表達(,個)
與假手術組比較,* P <0.05、**P <0.01
2.3 大鼠腦組織中NO 含量的結果
與假手術組比較,ICH組大鼠2h 腦組織NO含量已有下降,12h 已有顯著性差異(P <0.05),24~72h 處于低水平(P <0.01)。
表3 大鼠腦組織NO 含量的變化(,μmol/L)
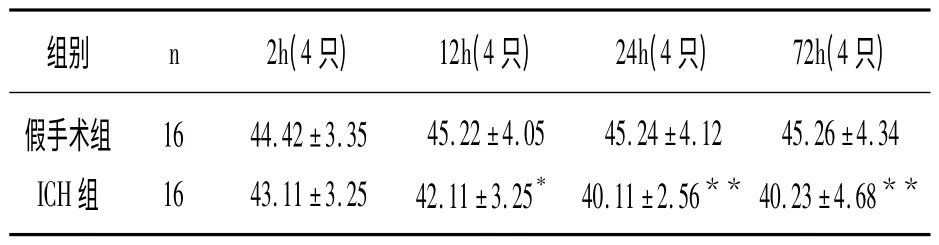
表3 大鼠腦組織NO 含量的變化(,μmol/L)
與假手術組比較,* P <0.05、**P <0.01
3 討論
在腦出血的病理發展過程中,腦組織繼發性損傷是腦出血病情加重、預后不良的重要因素[5]。出血性腦損傷的炎性反應,由白細胞粘附血管壁,血-腦屏障遭破壞、炎性細胞侵入腦實質等組成。腦出血時炎性因子表達增加,能增加腦水腫、血管壁通透性。NO 是由血管內皮細胞分泌的強有力的血管舒張因子,可以直接作用于平滑肌細胞,通過激活鳥苷酸環化酶,使細胞內的游離鈣水平降低,平滑肌松弛。腦部血流是由內皮衍生的NO調節的,NO 還是紅細胞聚集性的重要影響因素[6]。NO 可通過抑制白細胞-內皮細胞粘附、阻止血小板凝集和疏通組織灌注等限制缺血性腦損傷[7]。本實驗中與假手術組比較,ICH組大鼠2h腦組織NO 含量已有下降,12h 已有差異(P <0.05),24~72h 處于較低水平(P <0.01),說明腦出血急性期NO 下降是導致紅細胞聚集,進而溶解破裂、血腫形成的重要因素,因而治療中改善微循環是重要環節。腦出血后腦水腫主要分為血管源性腦水腫和細胞毒性腦水腫,血管源性腦水腫常發生于腦出血早期,它的形成原因主要有血管壁通透性增加、血管損傷、血漿外滲及血腦屏障破壞[8]。腦出血后補體級聯被激活,C9 表達增加,補體C9-C5b組成膜攻擊復合物(MAC),MAC 是大分子復合物,可形成跨膜孔道使大分子物質和離子雙向流動,進而攻擊神經膠質細胞、神經細胞和血腫內的紅細胞,加劇ICH 后腦損傷,MAC 也可直接插入星形膠質細胞、神經元和內皮細胞,破壞血腦屏障。實驗表明腦出血后24~72h,C9 的表達處于高峰,說明在腦出血后腦水腫尤其在血管源性腦水腫中補體系統對于其發展起著重要作用。
[1]聶亞雄,王東,張雄,等.三七總皂苷注射液對腦出血大鼠腦水腫的影響[J].中國中西醫結合雜志,2006,26(10):922
[2]Hua Y,Xi G,Keep RF,et al.Complement activation in the brain after experimental intracerebral hemorhage[J].J Neurosurg,2000,92(6):1016
[3]Rosenberg GA,Mun-Bryce S,Kornfeld M,et al.Colla-genase induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801
[4]Guohua Xi,Ya Hue,Keep RF,et al.Activation of p44/42 mitogen activated protein kinase in thrombin-induced brain tolerance[J].Brain Res,2001,(895):153
[5]Keep RF,Xi G,Hua Y,et al.The deleterious or beneficial effects of different agents in intracerebral hemorrhage:think big,think small or is hematoma size important[J].Stroke,2005,36(7):1594
[6]Beridze M,Momtsehdze N,Shakarishvili R,et al.Effect of nitric oxide initial blood levels on erythroeyte aggrega-bility during 1 2 houm from ischemic stroke onset[J].Clinical Hemorheology and Microcirculation,2004,30:403
[7]Cosentino F,Rubaattu S,Savoia C,et al.Endothelial dysfunction and stroke[J].J Cardiovasc Pharmacol,2001,38(Suppl 2):75
[8]Nakam ura T,Xi G,Park JW,et al.Holo-transferrin and thrombin can interact to cause brain dam age[J].Stroke,2005,36(2):348

