絲瓜多酚氧化酶的分離純化及酶學(xué)性質(zhì)
吳海霞,曹雨舟
(1.運(yùn)城學(xué)院生命科學(xué)系,山西 運(yùn)城 044000;2.山西昭鑫電力科技有限公司,山西 運(yùn)城 044000)
絲瓜多酚氧化酶的分離純化及酶學(xué)性質(zhì)
吳海霞1,曹雨舟2
(1.運(yùn)城學(xué)院生命科學(xué)系,山西 運(yùn)城 044000;2.山西昭鑫電力科技有限公司,山西 運(yùn)城 044000)
從絲瓜中分離純化出多酚氧化酶(polyphenol oxidase,PPO),并對其部分酶學(xué)性質(zhì)進(jìn)行研究。采用硫酸銨分級鹽析、透析、DEAE-Cellulose DE-52離子交換層析和Sephadex G-75分子篩凝膠過濾層析分離純化絲瓜PPO。純化所得酶的比活力為957.9 U/mg,純化倍數(shù)為28.3,酶活力回收率為18.5%;十二烷基磺酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)及非變性聚丙烯酰胺凝膠電泳(Native-PAGE)檢測結(jié)果顯示該酶蛋白呈單一條帶,為單亞基蛋白,其分子質(zhì)量約為67.8 kD,且無同工酶;該酶最適pH 6.0,最適溫度30 ℃,以左旋多巴(L-dopa)為底物,其米氏常數(shù)(Km)為1.32 mmol/L,最大反應(yīng)速率(Vmax)為0.22 OD475nm/min。
絲瓜;多酚氧化酶;分離純化;酶學(xué)特性
絲瓜(Luffa cylindrica L. Roem)為葫蘆科絲瓜屬一年生攀緣性草本植物,在我國南北各地普遍種植[1]。中醫(yī)認(rèn)為,絲瓜性涼、味甘,具有清熱涼血、順氣健脾、化瘀解毒等功效,是一種具有良好保健功效的蔬菜[2]。絲瓜在加工過程中易發(fā)生褐變,這主要是由于在受到機(jī)械損傷或處于不良環(huán)境時絲瓜體內(nèi)的多酚類物質(zhì)會在多酚氧化酶(polyphenol oxidase,PPO)的催化作用下氧化而呈現(xiàn)褐色,這在一定程度上降低了絲瓜的感官品質(zhì)、營養(yǎng)價值和商品價值[3]。PPO是植物體內(nèi)普遍存在的一類含銅元素的金屬蛋白酶,能催化植物酚類物質(zhì)為醌類,醌經(jīng)自身縮合或與細(xì)胞內(nèi)的蛋白質(zhì)反應(yīng),產(chǎn)生黑色或褐色沉積物,是引起果蔬發(fā)生酶促褐變的主要酶類[3-4]。國內(nèi)外對果蔬中PPO的研究主要集中在蘋果[5-6]、香蕉[7]、馬鈴薯[8]、茄子[9]、蘑菇[10-12]、蓮藕[13]、綠豆[14]等,有關(guān)絲瓜PPO的研究僅黃樹蘋等[3]采用粗酶提取物對其部分酶學(xué)特性進(jìn)行了報道。本實(shí)驗(yàn)以新鮮絲瓜為試材,對其中的PPO進(jìn)行分離純化及純度鑒定,并對其部分酶學(xué)特性進(jìn)行研究,以期為進(jìn)一步研究果蔬褐變機(jī)理、調(diào)控絲瓜加工條件及采用抗褐變措施提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
市售新鮮絲瓜,經(jīng)剝皮后用粉碎機(jī)破碎,備用。
DE-52 英國Whatman公司;SephadexG-75 美國Pharmacia公司;低相對分子質(zhì)量標(biāo)準(zhǔn)蛋白質(zhì)Maker為預(yù)染蛋白;PEG-20000、PEG-4000 美國Ameresco公司;其余試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
Lambda 35紫外-可見分光光度計(jì) 美國Perkin Eimer公司;2-16k臺式高速冷凍離心機(jī) 美國Sigma公司;Alpha 1-2 LD plus冷凍干燥機(jī) 德國Christ公司;mini電泳儀、電泳槽 美國Bio-Rad公司;PB-10 pH計(jì) 德國Sartorius公司;BT1-100E 恒流泵、QT-58A智能紫外檢測儀、DBS-100-LCD全自動部分收集器 上海琪特分析儀器有限公司。
1.3 方法
1.3.1 蛋白質(zhì)含量測定
采用Bradford染色法[4]。以牛血清蛋白作為標(biāo)準(zhǔn)蛋白,繪制標(biāo)準(zhǔn)曲線,并計(jì)算蛋白質(zhì)含量。其回歸方程為y=5.217 1x+0.003 8,R2=0.999 3。
1.3.2 多酚氧化酶(PPO)酶活力的測定
取2.4 mL 20 mmol/L pH 7.5的Tris-HCl緩沖液(TBS)于試管中,45℃預(yù)熱3 min,加入0.5 mL 30 mmol/L L-Dopa溶液,預(yù)熱2 min,加400 μL酶液,反應(yīng)6 min后,迅速取出測定OD475nm。以煮沸10 min后的酶液取代原酶液作為空白對照。1個PPO活力單位(U)定義為:測定條件下每分鐘引起OD值變化0.001所需的酶量[6,10]。比活力(U/mg)定義為:指酶液中每毫克蛋白的酶活力。純化倍數(shù)是指純化后所得酶液的比活力與粗提酶液比活力的比值。
1.3.3 絲瓜PPO粗酶液的提取
采用磷酸緩沖液(phosphate buffered saline,PBS)提取法[8-9]。取200 g新鮮絲瓜,剪碎后,以料液比1∶1(m/V)加入4 ℃預(yù)冷的pH 5.5 PBS中,并加10 g聚乙烯吡咯烷酮及0.5 g VC,勻漿,于4 ℃靜置浸提12 h,過濾,濾液于4℃、10 000 r/min離心20 min,上清液即為PPO粗酶液。
1.3.4 絲瓜PPO的分離純化
1.3.4.1 分級鹽析
在粗酶液中,加入30%飽和硫酸銨,4℃靜置6 h,10 000 r/min離心20 min,上清液測量體積后再加入40%的飽和硫酸銨、靜置、離心。同上,依次用50%、60%、70%、80%的不同飽和度硫酸銨進(jìn)行鹽析。測定每次鹽析后上清液中的酶活力,以粗酶提取液的酶活力為100%,二者相比得相對酶活力[9]。實(shí)驗(yàn)重復(fù)3次。
1.3.4.2 透析除鹽
將經(jīng)鹽析所得蛋白溶于PBS,于4℃冰箱透析約12~18 h,其間每3~4 h更換蒸餾水。BaCl2飽和溶液檢查透析是否完全。
1.3.4.3 聚乙二醇濃縮
透析后的酶液采用 PEG4000濃縮后,過DEAE-cellulose DE52離子交換柱;收集的酶液采用 PEG20000濃縮后進(jìn)行Sephadex G-75凝膠過濾。
1.3.4.4 DEAE-cellulose DE-52離子交換層析
取4 mL濃縮后的酶液上樣于經(jīng)0.02 mol/L、pH 7.0 TBS平衡的DE-52離子柱,用0.02 mol/L、pH 7.0的TBS(含0~1 mol/L NaCl)連續(xù)線性洗脫,流速0.5 mL/min,每管收集1.5 mL。測定各管的OD280nm、OD475nm及酶活力,合并收集酶活性峰。PEG20000濃縮、離心備用[6-9]。
1.3.4.5 Sephadex G-75凝膠過濾層析
將經(jīng)DE-52初步純化的粗酶液12000 r/min高速離心5 min,取上清1 mL上樣Sephadex G-75凝膠柱,用0.05 mol/L、pH 7.0的TBS(0.l mol/L NaCl)洗脫,流速0.25 mL/min,每管收集1.0 mL。隔管檢測OD280nm和OD475nm及酶活力,合并收集酶活性峰。真空冷凍干燥,備用[6-9]。
1.3.5 SDS-PAGE和Native-PAGE檢測[15]
1.3.5.1 SDS-PAGE電泳
采用分離膠12%、濃縮膠4%,電極緩沖液為pH 8.3的Tris-Gly-SDS緩沖液。初始電壓80 V,待溴酚藍(lán)指示染料前沿進(jìn)入分離膠后,電壓調(diào)至120 V。以溴酚藍(lán)在電泳凝膠片的前沿位置作參數(shù),計(jì)算各標(biāo)準(zhǔn)蛋白與樣品的相對遷移率Rf值,以lgMr對Rf值作標(biāo)準(zhǔn)曲線,計(jì)算PPO的相對分子質(zhì)量。回歸方程為y=-1.361 4x+2.646 5,R2=0.962 3。
1.3.5.2 Native-PAGE電泳
操作方法與SDS-PAGE類似,但上樣前樣品不煮沸,且上樣緩沖液中不含強(qiáng)還原劑β-巰基乙醇。上樣樣品為檢測酶活力逐漸增強(qiáng)的5個收集管內(nèi)的酶液,每個樣品2個平行。電泳結(jié)束后,兩組樣品分別進(jìn)行活性染色與考馬斯亮藍(lán)R-250染色[9]。
1.3.6 絲瓜PPO部分酶學(xué)性質(zhì)
1.3.6.1 最適pH值
按1.3.2節(jié)酶活力測定體系,以不同緩沖液調(diào)節(jié)反應(yīng)體系的pH值,測定不同pH值(3.0~10.0)范圍內(nèi)PPO的酶活力;以酶液在最適條件下的酶活力作為100%,其余pH值條件下測得的酶活力分別與之相比得相對酶活力[11-12],每個處理3次重復(fù)。
1.3.6.2 最適溫度
按1.3.2節(jié)酶活力測定體系,分別測定酶液在不同溫度(20~70℃)下的酶活力;以酶液最適條件下酶活力作為100%,其余溫度條件下測得的酶活力分別與之相比得相對酶活力[11-12],每個處理3次重復(fù)。
1.3.6.3 米氏常數(shù)(Km)、最大反應(yīng)速率(Vmax)的測定
將L-Dopa配制成不同濃度的溶液(2~15 mmol/L),分別測定不同底物濃度下酶的反應(yīng)速率(用吸光度OD475nm表示)[14-15]。按Lineweaver-Burk雙倒數(shù)作圖,求出Km、Vmax。
2 結(jié)果與分析
2.1 硫酸銨最佳飽和度的確定
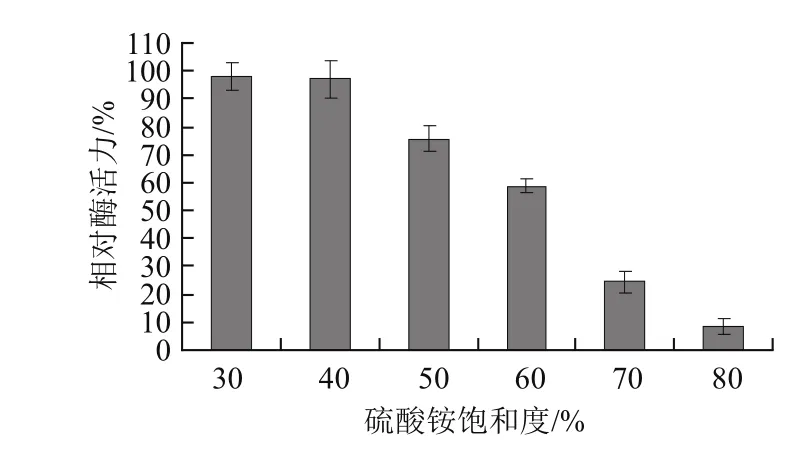
圖1 硫酸銨分級鹽析Fig.1 Ammonium sulphate fractional precipitation
為研究不同飽和度硫酸銨溶液沉淀絲瓜PPO的效果,對粗酶液提取液進(jìn)行分級鹽析,結(jié)果如圖1所示。采用30%~80%的飽和硫酸銨分級沉淀絲瓜PPO時,隨著硫酸銨飽和度的增加,其上清液中的相對酶活力逐漸降低。硫酸銨飽和度為30%時,上清液中的酶活力最高,40%與30%差異不明顯,但當(dāng)其飽和度升至50%時,酶活力下降幅度較大,當(dāng)飽和度達(dá)到80%時,上清液中幾乎不含酶蛋白,酶活力僅為7%。由此說明,絲瓜PPO主要存在于40%~80%飽和度硫酸銨鹽析沉淀中,小于40%的硫酸銨飽和度下沉淀出的蛋白質(zhì)主要為雜蛋白[11]。為了純化得到較多的PPO,同時使酶活力得到最大回收,以采用40%~80%飽和度硫酸銨鹽析沉淀對絲瓜PPO進(jìn)行初步純化最為合適。
2.2 絲瓜PPO的分離純化結(jié)果
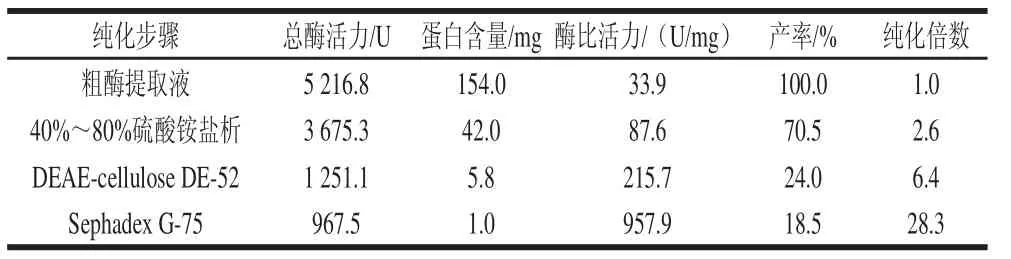
表1 絲瓜PPO純化結(jié)果Table 1 Purification of PPO from loofah
從表1可見,粗酶液提取液經(jīng)硫酸銨沉淀、柱層析純化后,其中的蛋白含量大幅降低,總酶活力明顯下降,但酶比活力顯著增加。粗酶液經(jīng)40%~80%飽和度硫酸銨分級沉淀后,去除了72.7%的雜蛋白,酶活力回收率70.5%,比活力比 粗酶液提高了2.6倍,可能是在純化過程中一些PPO活性抑制物被去除[16]。
經(jīng)硫酸銨沉淀后的PPO采用DEAE-cellulose DE-52柱層析進(jìn)一步純化,并選用改變洗脫液離子強(qiáng)度的方法對PPO進(jìn)行梯度洗脫,NaCl的梯度為0~1.0 mol/L。從圖2可以看出,這一步分離純化過程出現(xiàn)1個大的蛋白質(zhì)洗脫峰,和3個小的蛋白洗脫峰,其中第1個大的洗脫峰含酶量較少,幾乎檢測不到PPO活力。而第2個蛋白峰含酶量較高,對應(yīng)的NaCl洗脫濃度約為0.5 mol/L。從表1及洗脫曲線可以看出,酶活性峰的對應(yīng)位置蛋白峰較弱,說明離子交換層析可除去大部分雜蛋白,并使酶的比活力較粗酶液提高6.4倍。合并有酶活性的75~78號收集管,采用PEG20000包埋法濃縮,進(jìn)一步進(jìn)行Sephadex G-75凝膠柱純化。
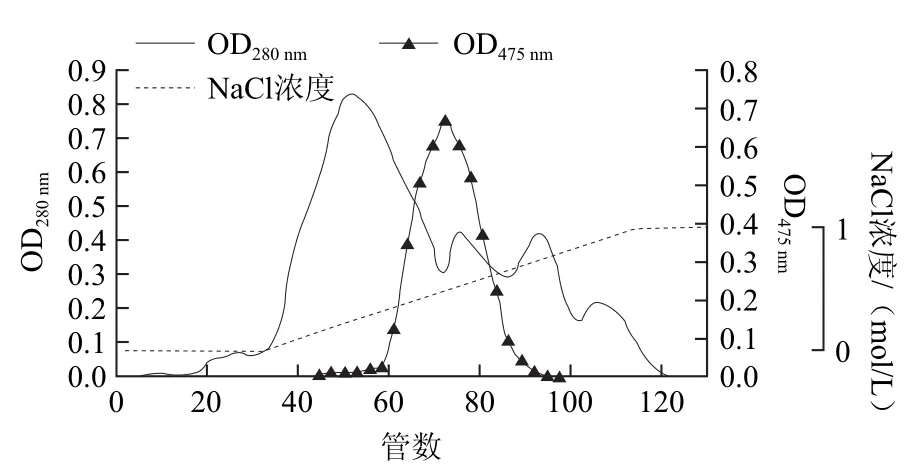
圖2 DEAE-Cellulose DE-52離子交換層析Fig.2 DEAE-Cellulose DE-52 ion exchange chromatography
Sephadex G75凝膠層析的洗脫曲線如圖3所示。可以看出,洗脫過程中出現(xiàn)3個明顯的蛋白吸收峰,經(jīng)檢測第1個峰蛋白含量較高,且對應(yīng)于酶活性峰,說明該峰即為PPO對應(yīng)洗脫峰。將對應(yīng)于第1個洗脫峰的第64~66管洗脫液合并,測定得其蛋白質(zhì)含量為1.0 mg,總酶活力為967.5 U,酶比活力為957.9 U/mg,經(jīng)過此純化步驟,酶液的比活力較粗酶液提高了28.3倍。在上述整個純化過程中,酶活力的回收率為18.5%,雜蛋白去除率高達(dá)99.4%。
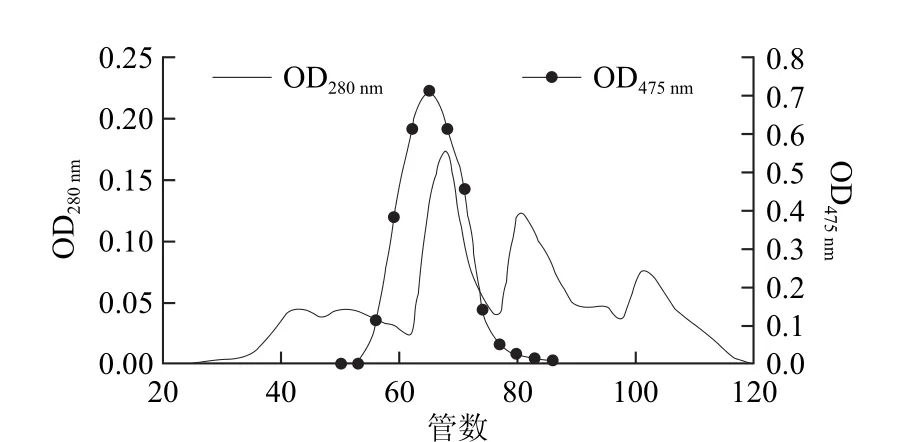
圖3 Sephadex G-75分子篩凝膠過濾層析Fig.3 Sephadex G-75 gel ?ltration chromatography
2.3 絲瓜PPO純度的鑒定結(jié)果對各步純化所得酶液分別進(jìn)行SDS-PAGE變性電泳,并對經(jīng)Sephadex G-75凝膠層析后的純化樣品進(jìn)行Native-PAGE非變性電泳,結(jié)果如圖4、5所示。由圖4可知,經(jīng)硫酸銨鹽析所得樣品中含有大量雜蛋白;經(jīng)DE-52離子交換層析后,雜蛋白明顯減少;最后經(jīng)Sephadex G-75分子篩凝膠過濾層析后,為單一條帶,說明該酶蛋白為單亞基蛋白,其分子質(zhì)量約為67.8 kD。
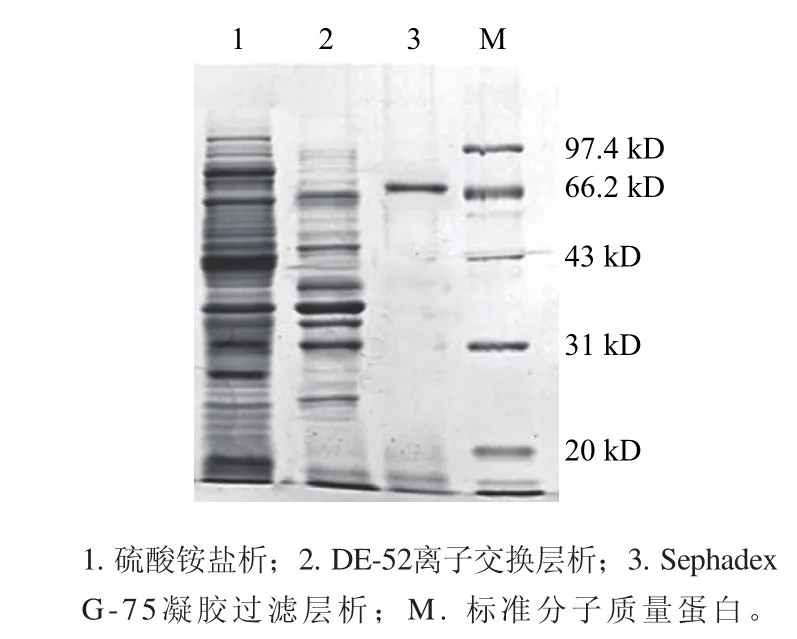
圖4 絲瓜PPO SDS-PAGE電泳圖譜Fig.4 SDS-PAGE of loofah PPO
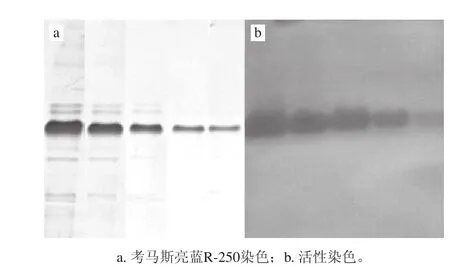
圖5 絲瓜PPO Native-PAGE圖譜Fig.5 Native-PAGE of loofah PPO
由圖5可知,對Native-PAGE電泳膠帶活性染色后,僅顯示1條清晰的隨蛋白濃度減小而由深變淺的褐色條帶(b),表明絲瓜PPO無同工酶。同時,與其對應(yīng)的樣品進(jìn)行考馬斯亮藍(lán)R-250染色后,得到清晰的藍(lán)色條帶(a),且條帶強(qiáng)弱均同活性染色條帶一致,表明考馬斯亮藍(lán)染色條帶即為絲瓜PPO蛋白。
2.4 絲瓜PPO部分酶學(xué)性質(zhì)分析結(jié)果
2.4.1 最適pH值分析結(jié)果
pH值是影響酶活性表達(dá)的重要因素,一般是通過改變酶的構(gòu)象而實(shí)現(xiàn)的,pH值不但影響酶活性基團(tuán)的解離,也會影響底物的解離[12]。由于PPO是含銅酶,pH值較高或較低都會導(dǎo)致Cu2+的解離及蛋白質(zhì)的變性,而使PPO失去活性。研究報道,不同植物或同一植物不同部位的PPO,其最適pH值可能有所不同,作用底物的不同也會導(dǎo)致最適pH值的變化。以鄰苯二酚為底物,曼密蘋果PPO為7.0[6],黑豆PPO最適pH 6.8[17],栗子PPO最適pH值為5.0[18]。Aydemir[19]分別以愈創(chuàng)木酚、L-Dopa及鄰苯三酚為底物研究得出洋薊PPO最適pH值分別為6.0、8.0和6.5。Arslan等[20]則分別以愈創(chuàng)木酚、兒茶酚及鄰苯三酚為底物研究表明桑葚PPO的最適pH值為5.0、7.0和7.5。本實(shí)驗(yàn)以L-Dopa為底物研究了絲瓜PPO的最適pH值。由圖6可知,該酶促反應(yīng)適宜的pH值范圍較寬,當(dāng)pH值為3.0~6.0時,隨著pH值的逐漸增加,絲瓜PPO的活性逐漸增強(qiáng),pH值為6.0時活性最高,然后隨著pH值的繼續(xù)增大,酶活力受到抑制,逐漸減弱。由此可知,以L-Dopa為底物時絲瓜PPO的最適pH為6.0。與黃樹蘋等[3]以鄰苯二酚為底物所測得的絲瓜PPO最適pH 6.8有差別。這主要是由于實(shí)驗(yàn)中PPO作用底物不同而造成,但同時也可能受到絲瓜品種、實(shí)驗(yàn)方法等因素的影響。
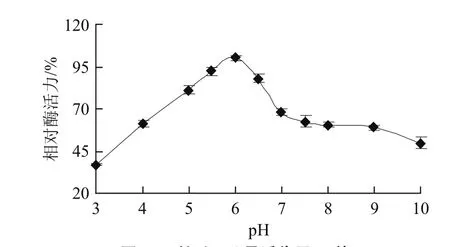
圖6 絲瓜PPO最適作用pH值Fig.6 Optimal pH of loofah PPO
2.4.2 最適溫度分析結(jié)果
溫度對酶催化反應(yīng)的影響是雙重的,一方面是酶作為一種生物催化劑,隨著溫度的升高,其活化分子數(shù)增多,催化效率提高,酶促反應(yīng)速率加快;另一方面則是隨著反應(yīng)溫度的升高,酶蛋白變性程度不斷加深,逐步喪失其催化活力,同時不適宜的溫度也會破壞酶活性部位三維結(jié)構(gòu)的完整性和穩(wěn)定性[17,21]。如圖7所示,在10~30 ℃隨著溫度的上升,絲瓜PPO活性逐漸增強(qiáng),30 ℃時活性最高,可能是在此溫度范圍內(nèi)第一種效應(yīng)起主導(dǎo)作用,溫度的適度提高,可使酶朝著有利于與底物發(fā)生作用的催化構(gòu)象轉(zhuǎn)變;隨著溫度的繼續(xù)升高,酶活力有所下降,但當(dāng)升高至65 ℃時還有60%以上的相對酶活力,這說明溫度的繼續(xù)升高雖然會使酶的催化活力下降,但效果并不明顯。因此說明,絲瓜PPO的最適反應(yīng)溫度雖是30 ℃,但在實(shí)際的貯藏、加工過程中,并不能單獨(dú)采用持續(xù)升溫的措施來控制褐變,而需與其他的控制酶活力的方法相結(jié)合。

圖7 絲瓜PPO最適作用溫度Fig.7 The optimal temperature of loofah PPO
2.4.3 Km、Vmax的測定結(jié)果
米氏常數(shù)(Km)是反應(yīng)達(dá)到最大反應(yīng)速率一半時的底物濃度,可以反映酶與底物親合力的大小。Km越小,酶與底物的親合力越大。酶的Km值范圍很廣,大多數(shù)酶的Km值在10-6~10-7mol/L[4]。不同植物來源PPO的Km不同,同一種PPO作用底物不同,其Km也不同。Palma-Orozco等[6]以兒茶酚和鄰苯三酚為底物,得出曼密蘋果PPO的Km分別為44、1.3 mmol/L。以L-Dopa為底物時洋薊PPO的Km及Vmax分別為37.7 mmol/L、5 865 U/(mL·min)[19]。本實(shí)驗(yàn)以L-Dopa為底物,據(jù)Lineweaver-Burk雙倒數(shù)作圖原理,得線性方程y=5.995 6x+4.549 6,推知絲瓜PPO的Km為1.32 mmol/L、Vmax為0.22 OD475nm/min。比較洋薊PPO與絲瓜PPO,發(fā)現(xiàn)作用于同一底物L(fēng)-Dopa時,其Km的差異很大,可能是由于不同來源PPO的酶蛋白組成、結(jié)構(gòu)不同,其與底物結(jié)合的能力強(qiáng)弱不同,從而造成其Km不同。
3 結(jié) 論
絲瓜PPO的分離純化過程表明,采用40%~80%的硫酸銨分級沉淀,可以去除粗酶提取液中72.7%的雜蛋白,酶活回收率達(dá)70.5%;經(jīng)透析、PEG濃縮,依次上樣DE-52和Sephadex G-75進(jìn)一步純化后,酶比活力達(dá)957.9 U/mg,酶活力回收率為18.5%,純化倍數(shù)為28.3。SDS-PAGE凝膠電泳顯示單一條帶,為單亞基蛋白,分子質(zhì)量約為67.8 kD,Native-PAGE結(jié)果表明此酶無同工酶。
絲瓜PPO酶促反應(yīng)在pH 5.0~7.0酶活力較高,pH 4.0~5.0和pH 7.0~8.0酶活力受到抑制,其最適pH 6.0。在10~30 ℃隨著溫度的升高,酶活逐漸增強(qiáng),在30 ℃時酶活最高;大于30 ℃時,隨著溫度的升高,酶活逐漸減弱,其最適溫度30 ℃。以L-Dopa為底物時,該酶的Km值為1.32 mmol/L,Vmax為0.22 OD475nm/min。在絲瓜的貯藏、加工過程中可采用調(diào)節(jié)pH值在強(qiáng)酸性或偏堿性環(huán)境并結(jié)合適當(dāng)升溫的方法來保持酶活性在較低的水平,從而達(dá)到控制絲瓜褐變的目的。
[1] 邵興云. 絲瓜的生物學(xué)特性和開發(fā)利用[J]. 生物學(xué)通報, 2004(5): 9-10.
[2] 蔡建. 絲瓜的營養(yǎng)保健和開發(fā)利用[J]. 食品與藥品, 2006, 8(5): 70-73.
[3] 黃樹蘋, 談太明, 徐長城, 等. 絲瓜多酚氧化酶的酶學(xué)特性初步研究[J].中國蔬菜, 2009(10): 17-22.
[4] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究進(jìn)展[J]. 植物學(xué)通報, 2005, 22(2): 215-222.
[5] 田玉庭, 岳田利, 袁亞宏, 等. 澳洲青蘋多酚氧化酶的分離純化研究[J].食品研究與開發(fā), 2006, 27(5): 180-182.
[6] PALMA-OROZCO G, ORTIZ-MORENO A, DORANTES-áLV AREZ L, et al. Purifi cation and partial biochemical characterization of polyphenol oxidase from mamey (Pouteria sapota)[J]. Phytochemistry, 2011, 72: 82-88.
[7] 張勇, 建偉, 溫其標(biāo), 等. 香蕉多酚氧化酶褐變性質(zhì)的研究[J]. 食品與發(fā)酵工業(yè), 2004, 30 (5): 53-57.
[8] MISHRA B B, GAUTAM S, SHARMA A. Purification and characterisation of polyphenol oxidase (PPO) from eggplant (Solanum melongena)[J]. Food Chemistry, 2012, 134(4): 1855-1861.
[9] MARRI C, FRAZZOLI A, HOCHKOEPPLER A, et al. Purification of a polyphenol oxidase isoform from potato (Solanum tuberosum) tubers[J]. Phytochemistry, 2003, 63: 745-752.
[10] 朱繼英, 王健, 王相友. 雙孢蘑菇多酚氧化酶的分離、純化及特性分析[J]. 園藝學(xué)報, 2012, 39(4): 763-768.
[11] 趙東海, 張建平, 侯菊花. 蘑菇中多酚氧化酶的酶學(xué)特性研究[J]. 食品與機(jī)械, 2004, 20(5): 12-13; 17.
[12] 李君蘭, 李怡華, 趙秋玲, 等. 雞腿蘑多酚氧化酶特性研究[J]. 食品科學(xué), 2007, 28(1): 187-191.
[13] 潘永貴, 陳維信. 鮮切蓮藕組織中多酚氧化酶的分離純化[J]. 食品與生物技術(shù)學(xué)報, 2008, 27(2): 55-60.
[14] GUO Li , Ma Ying, SHI J, et al. The purification and characterisation of polyphenol oxidase from green bean (Phaseolus vulgaris L.)[J]. Food Chemistry, 2009, 117: 143-151
[15] 陳均輝, 陶力, 朱婉華, 等. 生物化學(xué)實(shí)驗(yàn)[M]. 北京: 科學(xué)出版社, 2002. [16] 鄭校先, 戚曉玉, 周培根. 烏賊墨中多酚氧化酶的分離及純化[J]. 上海水產(chǎn)大學(xué)學(xué)報, 2001, 10(2): 154-157.
[17] 張寬朝, 全明吉. 黑豆多酚氧化酶的分離純化及其酶學(xué)特性研究[J].中國飼料, 2012(19): 38-41.
[18] XU J S , ZHENG T L, MEGURO S, et al. Purification and characterization of polyphenol oxidase from Henry chestnuts (Castanea henryi)[J]. The Japan Wood Research Society, 2004, 50: 260-265.
[19] AYDEMIR T. Partial purifi cation and characterization of polyphenol oxidase from artichoke (Cynara scolymus L.) heads[J]. Food Chemistry, 2004, 87(1): 59-67.
[20] ARSLAN O, ERZENGIN M, SINAN S, et al. Purifi cation of mulberry (Morus alba L.) polyphenol oxidase by affi nity chromatography and investigation of its kinetic and electrophoretic properties[J]. Food Chemistry, 2004, 88: 479-484.
[21] MDLULI K M. Partial purifi cation and characterisation of polyphenol oxidase and peroxidase from marula fruit (Sclerocarya birrea subsp. Caffra)[J]. Food Chemistry, 2005, 92(2): 311-323.
Isolation, Purification and Some Enzymatic Properties of Polyphenol Oxidase from Loofah
WU Hai-xia1, CAO Yu-zhou2
(1. Life Sciences Department, Yuncheng University, Yuncheng 044000, China; 2. Shanxi Zhaoxin Electric Power Technology Co. Ltd., Yuncheng 044000, China)
Polyphenol oxidase (PPO) from loofah was extracted, and some of its kinetic properties were studied. The PPO was purified by ammonium sulfate precipitation, dialysis, DEAE-Cellulose DE-52 ion-exchange and Sephadex G-75 gel filtration. The specific activity of the purified PPO was 957.9 U/mg, which exhibited a purification fold of 28.3 and an activity recovery of 18.5%. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and nativepolyacrylamide gel electrophoresis (Native-PAGE) showed that the enzyme was homogeneous as a monomeric protein. Its molecular weight was estimated to be 67.8 kD and it had no isozymes. The kinetic properties of the enzyme showed that the optimal pH and temperature were pH 6.0 and 30 ℃, respectively. The Kmand Vmaxtowards the substrate L-dopa were 1.32 mmol/L and 0.22 OD475nm/min, respectively.
loofah; polyphenol oxidase (PPO); purification; enzymatic properties
S642.4;TS255.36
A
1002-6630(2014)07-0187-05
10.7506/spkx1002-6630-201407037
2013-05-15
江蘇省普通高校研究生科研創(chuàng)新計(jì)劃項(xiàng)目(CXZZ12_0544)
吳海霞(1980—),女,講師,博士研究生,研究方向?yàn)檗r(nóng)產(chǎn)品貯藏保鮮及植物活性成分。E-mail:whxviolet@163.com

