響應面法優化小刺青霉16-7產纖維素酶液體發酵工藝
李 悅,薛橋麗,李世俊,王 晶,胡永金,*
響應面法優化小刺青霉16-7產纖維素酶液體發酵工藝
李 悅1,薛橋麗2,李世俊1,王 晶3,胡永金1,*
(1.云南農業大學食品科學技術學院,云南 昆明 650201;2.云南農業大學圖書館,云南 昆明 650201;3.玉溪沃森生物技術有限公司,云南 玉溪 653100)
在單因素試驗的基礎上,采用Plackett-Burman試驗設計及響應面分析,利用Minitab軟件,對纖維素酶高產菌小刺青霉(Penicillium spinulosum)16-7進行發酵工藝條件的優化。通過Plackett-Burman試驗篩選出影響產酶的3 個主要因素,即稻草-麩皮(碳源)添加量、培養溫度和培養時間。在此基礎上通過最陡爬坡試驗和響應面分析法進行回歸分析。結果表明:當稻草-麩皮添加量為3.45 g/100 mL、培養溫度為27.11 ℃和培養時間為146.27 h時,酶活力最高,此條件下濾紙酶酶活力預測值為132.53 U/mL。經過修正,選擇稻草-麩皮添加量3.45 g/100 mL、培養溫度27 ℃、培養時間146 h,此條件下測得羧甲基纖維素酶酶活力為387.58 U/mL、濾紙酶酶活力為128.86 U/mL,濾紙酶酶活力比優化前提高49.07%。
纖維素酶;發酵;Plackett-Bumann設計;響應面分析;小刺青霉
纖維素是地球上分布最廣泛、含量最豐富的可再生資源,據不完全統計,全球每年通過光合作用產生的植物生物量高達1.14×1012t[1-2],其中大部分尚未被利用或未被合理利用,目前全世界被開發利用的農林纖維副產物不足2%,我國約有50%以上的農林廢棄物在田間地頭被白白燒掉。這不僅浪費了寶貴的自然資源,而且全世界每年因農林廢棄物焚燒造成的直接經濟損失達數十億元[3-5]。
因此,合理開發和利用這一豐厚的天然資源——纖維素,是世界各國當前研究開發的重點領域[6-8]。如用纖維素酶將纖維素降解為可利用的糖液,再進一步轉化為酒精、菌體蛋白、氣體燃料(如氫氣)等物質,對解決當今世界所面臨的糧食短缺、能源危機和環境污染問題具有深遠的意義[9-10]。目前用于生產纖維素酶的微生物菌種大多都是絲狀真菌,主要為木霉屬、曲霉屬和青霉屬等菌株[11]。
纖維素酶是微生物分解利用纖維素時自身合成的一種胞外酶,酶產量的高低直接影響纖維素利用率。在發酵過程中,纖維素酶的活力大小主要與菌種纖維素酶基因的表達有關,但是同一菌株,通過一定的外部條件優化,可以提高其產酶活力,發酵的工藝條件對產酶的影響也十分重要,以本實驗室篩選保存的小刺青霉(Penicillium spinulosum)16-7為研究對象,設計Plackett-Burman試驗,擬篩選出對纖維素酶發酵最重要的影響因素,結合響應面試驗設計,優化纖維素酶液態發酵工藝條件。
1 材料與方法
1.1 菌種、試劑與培養基
1.1.1 菌種
小刺青霉(Penicillium spinulosum)16-7,云南省大圍山原始森林土壤中篩選,由云南農業大學食品科學技術學院微生物實驗室分離保存。
1.1.2 試劑
羧甲基纖維素鈉(sodium carboxyl methyl cellulose,CMC-Na)(化學純)、3,5-二硝基水楊酸(化學純)國藥集團化學試劑有限公司;酒石酸鉀鈉(分析純)天津市永大化學試劑有限公司;定量濾紙(中速) 杭州富陽特種紙業有限公司。
1.1.3 培養基
種子培養基[11]:CMC-Na 1.5 g/100 mL、NH4NO30.1 g/100 mL、酵母膏0.1 g/100 mL、MgSO4·7H2O 0.05 g/100 mL、KH2PO40.1 g/100 mL,pH值自然,121 ℃滅菌30 min。
液體發酵培養基[11]:1.5 g/100 mL不同碳源、NH4NO30.4 g/100 mL、酵母膏0.4 g/100 mL、MgSO4·7H2O 0.02 g/100 mL、KH2PO40.4 g/100 mL,pH值自然,121 ℃滅菌30 min。
1.2 儀器與設備
HX121-0054立式壓力蒸汽滅菌鍋 上海華線醫用核子儀器有限公司;SHA-BA恒溫振蕩器 常州澳華儀器有限公司;101-2A電熱鼓風干燥箱 北京中興偉業儀器有限公司;SW-CJ-2D超凈工作臺 蘇州凈化設備有限公司;7200型可見分光光度計 尤尼柯(上海)儀器有限公司;DT5-2型低速臺式離心機 北京時代北利離心機有限公司。
1.3 稻草、麩皮預處理
將100 g稻草、麩皮分別置于500 mL的3 g/100 mL氫氧化鈉溶液中混勻,0.15 MPa(126~128 ℃)保溫5 min,放氣[12]后備用。
1.4 培養方法
1.4.1 液體種子培養
將小刺青霉16-7制成孢子懸液(107~108個細胞/mL),按10%的接種量接入到裝有100 mL液體種子培養基的250 mL三角瓶內,置于恒溫搖床中28 ℃、120 r/min振蕩培養3 d。
1.4.2 發酵培養
按照試驗設計,將種子培養液接入發酵培養基進行發酵培養,每組做3 個平行樣。
1.5 分析方法[13-15]
1.5.1 粗酶液的制備
將發酵液在5 000 r/min條件下離心10 min,取上清液作為粗酶液。
1.5.2 羧甲基纖維素酶活力(CMCase activity,CMCA)測定
分別向4 支試管(1 支空白管,3 支樣品管)加入1 g/100 mL CMC-Na溶液(用pH 5.0醋酸-醋酸鈉緩沖溶液配制)2.00 mL,然后加入一定稀釋比例的酶液0.50 mL (空白管不加),混勻。將4 支試管置于50 ℃水浴中反應30 min,迅速向各管加入DNS試劑3.0 mL,再于空白管中加入稀釋好的酶液0.5 mL。將4 支管同時放入沸水浴中,加熱10 min取出。冷卻至室溫,定容至15 mL搖勻,以空白管(對照液)調零,測OD540nm值。酶活力單位采用國際定義方法:以1 mL酶液在1 min內分解底物生成1 μg葡萄糖的酶量定義為1 個酶活力單位(1 U/mL)。
1.5.3 濾紙酶活力(filter paper activity,FPA)的測定
分別向4 支試管(1 支空白管,3 支樣品管),加入50 mg濾紙和pH 5.0醋酸-醋酸鈉緩沖溶液1.5 mL,然后加入一定稀釋比例的酶液0.50 mL(空白管不加),使管內溶液浸沒濾紙,蓋塞。將4 支試管同時置于50 ℃水浴中反應60 min后,立即向各管加入DNS試劑3.0 mL。再于空白管中加入稀釋好的酶液0.50 mL。后續操作同1.5.2節。
1.6 試驗設計
1.6.1 單因素試驗
分別選取碳源、氮源、起始pH值、裝液量、轉速、接種量、培養時間、培養溫度、表面活性劑添加量進行單因素試驗,研究各因素對發酵產纖維素酶的影響。
碳源:首先分別以3 g/100 mL稻草、玉米秸稈、濾紙、葡萄糖、CMC-Na為不同的碳源,然后在確定稻草為最佳碳源基礎上添加不同質量比例的麩皮,確定二者的添加比例以提高碳源利用率;氮源:以0.6 g/100 mL蛋白胨、酵母膏、NH4NO3、NaNO3、(NH4)2SO4及NH4Cl作為不同的氮源,確定最佳氮源后考察不同添加量對產酶的影響;培養基起始pH值:分別設培養基起始pH值為3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5;裝液量:分別盛裝25、50、75、100、125、150 mL液體培養基到250 mL的三角瓶中;搖床轉速:分別設置為100、125、150、175、200、250 r/min;接種量:向產酶培養基中分別加入1%、2%、3%、4%、5%、6%、7%、8%、9%、10%的種子培養液;培養溫度:在26、28、30、32、34 ℃條件下培養;培養時間:分別培養3、4、5、6、7、8、9 d;表面活性劑的添加量:向培養基中分別添加0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL/100 mL的吐溫-80。
1.6.2 Plackett-Burman試驗
Plackett-Burman設計是一種兩水平的試驗設計方法,它基于非完全平衡塊原理,可以用最少試驗次數估計出因素的主效應,適用于從眾多的考察因素中快速有效地篩選出最為重要的幾個因素[16-17]。在單因素試驗的基礎上,以FPA作為響應值,對影響產酶的碳源、氮源、菌種接種量、搖床轉速、裝液量、吐溫-80添加量、初始培養溫度、初始pH值、培養時間9 個影響因素進行篩選,篩選出3 個主效應因子,每個因素選兩個水平,另設3 個虛擬列,以考察實驗誤差,共20 組試驗。
1.6.3 最陡爬坡試驗
最陡爬坡試驗可以達到快速進入最優點附近區域的目的[18]。系統最優條件的初步估計常常遠離實際的最優點,要先采用最陡爬坡試驗設計逼近最佳值區域后才能建立有效的響應面擬合方程[19-21]。以Plackett-Burman試驗的零水平作為最陡爬坡試驗的基礎點,根據Plackett-Burman試驗獲得的3 個主效應因素的比例關系設定步長和上升路徑進行最陡爬坡試驗設計。
1.6.4 響應面試驗設計
采用Box-Behnken法,依據Plackett-Burman試驗和最陡爬坡試驗確定的試驗因素與水平,對纖維素酶發酵條件進行響應面分析試驗,包括12 個析因試驗和5 個中心試驗,共17 組試驗。
2 結果與分析
2.1 單因素試驗
2.1.1 碳源對產纖維素酶的影響

圖1 不同碳源對小刺青霉16-7產纖維素酶的影響Fig.1 Effect of carbon sources on cellulase production
由圖1可知,小刺青霉16-7在以稻草為碳源時酶活力最高(CMCA為244.67 U/mL、FPA為69.55 U/mL),秸稈次之。說明該菌對稻草這類天然纖維素的分解利用能力較強,其中葡萄糖幾乎是所有真菌都喜歡利用的良好碳源,所以酶活力也較高,但產酶能力仍低于天然纖維素,這和很多研究報道的葡萄糖是真菌纖維素酶合成的阻遏物的觀點一致。結果說明,該菌在不同種類的碳源培養基中,產酶能力有很大差別。

圖2 稻草與麩皮質量比對小刺青霉16-7產纖維素酶的影響Fig.2 Effect of rice straw-to-wheat bran ratio on cellulase production
由圖2可知,隨著稻草與麩皮比例的不斷變化,酶活力呈現先增大后減小的趨勢。當稻草與麩皮比為7∶3時,酶活力達到峰值,CMCA為269.83 U/mL,FPA為74.15 U/mL。分析原因可能是麥麩為產酶提供少量的淀粉、粗蛋白、微量元素等營養因子,從而提高菌株的產酶能力;同時,培養基內的初始糖質量濃度可加速誘導菌株產酶,且在一定范圍內,誘導纖維素酶產量是呈正比關系,但如果糖質量濃度過高則會降低酶產量。由此可見,培養基中添加適當比例的麩皮時,對于誘導纖維素酶的形成是有幫助的。但是,隨著麩皮的添加比例不斷增大,會對纖維素酶的形成產生抑制作用,另外過多的麩皮可能會造成培養基的蓬松度降低,通氣性減弱,從而影響纖維素酶的形成。

圖3 稻草-麩皮添加量對小刺青霉16-7產纖維素酶的影響Fig.3 Effect of carbon source concentration on cellulase production
由圖3可知,隨著稻草-麩皮添加量的不斷增大,酶活力呈現先急劇增大,到峰值后緩慢下降的趨勢。當稻草-麩皮添加量為3 g/100 mL時,CMCA和FPA達到峰值,CMCA為281.77 U/mL,FPA為77.09 U/mL。可能是因為適量的稻草-麩皮添加量作為一種誘導劑在表達體系中起作用,過低的糖濃度誘導作用小,延緩產酶期,且菌絲體生長緩慢,而過高的糖質量濃度則會對纖維素酶的形成產生抑制作用。初步確定稻草-麩皮的添加量為3 g/100 mL。
2.1.2 氮源對產纖維素酶的影響

圖4 不同氮源對小刺青霉16-7產纖維素酶的影響Fig.4 Effect of nitrogen sources on cellulase production
由圖4可知,不同氮源對小刺青霉16-7產酶影響的差異較大,其中蛋白胨和酵母膏對產酶有明顯的促進作用,其次為(NH4)2SO4、NH4Cl。結果表明,氮源對酶活力的影響因素依次為:有機氮>銨鹽>硝酸鹽,采用蛋白胨作為氮源時效果最好,CMCA為258.59 U/mL,FPA為69.28 U/mL。

圖5 蛋白胨添加量對小刺青霉16-7產纖維素酶的影響Fig.5 Effect of peptone concentration on cellulase production
由圖5可知,隨著蛋白胨添加量的不斷增大,酶活力呈現先增大后減小的趨勢。當蛋白胨添加量為0.8 g/100 mL時,CMCA和FPA達到峰值,CMCA為282.32 U/mL,FPA為74.29 U/mL。初步確定蛋白胨的添加量為0.8 g/100 mL。
2.1.3 搖床轉速對產纖維素酶的影響

圖6 搖床轉速對小刺青霉16-7產纖維素酶的影響Fig.6 Effect of rotation speed on cellulase production
由圖6可知,當搖床轉速為150 r/min時,酶活力均達到峰值,CMCA為275.41 U/mL,FPA為72.48 U/mL。當搖床轉速從100 r/min增至150 r/min時,小刺青霉16-7纖維素酶酶活力呈增大趨勢;但當轉速超過150 r/min后,產酶水平有所下降,選擇使用150 r/min的轉速比較適合。
搖床轉速主要影響發酵液的溶解氧濃度,目的菌是好氧菌,在生長和產酶過程中要消耗大量的氧,所以在產酶過程中應不斷振蕩來增加發酵液的溶氧濃度,另外適度振蕩還可以增加菌絲與發酵液中營養物質的充分接觸,使菌種能夠獲得充足的營養。由以上結果可以看出,轉速太低可能導致培養基中溶氧不足,影響菌體生長;太高可能由于機械剪切力過大,造成菌絲斷裂,進而影響產酶。
2.1.4 培養時間對產纖維素酶的影響

圖7 培養時間對小刺青霉16-7產纖維素酶的影響Fig.7 Effect of culture time on cellulase production
由圖7可知,培養時間對產酶有較大的影響。當培養時間為3~6 d時,酶活力呈現急劇增大的趨勢;當培養時間為7 d時,酶活力達到頂峰,CMCA為270.68 U/mL,FPA為71.23 U/mL;當培養時間超過7 d時,酶活力呈現緩慢下降的趨勢。
酶的產生需要一個過程,目的菌16-7培養前期處于遲緩期,菌絲體緩慢生長,對環境逐步適應,培養一段時間之后,菌絲體進入對數生長期,菌絲體生長旺盛,隨后進入穩定期,是菌株產生代謝產物的主要階段,產酶量逐步達到最高,這時的培養時間是7 d左右,即目的菌產纖維素酶的最佳培養時期。發酵后期,隨著培養基內可供菌株利用的營養物質的減少,以及代謝產物的積累,菌體步入衰亡期,細胞相繼衰老、死亡,生長繁殖等代謝活動減弱。通過對發酵過程中菌株生長狀況的觀察,發現菌絲體的形態變化與其產酶變化是一致的。
2.1.5 培養溫度對產纖維素酶的影響
由圖8可知,培養溫度對產酶活力具有較大影響。在28 ℃條件下,CMC酶活力和濾紙酶活力均達到最大值,CMCA為270.48 U/mL,FPA為70.92 U/mL。當溫度超過28 ℃,酶活力下降明顯。初步確定目的菌產纖維素酶培養溫度為28 ℃。

圖8 培養溫度對小刺青霉16-7產纖維素酶的影響Fig.8 Effect of culture temperature on cellulase production
在較低溫度26 ℃時,菌株生長緩慢,傳代時間延長,酶活力高峰期出現較晚。當培養溫度為28 ℃時,菌絲體旺盛生長,產酶高峰期提前,酶分泌增多,酶活力增大。但若溫度持續升高,可能造成了菌株過早老化,酶分泌量減少,酶活力逐漸降低。使得參與生化反應的酶系統遭到破壞,直接導致微生物細胞因無法繁殖而死亡。
2.1.6 培養基初始pH值對產纖維素酶的影響

圖9 培養基初始pH值對小刺青霉16-7產纖維素酶的影響Fig.9 Effect of initial pH on cellulase production
由圖9可知,培養基初始pH值對產酶有較明顯的影響,當初始pH值在3.0~5.5時,隨著pH值升高,纖維素酶活性出現上升趨勢;當初始pH值為5.5時,酶活力最高,CMCA為286.54 U/mL,FPA為75.41 U/mL;當初始pH值大于5.5后,酶活力逐步下降。初步確定目的菌產纖維素酶初始pH值為5.5。這與大多數真菌適宜在中性偏酸性的環境中生長相符。
2.1.7 接種量對產纖維素酶的影響

圖10 接種量對小刺青霉16-7產纖維素酶的影響Fig.10 Effect of inoculum size on cellulase production
由圖10可知,接種量對產酶效果影響較為明顯,接種量為1%~4%時,酶活力較小;當到5%時,產酶水平達到峰值,CMCA為294.35 U/mL,FPA為77.46 U/mL;超過5%以后,產酶水平有所下降,而在6%~8%,產酶較為穩定;當接種量大于8%,酶活力迅速下降。
接種量過小時,營養過剩,菌絲體劇烈生長,產酶滯后,產酶活力不高,延長生長周期;接種量過大時,第一,影響產酶培養基的透氣性,從而使得酶活力降低;第二,發酵前期菌株生長迅速,培養基溫度升高,抑制產酶能力;其三,菌株生長過密,發酵后期營養供給不足,競爭增強,抑制菌株生長。
2.1.8 裝液量對產纖維素酶的影響

圖11 裝液量對小刺青霉16-7產纖維素酶的影響Fig. 11 Effect of liquid medium volume in 250-mL flasks on cellulase production
由圖11可知,250 mL三角瓶裝100 mL培養基能獲得較佳的產酶效果,CMCA為289.56 U/mL,FPA為76.20 U/mL。裝的過多和過少都不利于產酶,裝液量過少,可能會引起搖瓶中的液體培養基晃動厲害,破壞了菌體與纖維素的黏附狀態,且機械剪切力過大,造成菌絲斷裂,進而影響產酶,但隨著裝液量超過100 mL,產酶水平也逐漸下降,這可能是由于供氧不足且在液體攪動過程中菌體不能和營養物質充分接觸,不利于目的菌的生長。
2.1.9 吐溫-80添加量對產纖維素酶的影響

圖12 吐溫-80添加量對小刺青霉16-7產纖維素酶的影響Fig.12 Effect of Tween-80 addition on cellulase production
由圖12可知,吐溫-80對產酶能力的影響較小。添加表面活性劑吐溫-80能在一定程度上提高纖維素酶活力,添加量為0.6 mL/100 mL時酶活力達到峰值,CMCA為281.45 U/mL,FPA為74.07 U/mL。CMCA是未添加時的1.21 倍,濾紙酶酶活力是未添加時的1.23倍,再增加用量酶活力開始下降,這可能是因為表面活性劑加入過多可能會引起蛋白質變性,進而使酶活力降低。同樣,添加量過低則起不到作用,添加量為0.2 mL/100 mL時的酶活力與未添加時相差不大。因此,添加表面活性劑控制在合適范圍內,將有利于提高產酶能力。針對小刺青霉株16-7,本實驗采用0.6 mL/100 mL的吐溫-80添加量較為合適。
2.2 Plackett-Burman試驗

表1 Plackett-Burman試驗設計及結果Table 1 Plackett-Burman experimental design and results

表2 Plackett-Burman試驗統計分析Table 2 Statistical analysis of the Plaekett-Burman experimental results
Plackett-Burman試驗設計與結果如表1所示,統計分析見表2,滿足“Prob>F”小于0.05的3 個因素(碳源、培養溫度、培養時間)是顯著的,可考慮作為主要因素進一步做響應面試驗。而其他因素的取值則根據各因素效應的正負和大小,正效應因素均取較高值,負效應因素均取較低值,即選擇蛋白胨添加量1.2 g/100 mL、搖床轉速150 r/min、pH 5.5、裝液量100 mL/250 mL、接種量7.5%、吐溫-80添加量為0.6 mL/100 mL。方差分析見表3,主效應“Prob>F”等于0.012,說明模型與試驗值擬合良好。

表3 Plackett- Burman試驗方差分析Table 3 Variance analysis of the Plaekett-Burman experimental results
2.3 最陡爬坡試驗
根據Plackett-Burman試驗獲得的3 個主效因素的比例關系設定步長和上升路徑,其中培養溫度有顯著正效應,應增加;稻草-麩皮添加量和培養時間有顯著負效應,應減小。進行最陡爬坡試驗,試驗設計及結果見表4。最優條件出現在試驗2,因此以該處理條件為中心點進行下一步響應面優化試驗。

表4 最陡爬坡試驗設計及結果Table 4 The response values of steepest ascent path
2.4 響應面試驗設計及結果
2.4.1 模型的建立
以FPA為響應值,根據表4的結果擬定試驗因素水平與結果見表5,用Design Expert軟件進行多元回歸分析。經回歸擬合后,試驗因素對響應值的影響可以用以下回歸方程表示:Y=132.25-2.03A+1.44B+1.99C+ 0.75AB-2.20AC+1.13BC-10.48A2-6.64B2-12.38C2。

表5 Box-Benhnken試驗設計與結果Table 5 Box-Benhnken Experimental design and results

表6 響應面二次回歸模型方差分析Table 6 ANOVA for the response surface quadratic model
由表6可知,所選模型的不同處理間差異極顯著(P<0.000 1),說明用回歸方程描述各因素與響應值之間的關系時,其應變量與全體自變量之間的線性關系顯著,即該試驗方法可靠。失擬項P=0.143 8>0.05,差異不顯著,說明試驗的誤差等偶然因素不會對試驗結果帶來顯著影響,該方程對試驗擬合情況好,試驗誤差小。
該方程的決定系數R2=98.85%,說明模型可以解釋98.85%的試驗所得的產酶變化,表示方程擬合度良好。變異系數表示試驗的精確度,變異系數值越低則試驗的可靠性越高,本試驗變異系數=1.35%,僅有1.35%的響應值變異不能用該模型解釋,說明試驗操作可信。
2.4.2 響應面圖和等高線圖分析
模型的三維響應面圖和等高線圖能比較直觀地解釋各變量和變量之間對響應值的影響。根據上述回歸方程繪制出響應面圖和等高圖,見圖13~15。利用該圖可以將其3 個變量中的1 個變量固定在中心值水平,而對另外2 個變量交互影響FPA的效應進行分析與評價。

圖13 碳源添加量和培養溫度對纖維素酶產量影響的響應等高線圖和響應面圖Fig.13 Response surface and contour plots for the effects of carbon source concentration and culture temperature on cellulase production
由圖13可知,在培養時間保持固定的情況下,稻草-麩皮添加量(A)和培養溫度(B)對FPA的影響。等高圖近圓形,且等高線較疏,表明此兩因素的交互作用不顯著。響應面立體分析圖開口向下,當響應值增大到極值以后,隨著各因素的增大,響應值逐漸減小。當稻草-麩皮添加量在3.25~3.75 g/100 mL、培養溫度在26.5~27.5 ℃時,可得到FPA的最大值。

圖14 碳源添加量和培養時間對纖維素酶產量影響的響應等高線圖和響應面圖Fig.14 Response surface and contour plots for the effects of carbon source concentration and culture time on cellulase production
由圖14可知,在培養溫度保持固定的情況下,稻草-麩皮添加量(A)和培養時間(C)對FPA的影響。等高圖呈橢圓形,且等高線較密,可以直觀地看出兩因素的交互作用顯著,同樣從方差分析可知稻草-麩皮添加量(A)和培養溫度(B)交互作用顯著(P=0.028 1)。處于同一曲線上的FPA是一樣的。在橢圓區域的中心FPA最大,由中心向邊緣FPA逐漸降低。響應面立體分析圖開口向下,當響應值增大到極值以后,隨著各因素的增大,響應值逐漸減小。當稻草-麩皮添加量在3.25~3.75 g/100 mL、培養時間在132~156 h時,可得到FPA的最大值。
由圖15可知,在稻草-麩皮添加量保持固定的情況下,培養溫度(B)和培養時間(C)對FPA的影響。等高圖呈橢圓圓形,且等高線較密,但方差分析中兩因素的P=0.201 9,可以得出此培養溫度和培養時間的存在一定交互作用。處于同一曲線上的FPA是一樣的。在橢圓區域的中心FPA最大,由中心向邊緣FPA逐漸降低。響應面立體分析圖開口向下,當響應值增大到極值以后,隨著各因素的增大,響應值逐漸減小。當培養溫度在26.5~27.5 ℃、培養時間在132~156 h時,可得到FPA的最大值。
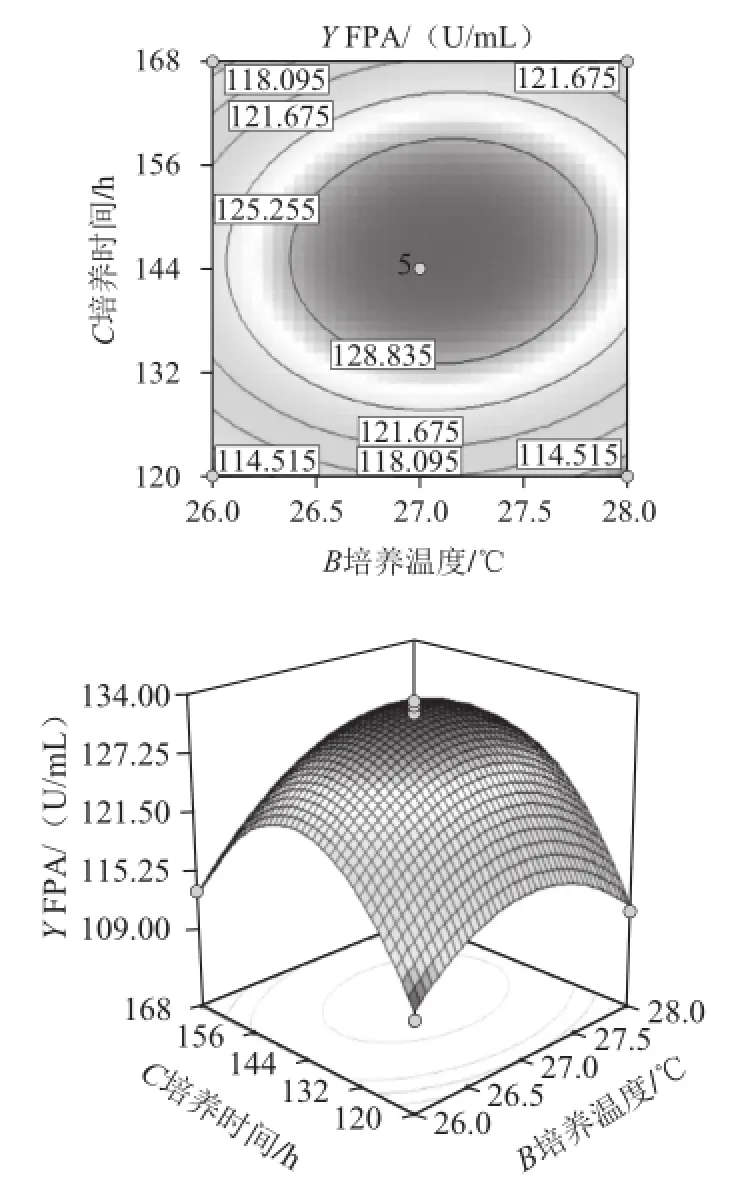
圖15 培養溫度和培養時間對纖維素酶產量影響的響應等高線圖和響應面圖Fig.15 Response surface and contour plots for the effects of culture time and temperature on cellulase production
對模型方程進行典型性分析,結果表明該模型有穩定點,最大值就是穩定點。此回歸模型得出Box-Behnken試驗的最優結果為稻草-麩皮添加量3.45 g/100 mL、培養溫度27.11 ℃、培養時間146.27 h,此條件下FPA為132.53 U/mL。
經過修正,選擇稻草-麩皮添加量3.45 g/100 mL、培養溫度27 ℃、培養時間146 h,進行3 批次發酵驗證實驗,獲得平均FPA為128.86 U/mL ,比優化前平均FPA(86.44 U/mL)提高49.07%。結果與模型預測基本一致,說明模型能夠比較真實地反映各顯著因素對纖維素酶產量的影響,表明所得模型對實驗具有指導意義。
3 結 論
單因素試驗的基礎上,通過Plackett-Burman試驗有效地找出影響纖維素酶產量主要因素,最陡爬坡試驗能充分接近最大響應面區域,再利用Box-Behnken試驗對顯著因素進行優化。得到的發酵最優條件為:稻草-麩皮添加量3.45 g/100 mL、培養溫度27.00 ℃、培養時間146.00 h、蛋白胨添加量1.2 g/100 mL、搖床轉速150 r/min、pH 5.5、裝液量100 mL/250 mL、接種量7.5%、吐溫-80添加量為0.6 mL/100 mL。此條件下測得羧甲基纖維素酶酶活力為387.58 U/mL、濾紙酶酶活力為128.86 U/mL,濾紙酶酶活力比優化前提高49.07%。
參考文獻:
[1] 陳洪章, 李佐虎. 纖維素原料微生物與生物量全利用[J]. 化工科技市場, 2001(5): 17-20.
[2] 鄧天福, 杜開書, 李廣領. 纖維素酶及其在釀造業中的應用[J]. 中國釀造, 2011 , 30(12): 17-19.
[3] SHULER M L. Utilization and recycle of agriculture wastes and residues[M]. Boca Raton, Florida: CRC Press Inc., 1980.
[4] 薛橋麗, 王煒, 胡永金, 等. 堆肥中高溫纖維素酶菌株的篩選及其酶性質研究[J]. 中國釀造, 2012, 31(1): 30-33.
[5] 武林芝. 纖維素酶以及應用行業的研究進展[J]. 安徽農業科學, 2013, 41(26): 10570-10574.
[6] 宋穎琦, 劉睿倩, 楊謙, 等. 纖維素降解菌的篩選及其降解特性的研究[J]. 哈爾濱工業大學學報, 2002, 34(2): 197-200.
[7] 武香玉, 徐海燕, 辛國芹, 等. 纖維素酶及其研究進展[J]. 飼料博覽, 2013(10): 27-29.
[8] 胡格華, 蘇香萍, 潘虹, 等. 纖維素酶產生菌的篩選及產酶條件的研究[J]. 三峽大學學報: 自然科學版, 2013, 35(4): 100-102.
[9] LUTZEN N W, NIELSEN M H, OXENBOELL K M, et a1. Cellulase and their applications in the conversion of lignocellu-loses to fermentable sugars[J]. Philosophical Transactions of the Royal Society, 1983, 300: 283-291.
[10] 傅力, 涂正東, 葉凱. 里氏木霉高產纖維素酶菌株的選育及產酶培養基的優化[J]. 食品與機械, 2009, 25(3): 10-13.
[11] PERSON I, TJERNELD F, HAHN-HǎGERDAL B. Fungal cellulolytic enzyme production: a review[J]. Process Biochemistry, 1991, 26: 65-74.
[12] 葉生梅, 許盼吉, 汪江林. 稻草秸稈的預處理及發酵乙醇的試驗研究[J]. 中國糧油學報, 2008, 35(3): 16-20.
[13] 劉海波, 王義強, 陳介南. 一株高產纖維素酶菌的篩選與鑒定[J]. 生物學雜志, 2008, 25(3): 16-20.
[14] 張瑞萍. 纖維素酶的濾紙酶活和CMC酶活的測定[J]. 印染助劑, 2002, 19(5): 51-53.
[15] MANDELS M, ANEREOTTI R E. Enzymatic hydrolysis of waste cellulose[J]. Biotechnology and Bioengineering, 1976, 6: 17-21.
[16] ZHOU Jiangya, YU Xiaojuan, DING Cong, et a1. Optimization of phenol degradation by Candida tropicalis Z-04 using Plackett-Burman design and response surface methodology[J]. Journal of Environmental Sciences, 2011, 23(1): 22-30.
[17] 潘春梅, 王輝, 任敏. 響應面法優化L-谷氨酰胺發酵培養基的研究[J].生物技術通訊, 2013, 19(4): 528-531.
[18] CHEN Xiaochun, BAI Jianxin, CAO Jiaming, et a1. Medium optimization for the production of cyclicadenosine 3,5-monophosphate by Mierobacterium sp. No.205 using response surface methodology[J]. Bioresource Technology, 2009, 100(2): 919-924.
[19] RATNAM B V V, RAO M D. Optimization of fermentation condtions for the production of ethanol from sago starch using response surface methodology[J]. World Journal of Microbiology and Biotechnology, 2003, 19: 523-526.
[20] BAS D, BOYAEL I H. Modeling and optimization I: usability of response surface methodology[J]. Journal of Food Engineering, 2007, 78: 836-845.
[21] FUNG W Y, WOO Y P, LIONG M T. Optimization of growth of Lactobacillus acidophilus FTCC 09291 and evaluation of growth characteristics in soy whey medium: a response surface methodology approach[J]. Journal of Agricultural and Food Chemistry, 2008. 56: 7910-7918.
Optimization of Cellulase Production by Penicillium spinulosum 16-7 in Liquid-State Fermentation by Response Surface Methodology
LI Yue1, XUE Qiao-li2, LI Shi-jun1, WANG Jing3, HU Yong-jin1,*
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. Library of Yunnan Agricultural University, Kunming 650201, China; 3. Walvax Biotechnology Co. Ltd., Yuxi 653100, China)
This paper reports the optimization of the fermentation conditions for cellulase production by Penicillium spinulosum 16-7 by Plackett-Burman design and response surface methodology using the statistical software Minitab. By using Plackett-Burman design, carbon source (a combination of rice straw and wheat bran at a mass ratio of 7:3) concentration, culture temperature and time were identified as main factors that influence cellulase production. The selected variables were further investigated by steepest ascent analysis and optimized by response surface analysis. The highest cellulase activity was obtained after culture at 27.11 ℃ for 146.27 h at a carbon source concentration of 3.45 g/100 mL, leading to a predicted filter paper activity of 132.53 U/mL. Under the modified fermentation conditions of 3.45 g/100 mL carbon source concentration, 27 ℃ and 146 h, carboxymethyl cellulase activity was 387.58 U/mL and the filter paper activity was 128.86 U/mL, 49.07% higher than that obtained before optimization.
cellulase enzyme; fermentation; Plackett-Bumann design; response surface analysis; Penicillium spinulosum
Q93.33
A
1002-6630(2014)17-0137-09
10.7506/spkx1002-6630-201417028
2014-04-16
國家自然科學基金地區科學基金項目(30960308);云南省自然科學基金項目(2008ZC057M)
李悅(1988—),女,碩士,主要從事食品質量及安全性研究。E-mail:xixiliyue@tom.com
*通信作者:胡永金(1972—),男,教授,博士,主要從事功能性食品與生物技術研究。E-mail:huyjin@126.com

