三氧化二砷聯合熱療對食管癌細胞株EC-1放療的增敏作用研究
谷見法,馮沛貝,路 平
食管癌是我國常見的惡性腫瘤,主要的治療手段是手術和放療。近年來,食管癌的放療取得了長足的進步[1],單純放療的療效已與手術效果相當。但有研究顯示,食管癌患者單純放療后生存期很少能超過3年[2]。這是由于食管癌細胞的放射線抗拒性,同時放療無法控制腫瘤的遠處轉移,從而使局部未控制,導致治療失敗。又因食管周圍毗鄰有心、肺和脊髓等重要臟器,增大照射劑量可使局控率提高,但劑量過大會對患者的這些重要器官造成傷害;同時也存在著諸如遠期療效并不提高、毒性反應較大影響生存質量等問題。因此,尋找有效的放療增敏療法及增敏劑,提高食管癌的放射敏感性及局控率,同時盡量減少對正常組織的損傷[3],成為放療研究的一個熱點。本研究旨在探討三氧化二砷(As2O3)聯合熱療對食管癌放療的增敏作用,現報道如下。
1 材料與方法
1.1 材料
1.1.1 細胞和試劑 人食管癌細胞株EC-1由新鄉醫學院腫瘤反轉錄分子生物學實驗室提供,用含100 U/ml青霉素、100 μg/ml鏈霉素和10%(V/V)胎牛血清的RPMI-1640培養基,于37 ℃、5%二氧化碳(CO2)孵箱中培養。每24 h更換培養液。每48 h傳代1次。As2O3(10 mg/瓶)購自北京雙鷺藥業股份有限公司。
1.1.2 主要儀器 恒溫循環水浴器(HX-1050)(北京博醫康實驗儀器有限公司);電熱恒溫水浴箱(HB3V21,Cu600)(上海醫療器械七廠);恒溫CO2細胞培養箱(英國RSBionch公司);倒置顯微鏡(EE 2000-U)(日本Nikon公司),超凈工作臺(SW-CJ-1F)(蘇州凈化設備有限公司),6 MV電子直線加速器(德國西門子公司),Epics-XLⅡ型流式細胞儀(美國Beckman Coulter公司) ;顯微鏡(日本Olympus公司);OLYMPUS直立光照照相系統(日本Olympus公司)。
1.2 方法
1.2.1 平板克隆形成實驗檢測細胞放射敏感性 實驗分組:單純放療組(R組)、熱療+放療組(HR組)、As2O3+放療組(AR組)、As2O3+熱療+放療組(AHR組)。每個實驗組又接受0、1、2、4、6、8、10 Gy 7種不同劑量的照射。放療均在室溫下照射,電子直線加速器6 MV X線,劑量率為2 Gy/min,照射面積為23 cm×16 cm,源軸距100 cm,培養瓶或培養皿下置1.5 cm組織補償膜,機架角180°,室溫下照射。熱療是將恒溫孵育箱溫度調至43 ℃穩定1晝夜,次日將細胞培養皿瓶口密封后放入恒溫孵育箱中,加熱30 min,熱平衡5 min。加As2O3,藥物濃度根據前期的實驗確定半抑制濃度(IC50),20%IC50為3 μmol/L,作為本實驗藥物濃度,作用時間為48 h。具體方法如下。
取對數生長期生長的EC-1,用胰液常規消化,并吹打成單細胞懸液,計數并按梯度稀釋分別接種于60 mm培養皿中,并使細胞在培養皿中均勻分散。將接種好細胞的60 mm培養皿移入37.5 ℃、5%CO2及99%飽和濕度孵育箱中培養24 h,待細胞貼壁后加入As2O3,繼續放入孵育箱中進行培養24 h。然后將各組細胞培養皿正置,分別給予不同劑量的照射,照射時培養皿周以封口膜封口,照射后行熱療處理,繼續在37 ℃、5%CO2及99%飽和濕度孵育箱中培養24 h,然后棄去含藥物的培養液,換新鮮的不含藥物的培養液,于培養箱內培養14 d。細胞均定期更換培養液。培養14 d后取出60 mm培養皿,棄培養液,PBS緩沖液清滌兩遍,用5 ml甲醇固定15 min。棄固定液,加用Gimsa液染色20 min,流水緩慢洗去染色液后在空氣中干燥,將60 mm培養皿平放置在一張帶網格的透明膠片,計數顯微鏡下>50個細胞的克隆數。每個處理組設3個平行培養皿,重復3次,取平均值。計算細胞存活分數(SF),SF=實驗組每孔克隆數/(每孔細胞種植數×貼壁率)×100%。在半對數坐標上以橫坐標表示放射劑量,縱坐標表示細胞SF的對數值,根據擬合細胞存活曲線,計算出各組平均致死劑量(D0)、準閾劑量(Dq,表示細胞對亞致死損傷的修復能力)、平均致死劑量增敏比(SERD0)、準閾劑量增敏比(SERDq)。
1.2.2 流式細胞儀檢測細胞周期及細胞凋亡率 采用流式細胞儀檢測各組細胞經不同處理后的細胞周期及細胞凋亡率。
1.2.2.1 細胞周期 取指數生長期的EC-1,細胞濃度調整為1×105/ml,接種在6孔培養板上,每組設3個復孔,實驗重復3次,每板3 ml。接種后24 h予以下處理:AR組和AHR組給予3 μmol/L的As2O3,HR組和AHR組熱療予以43 ℃加熱30 min,加藥及熱療后24 h行放療,劑量率為2 Gy/min,照射劑量為2 Gy。處理結束后于37 ℃、5%CO2的培養箱中再培養48 h,消化離心制成單細胞懸液,以冷PBS洗滌2次。1 ml PBS打散離心管中的細胞制成細胞懸液,加入5 μl核糖核酸酶(RNase,10 mg/ml),置37 ℃水浴中消化1 h以去掉RNA,然后馬上放在冰浴中終止消化。加入50 μl碘化丙啶(PI,1 mg/ml),避光染色30 min(4 ℃),400目篩網濾過后,樣品上流式細胞儀于488 nm處檢測細胞DNA含量。每份標本累計分析104個細胞,應用Exppo 32 ADC進行免疫熒光數據分析,用Multicycle AV分析軟件對DNA細胞周期擬合分析。
1.2.2.2 細胞凋亡率 實驗分組與處理同1.2.2.1,收集各組的EC-1,PBS緩沖液洗滌2次,調整細胞濃度為1×106/ml,加入1 ml PI染液,用Single histogram statistic軟件分析細胞凋亡率。
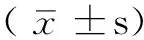
2 結果
2.1 細胞放射敏感性 各組食管癌細胞照射后所形成細胞克隆狀態見圖1,通過單擊多靶模型擬合細胞存活曲線(見圖2),根據擬合的細胞存活曲線以及相關公式,得出放射學相關指標(見表1)。可見HR組、AR組、AHR組細胞SF相對于R組下降,D0、Dq值降低,存活曲線肩區變窄,SERD0分別為1.059、1.286和1.723,SERDq分別為1.917、3.474和11.000。
2.2 細胞周期及細胞凋亡率 經不同處理48 h后各組食管癌細胞株EC-1所占細胞周期比例見表2及圖3,其中HR組、AR組及AHR組G0/G1期、S期細胞比例較R組降低,G2/M期細胞比例較R組增加,差異有統計學意義(P<0.05);AR組G0/G1期細胞比例較HR組降低,差異有統計學意義(P<0.05);AHR組各細胞周期細胞比例與HR組、AR組比較,差異均有統計學意義(P<0.05)。

表1 各組食管癌細胞株EC-1照射后存活曲線的主要指標
注:D0=平均致死劑量,Dq=準閾劑量,N=靶點數,SERD0=平均致死劑量增敏比,SERDq=準閾劑量增敏比;-為無
經不同處理48 h后各組細胞凋亡率見表2,其中HR組、AR組及AHR組細胞凋亡率較R組升高,差異有統計學意義(P<0.05);AHR組細胞凋亡率亦高于HR組、AR組,差異有統計學差異(P<0.05)。


Table 2 Comparison of cell cycles and cell apoptosis rate in each group
注:與R組比較,*P<0.05;與HR組比較,△P<0.05;與AR組比較,☆P<0.05

圖1 不同處理組食管癌細胞株EC-1克隆形成情況

注:R組、HR組、AR組、AHR組平均G2/M期細胞比例分別為17.1%、27.7%、34.1%和58.7%
圖3 各組食管癌細胞株EC-1的細胞周期
Figure3 The cell cycle status in different groups

圖2 各組食管癌細胞株EC-1存活曲線
3 討論
As2O3是中藥砒霜的主要組分,其用于治療疾病已有很長的歷史,但因為其毒性大,并有致畸、致突變及致癌作用,限制了其在臨床上的廣泛使用。20世紀70年代,國內學者開始將主要成分為As2O3的癌靈1號應用在急性早幼粒細胞白血病(APL)的治療中,療效顯著[4]。隨后國內外學者開始進行實體瘤的基礎與臨床研究,逐漸證實As2O3對口腔癌[5]、肺癌[6]、纖維肉瘤[7]、惡性膠質瘤[8]、肝癌[9-10]等實體瘤的放療增敏作用。在食管癌放療增敏方面,景紹武等[11]發現As2O3能增加放療對食管癌細胞株Eca109增殖的抑制作用,進一步研究發現As2O3能影響Eca109細胞周期,誘導細胞凋亡,以此來增強放射線對細胞的殺傷作用。
熱療是通過加熱使腫瘤組織的溫度達到40~44 ℃,從而引起腫瘤細胞生長阻滯或死亡的一種治療方式。許多研究證實,熱療能對腦膠質瘤[12]、宮頸癌[13]、鼻咽癌[14]、肺癌[15]的放療增敏[16]。我國在20世紀80年代開始將熱療應用于食管癌的治療。郭可鋒等[17]在中晚期食管癌研究中發現熱療聯合放療的近期療效(95.8%)明顯優于單純放療(70.8%)。其他研究也發現熱療聯合放療治療食管癌的療效明顯優于單純放療[18-19]。故本研究旨在探討As2O3聯合熱療對食管癌放療的增敏作用。
3.1 As2O3、熱療對放療的增敏效果分析 本研究根據單擊多靶模型公式進行4組人食管癌細胞株EC-1放射-生存曲線的擬合比較后發現,ARH組經過As2O3、熱療作用后的細胞D0、Dq、N均減小,提示As2O3能對人食管癌細胞株EC-1放療增敏(SERD0=1.286,SERDq=3.474),熱療也能對人食管癌細胞株EC-1放療增敏(SERD0=1.059,SERDq=1.917),而As2O3聯合熱療后能進一步增強對人食管癌細胞株EC-1放療增敏作用(SERD0=1.723,SERDq=11.000)。提示經As2O3、熱療單獨作用后,人食管癌細胞株EC-1對放療的D0較單純放療降低,肩區縮小,細胞亞致死性損傷修復能力減弱;兩者聯合作用后對人食管癌細胞株EC-1放療增敏作用明顯增加,對放療的D0進一步降低,肩區更顯著縮小,細胞亞致死性損傷修復能力進一步減弱。
3.2 As2O3、熱療的放療增敏機制探討 目前提高腫瘤放療敏感性的方法主要有:(1)增加對腫瘤細胞DNA損傷或延緩、阻滯損傷的DNA修復;(2)將細胞主要阻滯于G2/M期,從而改變細胞周期分布;(3)使癌基因失活或抑癌基因復活等[20]。
本實驗對As2O3、熱療放療增敏機制進行了研究。通過流式細胞術檢測細胞周期及細胞凋亡率,結果顯示:HR組、AR組細胞G0/G1期、S期比例較R組降低,G2/M期比例較R組升高,說明無論是熱療還是As2O3,均能促使細胞周期阻滯在G2/M期,G0/G1期比例降低,與李嵐等[21]在胃癌BGC-823細胞中研究結果一致。但也有研究報道,As2O3作用于多發性骨髓瘤細胞后細胞周期阻滯在G2/M期及G1期,這可能與細胞系不同有關[22]。As2O3聯合熱療使對放射敏感的G2/M期細胞比例進一步升高(58.7%),對放射不敏感的S期細胞比例進一步減少,但降幅不大,最低才降至26.2%。可能原因是As2O3、熱療聯合放療后,細胞周期抑制基因p57表達顯著上調,而細胞周期促進基因cyclinB的表達受到明顯下調所致[22]。
此外,本研究還發現As2O3、熱療均可增加放射線誘導的細胞凋亡率,而兩者聯合后使放射線誘導的細胞凋亡更加明顯,但細胞凋亡率最高才達3.72%,遠低于劉敩等[23]用3 μg/ml的As2O3聯合熱療作用于肝癌24 h的細胞凋亡率18.6%。此外,在做細胞周期分析時發現,As2O3、熱療聯合放療后G0/G1期細胞比例降至最低,平均為15.1%。細胞受到DNA損傷后,p53的激活常會導致G0/G1期停滯,但食管癌細胞株EC-1可能p53基因突變,G0/G1期不受阻滯,甚至促進該期,從而使G0/G1期細胞比例降低,細胞凋亡不明顯,而缺乏p53時則多引起G2/M期停滯。
總之,As2O3、熱療在治療惡性腫瘤中均具有較大的臨床價值。實驗及臨床研究提示As2O3、熱療的抗瘤譜較寬,可抑制多種實體瘤細胞增殖,誘導其凋亡及增加放療敏感性。因此,As2O3、熱療可能為理想的放療增敏劑。本研究提示As2O3、熱療對食管癌細胞株EC-1放療有增敏作用,二者聯合應用增敏作用更明顯,為進一步的動物實驗和臨床試驗提供理論依據并做好了鋪墊,但目前對其作用機制尚不完全明了,有待進一步研究。
1 張佃富,張培良,王玉國,等.食管癌全程三維適形放療后程加速超分割的療效觀察[J].中華腫瘤防治雜志,2010,17(7):521-522,532.
2 邱嶸,王軍,王玉祥,等.三維適形與調強放療治療食管癌的臨床對照研究[J].中華腫瘤防治雜志,2012,19(1):68-71.
3 王堅,盧緒箐,李毅,等.熱療對放射性肺損傷保護作用的實驗研究[J].中華腫瘤防治雜志,2010,17(21):1714-1717.
4 楊紹靈,凌如芳,許志金.全反式維甲酸、三氧化二砷聯合化療治療初治急性早幼粒細胞白血病的臨床觀察[J].疑難病雜志,2010,9(3):194.
5 宿穎,楊慧,張敏,等.三氧化二砷聯合放療對口腔癌移植瘤小鼠治療作用的研究[J].口腔生物醫學,2010,1(4):173-177.
6 郭紅,于洪,王天祿.三氧化二砷對人肺癌A549細胞的放射增敏作用[J].中國腫瘤,2012,21(10):784-786.
7 王維虎,楊偉志,李曄雄.三氧化二砷對纖維肉瘤細胞放射增敏作用的研究[J].中華放射腫瘤學雜志,2006,15(6):448-451.
8 黃輝,蔣宏玲,劉芬菊,等.60Coγ射線照射聯合三氧化二砷對人腦膠質瘤SHG44細胞DNA損傷的研究[J].現代中西醫結合雜志,2012,21(12):1274-1276.
9 余桂芳,嚴躍紅,陳益民.三氧化二砷對人肝癌細胞生長及其侵襲轉移能力的影響[J].疑難病雜志,2011,10(4):293.
10 孫秉賦,張博,欒明翰.三氧化二砷聯合氟尿嘧啶對人肝癌SMMC-7721細胞Bcl-2和Bax表達的影響[J].中國煤炭工業醫學雜志,2013,16(11):1861-1863.
11 景紹武,王雅立,吳風鵬,等.三氧化二砷與放射線聯合對食管癌細胞株Eca109的增敏作用及機制[J].腫瘤防治研究,2011,38(6):620-623.
12 唐知己,章文斌,張銳,等.125I近距離放療聯合熱療對人膠質瘤細胞毒性的研究[J].臨床神經外科雜,2010,7(1):14-16.
13 董軍蘭,姚潔.同步放化療聯合深部熱療治療中晚期宮頸癌的臨床療效觀察[J].生物醫學工程進展,2011,32(4):233-235.
14 馬姍姍,王仁生,肖帥,等.鼻咽癌熱療療效的系統評價[J].中華腫瘤防治雜志,2011,18(4):288-291.
15 諶龍,孫娟,馬春峰,等.非小細胞肺癌放療聯合體外高頻熱療80例療效觀察[J].中國現代藥物應用,2012,6(18):46-47.
16 張佳慧,秦麗娟.腫瘤熱療的研究進展[J].實用心腦肺血管病雜志,2012,20(9):1424.
17 郭可鋒,柳玉華,李宗民.三維適形放療聯合射頻熱療治療中晚期食管癌的療效觀察[J].實用癌癥雜志,2011,26(1):67-77.
18 李征,米登海,楊克虎,等.放療聯合熱療治療食管癌的Meta分析[J].中華腫瘤防治雜志,2012,19(9):671-675.
19 諶龍,馬春峰,孫娟,等.食管癌放療聯合體外高頻熱療40例療效觀察[J].中國煤炭工業醫學雜志,2012,15(9):1348-1349.
20 梁克.腫瘤分子生物放射生物學研究進展[M]//殷蔚伯.腫瘤放射治療學.3版.北京:北京醫科大學中國協和醫科大學聯合出版社,2002:430-432.
21 李嵐,張敬東,劉云鵬,等.三氧化二砷對胃癌BGC-823細胞增殖及細胞周期的影響[J].腫瘤學雜志,2008,14(3):190-192.
22 Park WH,Seol JG,Kim ES,et al.Arsenic trioxide-mediated growth inhibition in MC/Car myeloma cells via cell cycle arrest in association with induction of cyclin-dependent kinase inhibitor,p21,and apoptosis[J].Cancer Res,2000,60(11):3065-3071.
23 劉敩,夏軼男,張暉.三氧化二砷聯合熱療Hep-2細胞周期進程及凋亡率的影響[J].老年醫學雜志,2012,32(4):753-754.

