多巴胺激動D1受體在戊四氮誘導大鼠癲癇發作中促驚厥作用的研究
王偉文,廖曉陽,王 建,楊正輝,劉 榆
癲癇是一種因大腦局部神經元過度興奮而導致的異常放電及臨床發作為特征的病理狀況。紋狀體、海馬是與癲癇發作密切相關的主要結構,而多巴胺在其中扮演著重要角色[1-2]。抗精神病藥物(D2受體阻斷劑)所導致個體發生癲癇的易患性增高應該與多巴胺的作用有關[3]。致癇藥物戊四氮(PTZ)常被用于誘導成年大鼠全身性癲癇持續狀態(SE)模型的制作。然而,迄今為止關于多巴胺及其相應受體在PTZ誘導的癲癇模型中是起抑制作用還是激動作用尚不清楚。即刻早期基因產物Fos在神經元的表達能充分反映活性神經元的分布,因此多年以來就被研究者廣泛用作標記活性神經元的標記物[4]。另有研究結果提示,Fos在化學藥物誘導的癲癇模型中表達數量與癲癇發作嚴重程度呈正相關[5]。本研究是在重復給予低劑量PTZ誘導的大鼠SE模型中,通過給予多巴胺選擇性地激動D1受體或用SCH23900選擇性地阻斷D1受體后對誘導大鼠相同癲癇發作分級所需PTZ劑量的比較及與前腦Fos表達的半定量檢測的聯系來進一步明確多巴胺及其受體在癲癇發作中所扮演的角色。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 二級健康雄性SD大鼠40只,體質量210~240 g,購于四川大學華西醫院實驗動物中心。
1.1.2 實驗藥品 PTZ和SCH23900(D1受體阻斷劑)購于英國Sigma公司,左旋多巴(L-Dopamine)和舒必利(sulpiride,D2受體阻滯劑)購于上海醫藥集團股份有限公司。
1.1.3 實驗儀器 顯微鏡由日本奧林巴斯公司生產。
1.2 方法
1.2.1 實驗動物分組 按照隨機數字表法將大鼠分為3個實驗組和1個對照組,每組10只。(1) PTZ組大鼠僅接受重復低劑量的PTZ誘導SE發作,發作2 h后處死;(2) LSP組大鼠首先接受舒必利(20 mg/kg)腹腔注射,15 min后再被給予左旋多巴(50 mg/kg)腹腔注射,15 min后接受重復低劑量的PTZ誘導SE發作,發作2 h后處死;(3) LSSP組大鼠首先接受舒必利(20 mg/kg)+SCH23990(0.75 mg/kg)腹腔注射,15 min后再接受左旋多巴(50 mg/kg)腹腔注射,15 min接受重復低劑量的PTZ誘導SE發作,發作2 h后處死;(4)對照組大鼠接受與PTZ組相同次數相同體積的0.9%氯化鈉溶液注射,并在注射完畢2 h后處死。
1.2.2 癲癇模型的制備及發作分級尺度的建立
1.2.2.1 癲癇模型制備 各實驗組大鼠均接受重復低劑量的PTZ腹腔注射誘導SE發作。注射方案:首劑按20 mg/kg PTZ腹腔注射,然后每間隔10 min按10 mg/kgPTZ腹腔注射直至SE發生。SE發作特征:大鼠出現連續的強直跌倒發作,時間10~15 s;而后幾分鐘反復出現頭、頸、軀干及四肢的陣攣性發作[7]。大鼠在SE發作后被放回溫暖(20 ℃)、安靜環境中飼養,在發作2 h后處死[6]。
本文創新點——紋狀體、海馬是與癲癇發作密切相關的大腦結構,而多巴胺在其中扮演著重要角色。以往的實驗性癲癇模型中,多巴胺對癲癇發作的發生、發展是起促進作用還是抑制作用尚存在爭議。而關于多巴胺及其相應受體在戊四氮誘導的癲癇模型中所起的作用尚不清楚。本研究是在重復給予低劑量戊四氮誘導的大鼠全身性癲癇持續狀態(SE)模型中,通過給予多巴胺選擇性地激動D1受體或用SCH23900選擇性地阻斷D1受體后對誘導大鼠癲癇發作各分級所需戊四氮劑量的比較及其與前腦Fos表達的半定量檢測的聯系分析,從行為學觀察和形態學檢測來進一步明確多巴胺及其受體在癲癇發作中所扮演的角色。結果提示:多巴胺激動D1受體對戊四氮誘導的SE發作有促驚厥作用,并貫穿于癲癇的發生、發展的全過程。
1.2.2.2 發作分級尺度的建立 大鼠SE發作嚴重程度根據Raccine制定標準來分級[7],即:0級,無反應;1級,耳、面部顫搐;2級,全身性波浪狀痙攣;3級,肌陣攣性抽搐或后肢抽搐及豎尾;4級,向一側傾倒;5級,軀體翻轉伴全身性陣攣-強直性發作。每次PTZ腹腔注射后,記錄注射間隔期10 min內的最高發作分級。
1.2.3 切片制備 大鼠經1%戊巴比妥鈉(40 mg/kg)腹腔注射深度麻醉后,予以左心室至升主動脈插管,含40 g/L多聚甲醛的0.1 mol/L磷酸緩沖液(PB,pH 7.4)灌流固定,腦組織在冷凍切片機上行全腦連續冠狀切片,收集25 μm厚的組織切片用于免疫組織化學染色。
1.2.4 免疫組織化學染色 各實驗組大鼠全腦系列切片行免疫組織化學染色(ABC法),首先一抗(兔抗Fos,Vector,1∶8 000) 4 ℃孵育48 h;其次二抗(驢抗兔生物素標記的IgG,Check,1∶500)室溫孵育8 h;最后ABC復合物(Vector,1∶500)室溫下孵育2 h,DAB-葡萄糖氧化酶-硫酸鎳胺加強法呈色反應20~30 min,組織切片上可見藍色的陽性產物,切片經晾干、脫水、透明后封片。在Olympus BX-60顯微鏡下分析觀察結果,并采集圖像。對照組中用正常兔血清替代一抗,余染色步驟同前。
1.2.5 數據分析 各組誘導不同程度癲癇發作所用PTZ累積劑量,計算平均數。免疫組織化學染色觀察各組位于大鼠皮質、海馬和紋狀體區域的陽性Fos神經元,每只大鼠每個區域挑選8~10張切片(雙側)用以計數。

2 結果
2.1 PTZ組、LSP組、LSSP組誘導不同程度癲癇發作所用PTZ累積劑量比較 PTZ組、LSP組、LSSP組誘導不同程度癲癇發作所用PTZ累積劑量比較,差異均有統計學意義(P<0.05);其中LSP組較PTZ組和LSSP組用量降低,差異均有統計學意義(P<0.05);PTZ組與LSSP組比較,差異均無統計學意義(P>0.05)。3組組內比較,誘導不同級別的癲癇發作所用PTZ累積劑量間差異均有統計學意義(P<0.05);不同癲癇發作分級間兩兩比較,差異均有統計學意義(P<0.05,見表1)。對照組大鼠均無癲癇發作。
2.2 Fos在大鼠皮質、海馬及紋狀體區域的表達 SE發作2 h后,中-高密集度的Fos在大鼠前腦區域廣泛表達,藍黑色的陽性Fos圓形產物均獨特地定位于細胞核上(見圖1a′,b′,c′)。在皮質,Fos主要表達分布于Ⅱ、Ⅲ、Ⅴ層(見圖1a);而在海馬的CA2、CA3及齒狀回區是Fos表達的密集區(見圖1b);在紋狀體Fos呈中等密集度地分布于尾殼核的背內側部(見圖1c)。
2.3 PTZ組、LSP組、LSSP組Fos在皮質、海馬及紋狀體表達數量比較 SE發作2 h后,PTZ組、LSP組、LSSP組Fos在皮質、海馬及紋狀體表達數量比較,差異均無統計學意義(P>0.05,見表2)。
3 討論
本研究結果顯示,在重復給予低劑量PTZ所誘導的大鼠SE模型中,誘導不同癲癇發作分級與所用PTZ累積劑量間存在著劑量依賴關系。誘導癲癇發作分級越高,所需PTZ的劑量越大。多巴胺對D1受體的促進作用可以減少誘導同等癲癇發作分級所用PTZ的劑量,多巴胺在PTZ誘導的癲癇模型中具有促進驚厥發作的作用。
以往的實驗性癲癇模型中,多巴胺對癲癇發作的發生、發展是其促進作用還是抑制作用尚存在爭議[8]。如Barone等[9]提出,在顳葉癲癇動物模型中多巴胺對癲癇發作的行為學改變并不明顯,但腦電監測結果顯示有促驚厥作用。本研究結果顯示多巴胺選擇性地激動D1受體對PTZ誘導的大鼠癲癇發作有促進作用。不論是起始階段小劑量PTZ所誘導的輕微發作(1級),還是后續PTZ累積所致的全面強直發作(5級),多巴胺的介入均可使誘導發作的PTZ劑量減低,而D1受體阻滯劑SCH23900可以阻斷這種效應。這一結果從行為學角度提示了多巴胺通過作用D1受體在癲癇的發生、發展過程中的促驚厥作用。

表1 PTZ組、LSP組、LSSP組誘導不同程度癲癇發作所用PTZ累積劑量比較只)
注:與LSP組比較,*P<0.05;與1級比較,△P<0.05;與2級比較,▲P<0.05;與3級比較,☆P<0.05;與4級比較,★P<0.05

注:a皮質(免疫組織化學染色,×40)、a′皮質(免疫組織化學染色,×400),b海馬(免疫組織化學染色,×40)、b′海馬(免疫組織化學染色,×400),c紋狀體(免疫組織化學染色,×40)、c′紋狀體(免疫組織化學染色,×400)
圖1 SE發作2 h后Fos在前腦皮質、海馬和紋狀體的表達分布
Figure1 The distribution of Fos expression in cerebral cortex,hippocampus and corpus striatum at 2 hours after the onset of SE
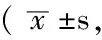
Table2 Comparison of quantity of Fos in cerebral cortex,hippocampus and corpus striatum in PTZ group,LSP group and LSSP group

組別只數皮質海馬紋狀體PTZ組101099±200274±59209±61LSP組101113±230291±63239±53LSSP組101052±215286±43219±50F值013905970413P值087105580666
即刻早期基因產物Fos在神經元的表達能充分反映活性神經元的分布,并且Fos表達的數量在化學藥物誘導的癲癇模型中與癲癇發作的嚴重程度呈正比[10]。長期以來,眾多神經科學者認為紋狀體、海馬是與癲癇活性密切相關的重要結構,但各自在癲癇發作中所扮演的角色尚不清楚。本研究在PTZ誘導的癲癇模型中,通過對Fos在大鼠皮質、海馬及紋狀體表達分布情況分析顯示,在皮質,海馬的CA2、CA3,紋狀體尾殼核的背內側部均有高密集度的表達,這一結果進一步證實了皮質、海馬和紋狀體是癲癇起源、擴展的重要結構組成。因此,多巴胺對D1受體的激動作用同樣對PTZ誘導的Fos表達有促進作用,本結果從形態學角度為多巴胺作用D1受體而參與對癲癇發作的調節提供了又一支持點。
總之,多巴胺激動D1受體在PTZ誘導的大鼠SE模型中,通過對癲癇發作分級及大鼠前腦區域Fos的表達分析結果顯示,無論從行為學還是形態學角度都提示多巴胺激動D1受體對PTZ誘導的SE有促驚厥作用,并貫穿于癲癇發生、發展的全過程。
1 Rektor I,Kuba R,Brázdil M,et al.Do the basal ganglia inhibit seizure activity in temporal lobe epilepsy? [J].Epilepsy Behav,2012,25(1):56-59.
2 Rocha L,Alonso-Vanegas M,Villeda-Hernández J,et al.Dopamine abnormalities in the neocortex of patients with temporal lobe epilepsy[J].Neurobiol Dis,2012,45(1):499-507.
3 Starr MS.The role of dopamine in epilepsy[J].Synapse,1996,22(2):159-194.
4 Szyndler J,Maciejak P,Turzyńska D,et al.Mapping of c-Fos expression in the rat brain during the evolution of pentylenetetrazol-kindled seizures[J].Epilepsy Behav,2009,16(2):216-224.
5 Nehlig A,Pereira de Vasconcelos AP.The model of pentylentetrazol-induced status epilepticus in the immature rat:short- and long-term effects[J].Epilepsy Research,2006,26(1):93-103.
6 Gubits RM,Hazelton JL,Simantov R.Variations in c-fos gene expression during rat brain development[J].Brain Res,1998,427(2):197-202.
7 Erdtmann-Vourliotis M,Riechert U,Mayer P,et al.Pentylenetetrazole(PTZ)-induced c-fos expression in the hippocampus of kindled rats is suppressed by concomitant treatment with naloxone[J].Brain Res,1998,792(2):299-308.
8 Bourne JA,Fosbraey P,Halliday J.SCH 23390 affords protection against soman-evoked seizures in the freely moving guinea-pig:a concomitant neurochemical,electrophysiological and behavioural study[J].Neuropharmacology,2001,40(2):279-288.
9 Barone P,Palma V,De Bartolomeis A,et al.Dopaminergic regulation of epileptic activity[J].Neurochemistry International,1992,20(Suppl):245S-249S.
10 Andre V,Pineau N,Motte JE,et al.Mapping of neuronal networks underlying generalized seizures induced by increasing doses of pentylenetetrazol in the immature and adult rat:A c-Fos immunohistochemical study[J].Eur J Neurosci,1998,10(6):2094-2106.

