免疫功能失調與慢性心力衰竭關系的Meta分析
劉 茂,黃 丹,陳 劍,唐文儀,李松彪,黃穗花,伍 衛
慢性心力衰竭(chronic heart failure,CHF)是一種復雜的臨床癥候群,是各種心血管疾病發展的嚴重階段,具有高發病率、高住院率、高病死率的特點,是嚴重威脅人類健康的疾病之一。在美國,具有心力衰竭表現的成年患者約有510萬人,而且其發病率呈逐年上升趨勢[1]。冠狀動脈性心臟病、心肌炎、高血壓、擴張型心肌病、心包疾病等多種疾病均可通過多種機制導致CHF[1]。近年研究顯示,CHF患者外周血CD4+細胞、CD4+/CD25-調節性T細胞(Treg)比例下降[2-3],CD4+輔助性T細胞17(Th17)比例上調[4],抗β1腎上腺素受體自身抗體陽性率明顯升高[5],表明免疫功能失調和炎性反應激活參與了CHF的發生發展過程[6]。然而,上述研究的樣本量較小,且某些研究結果尚存爭議[7]。為此,本研究納入近年國內外相關文獻,首次對其進行Meta分析,以期系統評價免疫功能失調與CHF的關系,為進一步深入研究以及防治CHF提供循證醫學支持。
1 資料與方法
1.1 文獻納入與排除標準
1.1.1 研究類型 研究CHF患者外周血淋巴細胞(CD4+、CD8+細胞,CD4+CD25+Treg、Th17)比例變化以及抗β1腎上腺素受體自身抗體陽性率的病例對照研究、隊列研究。
1.1.2 研究對象 研究對象至少分為兩組,一組為CHF患者(CHF組),一組為健康對照者(對照組)。排除血液系統疾病、急性感染、急性心血管事件、急性心力衰竭、慢性炎癥性疾病、惡性腫瘤、嚴重肝腎功能異常、自身免疫性疾病患者。若需納入亞組數據,則選擇病例數較多的組別。納入研究的樣本量不少于20例。
1.1.3 檢測指標 各研究需準確記錄至少一項下述指標:CD4+細胞比例、CD8+細胞比例、CD4/CD8比值、Treg比例、Th17比例、Th17/Treg比值、抗β1腎上腺素受體自身抗體陽性率或陽性患者例數。比值按百分數表示,計量資料需報道平均數及標準差。
1.1.4 排除標準 排除動物研究、病例報告、會議摘要、綜述、藥物試驗、中文或英文以外其他語言、無法獲取全文或數據不完整的文獻。
1.2 檢索策略 采用計算機檢索PubMed、EMBase、Cochrane圖書館、萬方數字化期刊數據庫及中國知網數據庫(CNKI),時間設定為建庫起始至2013-11-02。英文檢索詞包括:heart failure、lymphocyte、T cell、Treg、CD4、CD8、autoantibody、antibody;中文檢索詞包括:淋巴細胞、T細胞、CD4、CD8、自身抗體、心力衰竭、心功能不全。聯合使用上述關鍵詞進行檢索。語言限定為英文和中文。對相關文獻的參考文獻行二次檢索以減少漏檢。
1.3 資料提取及質量評價 由2名研究者獨立篩選和閱讀文獻,并提取資料,包括研究類型、第一作者姓名、發表年份、國家、樣本量、平均年齡、性別構成等。質量評價采用病例對照研究的紐卡斯爾渥太華量表(Newcastle-Ottawa scale,NOS)[8]。根據該評分標準,每項研究最高可得9分。資料提取及質量評價過程遇到不一致時,通過討論解決。
1.4 統計學方法 采用Cochrane協作網提供的RevMan 5.1軟件進行統計分析。利用CochraneQ檢驗及I2評價各研究的異質性,當I2<50%時表示各研究間無異質性,采用固定效應模型進行Meta分析;當I2≥50%時表示各研究間存在異質性,采用隨機效應模型進行Meta分析。計算失安全系數(Nfs)評價發表偏倚。原始數據若為計量資料,效應尺度指標采用加權均數差(WMD)及其95%可信區間(CI);原始資料為計數資料,則選擇比值比(OR)及其95%CI。除CochraneQ檢驗采用P<0.1為差異有統計學意義外,其余均定義P<0.05為差異有統計學意義。
2 結果
2.1 納入文獻的基本情況及質量 最初數據庫檢索到原始文獻404篇,剔除重復文獻及閱讀文題、摘要后,排除351篇,粗篩納入53篇。閱讀全文后,最終納入22篇文獻[2-5,7,9-25],文獻檢索流程見圖1。納入文獻的基本情況見表1,其中報道CHF患者外周血淋巴細胞比例變化的文獻共16篇[2-4,7,9-20],報道抗β1腎上腺素受體自身抗體陽性率變化情況的文獻共6篇[5,21-25]。
根據NOS質量評價標準,本研究納入文獻的NOS評分為7~8分(見表1),總體質量相對較高。
2.2 Meta分析結果
2.2.1 淋巴細胞比例變化與CHF的關系
2.2.1.1 外周血CD4+、CD8+細胞比例及CD4/CD8比值的變化 共有9篇文獻[2,7,9-15]報道CHF患者外周血CD4+、CD8+細胞比例及CD4/CD8比值的變化,共732例研究對象。異質性檢驗提示各研究間存在異質性(I2值分別為99%、97%和100%,均P<0.1),故采用隨機效應模型進行Meta分析。結果顯示,CHF組患者外周血CD8+細胞比例較對照組升高〔WMD=5.67,95%CI(0.81,10.53),P<0.05〕,CD4+細胞比例〔WMD=-5.86,95%CI(-15.54,3.82),P>0.05〕及CD4/CD8比值〔WMD=-0.31,95%CI(-1.02,0.41),P>0.05〕與對照組比較差異無統計學意義(見圖2)。
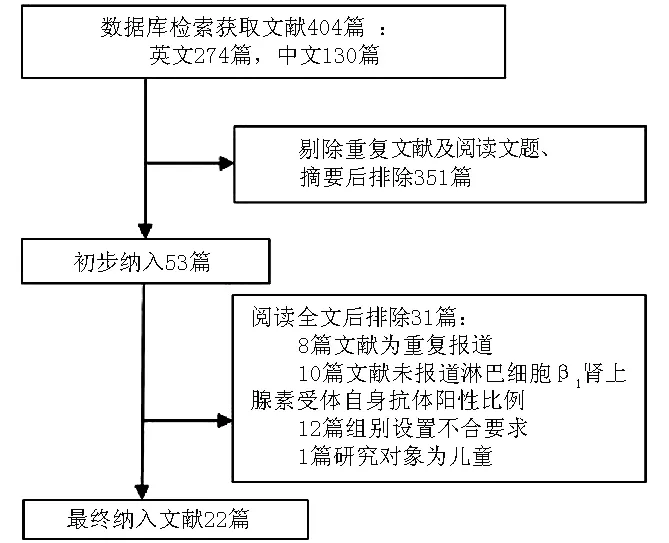
圖1 文獻檢索流程圖
注:CHF=慢性心力衰竭,NOS=紐卡斯爾渥太華量表,NYHA=紐約心臟協會,EF=射血分數,NA=未獲取,ELISA=酶聯免疫吸附試驗,SA-ELISA=鏈霉親合素-酶聯免疫吸附試驗,DM=糖尿病
2.2.1.2 外周血Treg、Th17比例及Th17/Treg比值的變化 共有10篇文獻[3-4,9,14-20]報道了外周血Treg、Th17比例及Th17/Treg比值的變化,共750例研究對象。異質性檢驗提示各研究間存在異質性(I2值分別為87%、78%、50%),故選擇隨機效應模型進行Meta分析。結果顯示,CHF組患者外周血Treg比例較對照組降低〔WMD=-3.14,95%CI(-3.88,-2.40),P<0.05〕,Th17比例〔WMD=2.53,95%CI(1.98,3.08),P<0.05〕及Th17/Treg比值〔WMD=1.06,95%CI(0.75,1.37),P<0.05〕較對照組升高,差異有統計學意義(見圖3)。

圖2 CHF組與對照組外周血CD4+、CD8+細胞比例及CD4/CD8比值比較的森林圖
Figure2 Forest plot of changes of peripheral blood CD4+,CD8+T cells and CD4/CD8in CHF group and control group
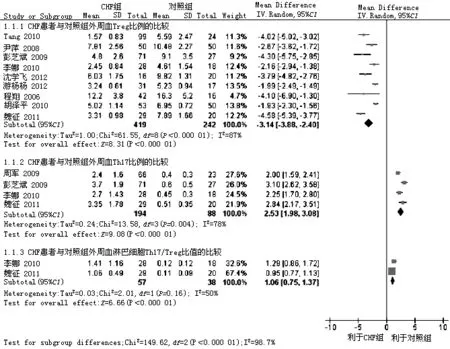
圖3 CHF組與對照組外周血Treg、Th17比例及Th17/Treg比值比較的森林圖
Figure3 Forest plot of changes of peripheral blood Treg,Th17 cells and Th17/Treg in CHF group and control group
2.2.2 血清抗β1腎上腺素受體自身抗體的變化 共有6篇文獻[5,21-25]報道了血清抗β1腎上腺素受體自身抗體的變化,共3 583例受試者,其中CHF組患者2 382例,對照組1 201例。異質性檢驗提示各研究間存在異質性(I2=71%,P<0.1),故選擇隨機效應模型進行Meta分析。結果顯示,CHF組患者血清抗β1腎上腺素受體自身抗體陽性率較對照組升高〔OR=10.70,95%CI(5.39,21.27),P<0.05,見圖4〕。
2.3 發表偏倚 根據公式計算外周血CD4+、CD8+比例變化及外周血Treg、Th17比例變化,兩組數據的Nfs0.05分別為263、1 706,說明至少分別需要263篇、1 706篇陰性報道才能使目前的Meta分析結果失效,可認為本研究的發表偏倚相對較小。

圖4 CHF組與對照組血清抗β1腎上腺素受體自身抗體陽性率比較的森林圖
Figure4 Forest plot of changes of β1receptor autoantibody in CHF group and control group
3 討論
CHF的病理生理機制復雜,近年研究顯示,免疫炎性因素在其疾病過程中發揮了重要作用[26]。T淋巴細胞是人體細胞免疫的主要細胞,根據細胞表面標志不同,外周血成熟的T淋巴細胞可分為CD4+細胞和CD8+細胞兩個亞群。CD4+細胞為輔助性T細胞,CD8+細胞主要為殺傷性細胞,介導細胞免疫。CD4/CD8比值正常為1.5~2.0,其比值下降提示輔助性T細胞受損。根據功能不同,T淋巴細胞又可分為CD4+輔助性T細胞(Th)、CD4+/CD25-Treg、CD8+/CD25-細胞毒性殺傷性T細胞(Tc)等亞群。Th17是一種以分泌IL-17為特點的Th亞群,還可分泌白介素6(IL-6)、腫瘤壞死因子α(TNF-α)等炎性遞質,介導炎性疾病、自身免疫性疾病、腫瘤等疾病的發生、發展[4,27]。Treg的功能主要是抑制免疫細胞活化,對細胞免疫產生負性調節作用。
Cao等[2]比較96例CHF患者與45例健康老人淋巴細胞亞群后發現,CHF患者外周血CD4+細胞比例下降,CD8+細胞比例相對上升,CD4/CD8比值顯著下降,說明CHF患者淋巴細胞亞群失衡、免疫功能紊亂。進一步研究還發現,CHF患者Treg比例較對照組明顯降低,Th17比例升高,Th17/Treg比值明顯升高,且與CHF病情呈正相關[3-4,19]。但同時亦有不一致的研究結果[7,14]。為此,本研究納入相關文獻進行系統評價,結果發現,與健康者比較,CHF患者外周血CD8+細胞比例升高,CD4+細胞比例及CD4/CD8比值差異無統計學意義,僅呈下降趨勢;CHF患者Treg細胞比例降低,Th17比例及Th17/Treg比值升高,說明CHF患者體內呈免疫激活狀態,Th17/Treg失衡參與疾病過程。此外,CHF患者還存在體液免疫異常。在擴張型心肌病所致的CHF患者中,出現抗β1腎上腺素受體自身抗體的比例為30.0%~45.7%,明顯高于健康者或單純高血壓患者[23,28]。本研究納入3 583例受試者進行Meta分析,結果提示CHF患者血清抗β1腎上腺素受體自身抗體陽性率高于健康者,說明體液免疫異常參與了CHF病理生理過程。
本研究的優勢在于首次對免疫因素與CHF關系的相關研究進行匯總分析,系統地表明免疫細胞失調、自身抗體形成等免疫學機制參與了CHF的發展過程。然而,本研究存在一定局限性:首先,研究類型的局限性——納入研究多為回顧性研究,干擾因素較多,總體研究質量一般;其次,存在一定的發表偏倚及限制語種偏倚,檢索語言限制為中文和英文,其他語種的文獻未被納入,亦未納入未發表的文獻;再次,各研究所采用的檢測方法及儀器的敏感度不同,存在一定程度的測量偏倚;最后,納入的研究對象病情程度、種族、年齡、性別構成也存在一定差異,可導致一定的選擇偏倚風險。
綜上所述,CHF患者存在淋巴細胞亞群比例失衡,血清抗β1腎上腺素受體自身抗體生成增加,免疫功能失調與CHF的疾病過程密切相關。
1 Yancy CW,Jessup M,Bozkurt B,et al.2013 ACCF/AHA guideline for the management of heart failure:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2013,62(16):e147-239.
2 Cao XJ,Li YF,Cao FF,et al.Effects of immune modulation therapy on cardiac function in aged patients with chronic heart failure[J].Zhonghua Xin Xue Guan Bing Za Zhi,2010,38(8):734-738.
3 Tang TT,Ding YJ,Liao YH,et al.Defective circulating CD4CD25+Foxp3+CD127(low) regulatory T-cells in patients with chronic heart failure[J].Cell Physiol Biochem,2010,25(4/5):451-458.
4 李娜,邊紅軍,張娟,等.慢性心力衰竭患者外周血中Th17及Treg細胞的檢測及意義[J].山東大學學報:醫學版,2010,48(6):100-103.
5 Baba A,Yoshikawa T,Chino M,et al.Autoantibodies:new upstream targets of paroxysmal atrial fibrillation in patients with congestive heart failure[J].J Cardiol,2002,40(5):217-223.
6 Torre-Amione G.Immune activation in chronic heart failure[J].Am J Cardiol,2005,95(11A):3C-8C,38C-40C.
7 Maisel AS,Knowlton KU,Fowler P,et al.Adrenergic control of circulating lymphocyte subpopulations.Effects of congestive heart failure,dynamic exercise,and terbutaline treatment[J].J Clin Invest,1990,85(2):462-467.
8 Wells GA,Shea B,O′Connell D,et al.The Newcastle-Ottawa Scale(NOS) for assessing the quality of nonrandomised studies in meta-analyses[DB/OL].http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.2014.
9 程翔,廖玉華,鄭金娥,等.慢性心力衰竭患者CD4+CD25+調節性T細胞檢測及意義[J].臨床心血管病雜志,2006,22(3):145-147.
10 劉春生,潘暉,穆展,等.卡維地洛對老年慢性心力衰竭患者外周血T淋巴細胞亞群變化的影響[J].河北醫藥,2011,33(21):3254-3255.
11 王勇,馮毅,朱源生,等.己酮可可堿對缺血性心肌病心力衰竭T淋巴細胞免疫及炎癥因子的影響[J].廣東醫學,2010,31(20):2705-2708.
12 韋方,王丕榮,李琮輝,等.心力衰竭患者免疫調節功能的改變及其與脂質過氧化的關系[J].遵義醫學院學報,2001,24(1):12-14.
13 姚恒臣,李復領,趙宗進,等.充血性心力衰竭患者T淋巴細胞亞群和白介素-6的表達[J].中國全科醫學,2006,9(23):1940-1942.
14 尹萍,盧惠茹,金文敏.老年慢性心力衰竭患者外周血調節性T細胞的表達[J].中國老年保健醫學,2008,6(6):16-17.
15 周軍,賀立群,羅兵,等.慢性心力衰竭患者Th17細胞的檢測及意義[J].實用醫學雜志,2009,25(5):750-752.
16 胡澤平,王邦寧,李嘉嘉.慢性心力衰竭患者外周血CD4+CD25+CD127-調節性T細胞和自然殺傷細胞的變化[J].安徽醫科大學學報,2010,45(1):98-101.
17 彭芝斌,鄧世磊,楊澤敏,等.慢性心力衰竭患者Th17/Treg失衡的研究及其意義[J].華中醫學雜志,2009,33(6):316-318.
18 沈學飛,韓曉云,殷愛民,等.維持性血液透析合并心力衰竭患者血清調節性T細胞與炎性因子的表達及意義[J].中國全科醫學,2012,15(23):2702-2703.
19 魏征,王邦寧,胡澤平,等.慢性心力衰竭患者外周血Th17/Treg失衡的研究及意義[J].中國臨床保健雜志,2011,14(3):254-257.
20 游楊楊,吳繼雄.慢性心力衰竭患者外周血CD4+CD25+CDlow127調節性T細胞的變化[J].山東醫藥,2012,52(5):55-57.
21 Holthoff HP,Zeibig S,Jahns-Boivin V,et al.Detection of anti-β1-AR autoantibodies in heart failure by a cell-based competition ELISA[J].Circ Res,2012,111(6):675-684.
22 Pei J,Li N,Chen J,et al.The predictive values of beta1-adrenergic and M2 muscarinic receptor autoantibodies for sudden cardiac death in patients with chronic heart failure[J].Eur J Heart Fail,2012,14(8):887-894.
23 張麟,胡大一,史旭波,等.心臟β1和M2受體自身抗體與心力衰竭的研究[J].中華內科雜志,2001,40(7):445-447.
24 章浩,許國根,徐遠勝.慢性心力衰竭患者血清β1腎上腺素能受體自身抗體的濃度與心功能的相關性研究[J].中國急救醫學,2008,28(7):597-599.
25 趙林雙,向光大,廖玉華,等.β1受體自身抗體和美托洛爾對糖尿病高血壓患者并發心力衰竭的影響[J].中國糖尿病雜志,2009,17(10):736-739.
26 Candia AM,Villacorta HJ,Mesquita ET.Immune-inflammatory activation in heart failure[J].Arq Bras Cardiol,2007,89(3):183-190,201-208.
27 Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
28 Nagatomo Y,Yoshikawa T,Kohno T,et al.A pilot study on the role of autoantibody targeting the beta1-adrenergic receptor in the response to beta-blocker therapy for congestive heart failure[J].J Card Fail,2009,15(3):224-232.

