原發性肝透明細胞癌的CT及MRI診斷分析
汪國余,黃抒佳,胡明華,陳 超,吳玉林
原發性肝透明細胞癌(primary clear cell carcinoma of the liver,PCCCL)是原發性肝癌的特殊類型,發病率低,臨床表現缺乏特異性,但其預后比其他類型肝細胞性肝癌(HCC)好,因此早期診斷尤為重要。國內有關PCCCL影像學的系統報道較少,本研究收集了7例經病理證實的PCCCL患者完整資料,分析其臨床特點及CT、MRI特征,旨在提高臨床醫生對本病的認識。
1 資料與方法
1.1 一般資料 選取2008年1月—2013年7月我院病理證實的PCCCL患者7例,其中男6例,女1例;年齡為34~66歲,平均44.7歲。5例以上腹部不適、疼痛就診,其中1例伴結腸癌手術史,余2例無明顯臨床癥狀,僅是體檢時發現肝臟占位。4例伴有乙型病毒性肝炎(乙肝)病史,HBsAg(+),未發現丙型肝炎病毒(HCV)感染病例。3例甲胎蛋白(AFP)水平升高,其余患者腫瘤標志物均未見異常。
1.2 方法 7例患者均行上腹部CT平掃加增強掃描,采用GE LightSpeed 16排螺旋CT機,按常規上腹部CT掃描條件掃描,層厚、層距5 mm,先做平掃后用非離子型對比劑優維顯或歐乃派克(300 mgI/ml)100 ml,經肘前靜脈以3 ml/s的速率由高壓注射器注入,注射后25~35 s和60~70 s分別行動脈期、門脈期掃描。
5例患者行上腹部MRI平掃加增強掃描,采用GE Signa HDx 1.5T MRI成像儀和體部相控陣體表線圈,矩陣256×192,掃描前常規行屏氣呼吸訓練。平掃包括橫斷面T2加權像(T2WI)+脂肪抑制(FS)〔重復時間(TR)6 000.0 ms,回波時間(TE)89.0 ms〕,擴散加權成像(DWI)(TR 4 200.0 ms,TE 65.7 ms),擴張敏感系數b值為0、600 s/mm2,T1加權像(T1WI)采用快速擾相梯度回波(FSPGR)成像,包括同相位(TR 185 ms,TE 4.4 ms)/反相位(TR 185 ms,TE 2.2 ms);增強采用三維容積內插快速擾相GRE T1WI(LAVA)序列,對比劑扎噴酸葡胺注射液(馬根維顯,Gd-DTPA)20 ml經肘前靜脈以2 ml/s流速注入,于注射后20、55、90 s進行掃描。
1.3 圖像分析 由2名經驗豐富的主任醫師觀察病灶各時期、序列的CT、MRI表現,主要評價內容包括病灶大小、數目、形態、邊界、密度/信號、腫瘤強化特點。
2 結果
2.1 病灶大小、數目、分布 7例患者均未見明顯肝硬化背景。6例患者為單發病灶,其中右肝4例,左肝2例。病灶直徑為2.2~4.7 cm,平均約3.3 cm。病灶呈圓形或類圓形,病灶邊界清。1例患者為多發病灶,最大病灶直徑約14.7 cm。術前7例患者全部誤診,其中2例誤診為原發性肝癌,2例誤診為轉移瘤,1例誤診為血管瘤,1例誤診為炎性假瘤,1例誤診為肝血管平滑肌脂肪瘤(HAML)。
2.2 CT檢查結果 7例患者病灶均呈相對低密度改變,6例密度不均勻,內伴不規則斑片狀或裂隙狀更低密度區(見圖1A),其中1例病灶內另見斑片狀略高密度影(見圖1B),CT值約48 HU;1例病灶密度尚均勻。CT增強掃描顯示5例病灶動脈期輕度強化,以邊緣強化為主,門脈期持續強化,逐步充填改變(見圖1C、1D),其中1例病灶中央同時出現斑片狀異常強化(見圖1D),1例出現延遲強化包膜,1例肝門部見腫大淋巴結(見圖1D);2例病灶動脈期強化明顯,門脈期未見明顯擴清。所以患者門脈顯影良好,未見充盈缺損。
2.3 MRI檢查結果 T1WI示3例病灶呈稍低信號,信號均勻(見圖2A),反相位信號程度均有下降(見圖2B);2例T1WI病灶信號混雜,內伴斑狀高信號,其中1例反相位序列高信號區信號減低,另1例信號無明顯下降。T2WI示所有病灶呈混雜高信號(見圖2C)。DWI示4例呈高信號(見圖2D),1例呈等信號。
MRI增強掃描顯示3例病灶動脈期輕度強化,邊緣強化明顯,門脈期病灶持續強化,均顯示延遲強化包膜。2例病灶動脈期強化明顯,動脈早期仍顯示從邊緣開始強化,并逐步向中央充填(見圖2E~圖2G);門脈期強化程度無下降,其中1例顯示延遲強化包膜(見圖2G)。所有患者門脈顯影良好。
3 討論
PCCCL是原發性肝癌的一種特殊類型,在臨床上罕見,占原發性肝癌的0.4%~37.0%,目前國際一般以透明細胞在腫瘤組織中所占比例超過30%作為PCCCL的診斷標準,也有學者認為透明細胞所占的比例超過10%既可診斷PCCCL,而國內學者一般以所占比例超過50%為診斷標準,正是由于診斷標準的不同,導致PCCCL發病率統計的差異較大[1]。男女性患者發病率說法不一[2-4]。本組6/7為男性,平均年齡約44.7歲。其臨床表現與原發性肝癌相似,常表現為右上腹痛、不適、乏力等,多伴有較高的乙型肝炎病毒(HBV)感染率。Liu等[1]研究認為,PCCCL患者的HCV感染率明顯高于原發性肝癌,而在年齡、性別、AFP陽性率、HBV感染、肝硬化及病灶數目、位置、大小、腫瘤分級等方面均無明顯差異;但國內李濤等[2]報道的一組大樣本PCCCL患者仍以較高HBV感染率為特點,而HCV感染率僅為2%;王德玲等[5]和付芳芳等[6]都各報道一組病例HBV感染率達到100%,可能以往PCCCL的研究主要來自HCV感染高發的日本及西方國家等,其感染率高達40%,而我國卻是以HBV感染為主,本組病例中4/7有HBV感染史,無HCV感染史。PCCCL腫瘤細胞以細胞胞質內富含糖原或脂肪而呈透明狀為特征,其發生可能與門靜脈血供減少和腫瘤的供血動脈不足所致代謝紊亂和糖代謝異常有關[7],組織學上大多為中高度分化,糖原染色(PAS)幾乎均為陽性,腫瘤旁組織有肝硬化或/和慢性肝炎改變[8]。一般認為透明細胞占癌細胞50%以上時可診斷PCCCL[1,9],占90%以上的病例非常罕見,免疫組化對病理診斷特別重要。AFP水平可以升高。本組7例患者病灶PAS染色均為陽性,其中5例病灶邊緣肝組織有慢性肝炎改變,3例AFP水平升高。PCCCL分化良好,進展緩慢,惡性程度低,特別是包膜的形成有利于對腫瘤生長的限制和手術切除。有研究顯示,術后輔助化療對PCCCL患者的生存時間無明顯作用[10],因此外科手術是治療PCCCL的首選方法;另有學者認為腫瘤內透明細胞所占比例與PCCCL的預后有關,透明細胞所占比例越大,預后越好[9]。
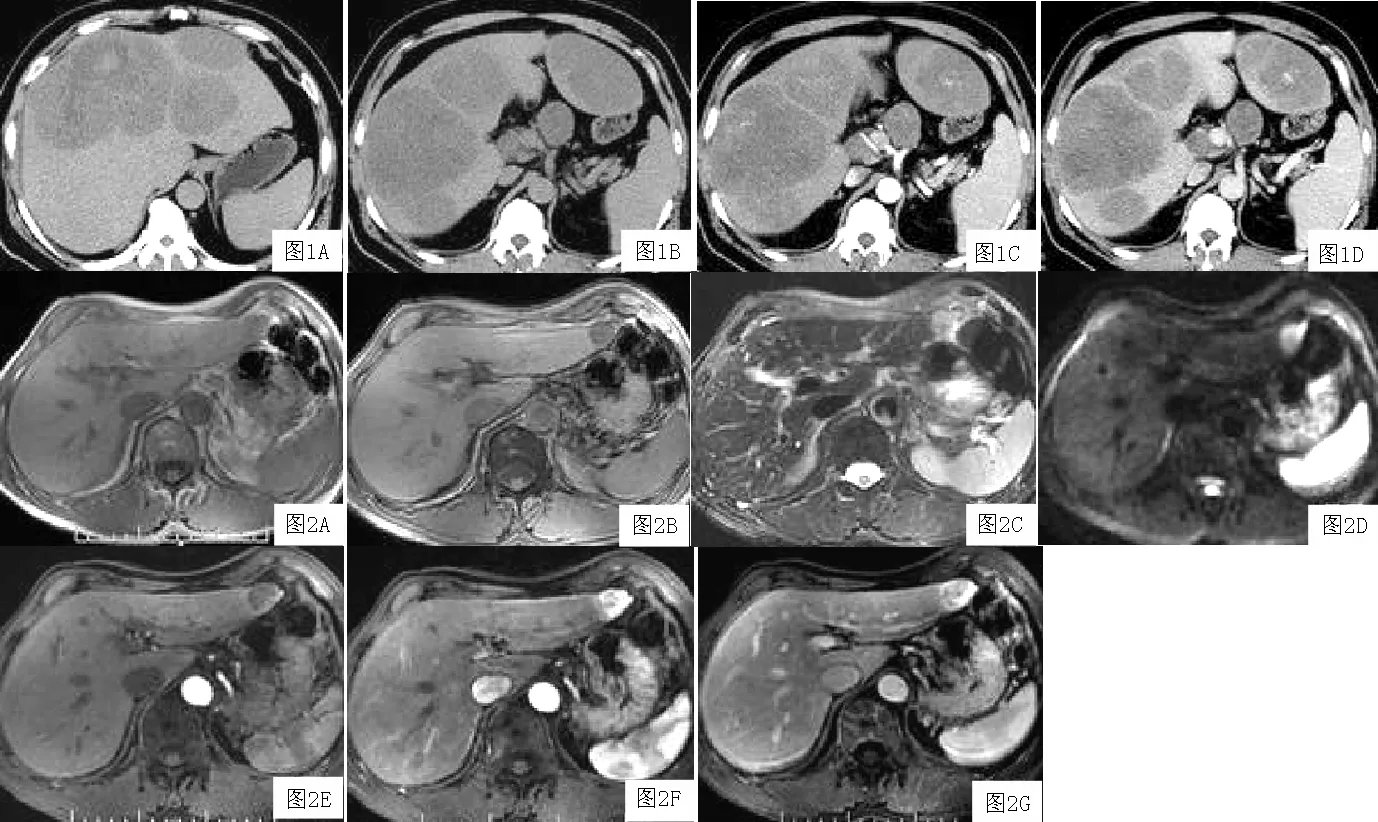
圖1 CT顯示肝內多發占位,呈低密度改變,密度不均,內伴斑片狀更低密度及更高密度區;CT增強掃描顯示輕度持續強化改變,邊緣為著,增加10~15 HU,門脈期見延遲強化包膜,病灶中央另見斑片狀異常強化灶;肝門部伴多發腫大淋巴結
Figure1 Multiple tumors were found with lower and inhomogeneous density,the solid portion of mass enhanced slightly and continually especially the peripheral part of the lesions by 10-15 HU;The rim enhancement of tumor capsule was found,and markedly enhancement was found in the middle of tumor;Lots of big lymph nodes were found in hepatic portal
圖2 MRI顯示左肝外側段小結節灶,T2WI、DWI呈高信號,T1WI呈等低信號改變,反相位病灶信號程度明顯降低;MRI增強掃描強化明顯,動脈期早期顯示仍從病灶邊緣開始強化,延遲期見不完整強化包膜
Figure2 A small tumor was found in left liver by MRI,with high signal on T2WI,DWI and lower signal on T1WI,the signal was reduced obviously on out of phase T1WI.The tumor had obvious enhancement,and starting from the edge of lesions on the arteria1 phase,the rim enhancement of tumor capsule was found
目前對于PCCCL的影像學表現報道較少,國內更是以個案報道為主,且差異較大,缺乏足夠的認識。PCCCL以單發常見,呈類圓形,一般腫瘤體積較小,本組病例6/7者表現為單發較小病灶,直徑2.2~4.7 cm,平均約3.3 cm。CT平掃一般呈相對低密度灶,密度不均勻,部分邊緣可見更低密度區,CT值甚至可達到負值,可能因為腫瘤細胞富含糖原及一定量的脂質成分[11],對提示診斷有一定意義。薄層CT掃描可增加其顯示率:本組1例病灶體積較大(直徑為14.7 cm),多發病灶且伴出血,肝門部淋巴結增大,任洪偉等[12]曾報道過一相似病例。MRI T1WI呈稍低信號或混雜信號,脂抑制或雙回波掃描反相位序列病灶信號存在不同程度降低,診斷意義較大,本組病例4/5者反相位圖像病灶信號程度有所下降,這與腫瘤細胞內富含糖原和存在脂質有關,糖原和脂質可以縮短T1值。由于腫瘤細胞胞質豐富,T2WI、DWI病灶多呈混雜高信號改變,當病灶內脂質成分較多時,T2WI脂抑制信號程度降低,本組1例較小病灶DWI呈等信號改變,可能與病灶內透明細胞所占比例偏少有關。
增強掃描對PCCCL的診斷意義重大,但由于腫瘤內透明細胞所占比例變化較大,因此腫瘤增強掃描后強化特點變化也較大,即透明細胞比例越高,增強掃描病灶強化程度越低,門脈期輕度持續強化。本研究CT增強掃描顯示5/7的病例病灶動脈期輕度強化,以邊緣強化明顯,門脈期病灶持續強化,呈逐步充填改變,但1例病灶中央同時伴小斑片狀異常強化。邱乾德等[13]曾報道一組病例表現出相似的特點,呈“慢進慢出”改變。本組病例2/7者病灶動脈期強化明顯,門脈期未見明顯擴清。MRI容積增強掃描顯示本組病例3/5者病灶動脈期輕度強化,以邊緣為著,門脈期病灶持續強化,逐漸向中央填充;2/5者病灶動脈期全瘤體強化明顯,但動脈早期仍能顯示從邊緣開始強化并逐步向中央填充的特點,所以在對PCCCL診斷時應強調多時期掃描的重要性。門脈期延遲強化的假包膜是PCCCL的另一特征,包膜的形成有利于限制腫瘤的生長和擴散[14],本組7例CT檢查患者中,1例顯示延遲強化包膜;5例MRI檢查患者中,4例顯示延遲強化包膜,其中3例輕度強化病灶均顯示延遲強化包膜,1例強化明顯病灶顯示延遲強化包膜,MRI的顯示率明顯較CT高。王德玲等[5]曾報道一組MRI增強病例全部顯示延遲強化包膜,可能源于MRI軟組織分辨率高,對組織和血流信號高度敏感的原因。相關文獻報道過PCCCL患者可伴門脈癌栓形成[5,12,15],但本組未發現此病例,需進一步論證。
雖然CT和MRI是發現和定性肝臟腫瘤的最好方法,但由于臨床醫生對PCCCL的影像學表現缺乏認識,本組病例術前均被誤診,所以同肝臟其他病變的鑒別就尤為重要。(1)當PCCCL動脈期強化明顯時,與HCC影像學表現有一定相似,且PCCCL也伴有較高的HBV感染率,AFP可陽性,鑒別困難,但是結合T1WI脂抑制、雙回波掃描反相位病灶信號減低以及增強掃描病灶呈邊緣、持續充填的強化特點有一定的鑒別意義,多時期掃描格外重要,但當HCC內含脂肪成分時則鑒別比較困難。(2)PCCCL病灶邊緣持續充填強化的特點與典型肝海綿狀血管瘤存在一定的相似度,肝海綿狀血管瘤是肝臟最常見的良性腫瘤,典型強化方式為動脈期病灶環形或邊緣結節狀強化,門脈期病灶持續強化,向中央充填,但其強化峰值較高,與主動脈內強化程度相近,而且血管瘤邊緣肝組織異常灌注出現概率高[16]。(3)PCCCL還應注意與富含脂肪的HAML鑒別,病灶持續強化是其特點,但病灶中央血管是HAML的另一重要征象[17],鑒別意義較大。
總之,PCCCL的影像學表現相對不典型,變化差異大,但由于腫瘤細胞富含糖原和一定的脂質,CT和MRI檢查可以顯示出其此特征,特別是雙回波掃描和增強多時期掃描的運用,有助于提高該病的術前診斷準確率。
1 Liu Z,Ma W,Li H,et al.Clinicopathological and prognostic features of primary clear cell carcinoma of the liver[J].Hepatol Res,2008,38(3):291-299.
2 李濤,樊嘉,欽倫秀,等.透明細胞型肝癌的臨床病理特點和預后[J].中華普通外科雜志,2012,27(2):96-99.
3 Oliveira AM,Eriekson LA,Burgart LJ,et al.Differentiation of primary and metastatic clear cell tumors in the liver by in situ hybridization for albumin messenger RNA[J].American Journal of Surgical Pathology,2000,24(2):177-182.
4 彭承宏,唐喆,吳育連,等.原發性肝透明細胞癌五例診治分析[J].中華普通外科雜志,2003,18(10):634-635.
5 王德玲,李卉,耿志君,等.原發性肝透明細胞癌的CT、MRI表現[J].中國醫學影像技術,2013,29(4):587-590.
6 付芳芳,沈海林,劉新愛,等.原發性肝臟透明細胞癌的MSCT影像表現分析[J].臨床放射學雜志,2011,30(2):202-205.
7 周梅玲,嚴福華,李清海,等.原發性透明細胞型肝癌的CT和MRI診斷[J].中華放射學雜志,2010,44(9):950-953.
8 Lao XM,Zhang YQ,Jin X,et al.Primary clear cell carcinoma of liver——clinicopathologic features and surgical results of 18 cases[J].Hepatogastroenterology,2006,53(67):128-132.
9 Ji SP,Li Q,Dong H.Therapy and prognostic features of primary clear cell carcinoma of the liver [J].World J Gastroenterol,2010,16(6):764-769.
10 吉勝樸,李強.透明細胞型肝細胞癌的外科治療與預后分析[J].天津醫科大學學報,2010,16(3):495-498.
11 王運韜,倪敏,陳自謙,等.原發性肝透明細胞癌的影像學與臨床病理對照[J].臨床軍醫雜志,2012,40(6):1500-1503.
12 任洪偉,董景輝,郭曉東,等.原發性肝透明細胞癌影像學及臨床分析[J].現代生物學進展,2012,12(16):3120-3125.
13 邱乾德,鄭祥武,孫龍偉,等.透明細胞型原發性肝細胞癌CT表現[J].中華放射學雜志,2009,43(8):890-891.
14 李濤,樊嘉,欽倫秀,等.透明細胞型肝癌術后早期及晚期復發的多因素分析[J].中華肝膽外科雜志,2012,18(8):578-581.
15 馬秀華,薛鵬,肖智博,等.原發性肝透明細胞癌的影像學診斷與臨床應用價值[J].中華肝膽外科雜志,2013,19(7):491-494.
16 譚曄,周誠,楊正漢,等.肝血管瘤周圍灌注異常的多層螺旋CT評價[J].臨床放射學雜志,2008,27(4):476-480.
17 汪國余,陳再智,徐祖良,等.肝臟血管平滑肌脂肪瘤的CT表現[J].影像診斷與介入放射學,2011,20(5):250-253.

