低溫冷凍條件對大豆分離蛋白分散液表面疏水性及二硫鍵的影響
王 玲,朱秀清,李佳棟,許 慧,鄭環宇,吳海波
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.國家大豆工程技術研究中心,黑龍江 哈爾濱 150030)
大豆分離蛋白(soybean protein isolate,SPI)是以低溫脫脂豆粕為原料,經堿提酸沉工藝制取的一種蛋白質含量在90%以上的大豆蛋白產品[1],是一種全價蛋白類食品添加劑。SPI憑其資源豐富,原料成本低等優勢,已廣泛應用于食品行業中。隨著生活節奏的加快和生活水平的不斷提高,一些方便快捷的冷凍食品,如冷凍肉丸、冷凍肉餡等深受人們的喜愛,使得大豆分離蛋白在冷凍食品應用中的市場前景更加廣闊。將SPI添加到冷凍肉制品中,利用SPI自身的功能性質,有利于在加工過程中發揮各種冷凍肉制品的理化性質。但是SPI在冷凍條件下,由于蛋白質分子多肽鏈特有的有規則排列發生變化成為較混亂的排列[2],會發生不可逆的凍結變性[3]。石彥國等[4]研究發現將粉末狀大豆蛋白配制成溶液后進行凍結,并在-1~-3 ℃條件下冷藏,解凍后部分大豆蛋白出現絮狀不融現象;Pikal-Cleland[5]得出在凍藏過程中,蛋白質分子間由于氫鍵、疏水鍵、二硫鍵、鹽鍵等的形成而聚集變性,從而導致鹽溶性蛋白的溶解度下降。大豆蛋白的冷凍變性,直接影響了SPI在冷凍食品中功能性的發揮。因此,研究冷凍過程中蛋白質結構變化,有助于深入了解大豆蛋白的冷凍變性機理,進而可以明確SPI的結構變化對其功能性的影響,無論從理論還是實際來說,都有一定的指導意義。巰基與二硫鍵是維持蛋白質空間結構重要的組成部分[6],通過其含量的變化情況來檢測蛋白質結構變化,是最有效便捷的方法。本實驗結合已有的方法和結果,探討低溫冷凍條件對SPI結構的影響。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白 哈高科大豆食品有限責任公司;β-巰基乙醇(分析純) 美國Amresco公司;三羥甲基氨基甲烷(分析純)、Ellman試劑(優級純)、5,5’-二硫代二硝基苯甲酸鹽(分析純)、1-苯胺基-8-萘磺酸(分析純) 美國Sigma公司。
1.2 儀器與設備
TU-1901雙光束紫外-可見分光光度計 北京普析通用儀器有限公司; BC-169海爾雙王子電冰箱 青島海爾電冰箱股份有限公司;4500型熒光分光光度計 日本日立公司。
1.3 方法
1.3.1 大豆分離蛋白基本成分的測定
蛋白質含量測定:凱氏定氮法(GB/T 5009.5—2010《食品中蛋白質的測定》);粗脂肪含量測定:索氏提取法(GB/T 5512—2008《糧油檢驗 糧食中粗脂肪含量測定》);灰分測定:GB/T 22510—2008《谷物、豆類及副產品灰分含量的測定》;水分測定:GB 5009.3—2010《食品中水分的測定》;粗纖維含量的測定:GB 5009.10—2003《植物類食品中粗纖維的測定》。
1.3.2 大豆分離蛋白冷凍樣品的制備
將干燥的SPI樣品與水以不同比例混合,攪拌均勻后,于室溫下靜置20 min后送入冰箱內冷凍。將冷凍后的SPI,在水中解凍,解凍后的樣品放入鼓風干燥箱中低溫烘干,將烘干后的固體粉碎,制成粉末狀樣品,備用。
1.3.3 巰基和二硫鍵含量的測定
蛋白質的巰基含量的測定,是根據Ellman[7]提出的理論,參照Tang[9]采用的5,5’-二硫代二硝基苯甲酸鹽滴定方法,在412nm波長測定吸光度。按照式(1)計算巰基含量。
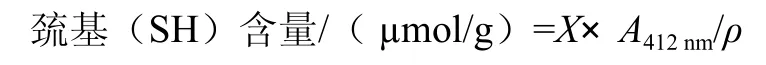
式中:X為摩爾消光系數(73.53);A412nm為溶液在412 nm的波長下測定的吸光度;ρ為樣品的蛋白質質量濃度/(mg/mL)[8]。
暴露巰基是指在SPI未變性的狀態下,埋藏于蛋白分子內部與外界極性環境不相互作用的巰基基團。按照式(2)計算暴露巰基含量和二硫鍵含量。

1.3.4 表面疏水性的測定
采用8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)熒光探針法測定蛋白質表面疏水性[10]。將蛋白質樣品溶于0.01 mol/L、pH 7.0的磷酸緩沖液中,配成質量濃度0.012 5~0.1 g/100 mL的溶液。取一定量的ANS固體,溶于相同的pH 7.0的磷酸緩沖液中,制成8.0 mmol/L的ANS溶液,取25 μL的ANS溶液添加到5 mL的樣品溶液中,避光反應15 min在激發波長390 nm、發射波長490 nm的條件下測定樣品熒光強度,以SPI添加量和熒光強度作圖,斜率即為表面疏水性。
1.3.5 冷凍條件下SPI添加量對SPI巰基、二硫鍵和表面疏水性的影響
在冷凍時間為72 h、冷凍溫度為-18 ℃的條件下,考察冷SPI添加量對SPI的游離巰基、暴露巰基、二硫鍵和表面疏水性的影響。
1.3.6 冷凍溫度對SPI巰基、二硫鍵和表面疏水性的影響
在冷凍時間為72 h、SPI與水質量比為1∶12的條件下,考察冷凍溫度的變化對SPI的游離巰基、暴露巰基、二硫鍵和表面疏水性的影響。
1.3.7 冷凍時間對SPI巰基、二硫鍵和表面疏水性的影響
在冷凍溫度為-18 ℃、SPI與水質量比1∶12的條件下,考察冷凍時間的變化對SPI的游離巰基、暴露巰基、二硫鍵和表面疏水性的影響。
1.4 數據處理及分析
所有數據均通過3次平行實驗得到,采用Microsoft Excel 2010進行數據處理。
2 結果與分析
2.1 大豆分離蛋白的成分
表1 大豆分離蛋白成分分析( ±s)Table 1 Composition analysis of soy protein isolate ( ±s)

表1 大豆分離蛋白成分分析( ±s)Table 1 Composition analysis of soy protein isolate ( ±s)
成分 水分 粗脂肪 蛋白質 灰分 粗纖維含量/% 3.42±0.17 0.07±0.0290.51±0.235.24±0.11 0.26±0.08
由表1可知,SPI的蛋白質含量(干基)可達到90%以上,含量豐富,因此研究蛋白質結構的變化,對提高和改善SPI在食品應用中的功能性具有重要意義。
2.2 冷凍條件下SPI添加量對SPI巰基、二硫鍵和表面疏水性的影響
由圖1可知,隨著SPI添加量的降低,游離巰基逐漸減少,即SPI與水質量比由1∶8降低至1∶16時,此時冷凍后SPI的游離巰基為由5.04 μmol/g減小到2.84 μmol/g,冷凍后的SPI樣品與未冷凍的對照組樣品相比,游離巰基含量均降低。這是由于大豆蛋白中的巰基具有較強的極性,能夠借助氫鍵與分子間相互作用,把極性的水分子吸附到蛋白分子周圍,在冷凍凍結作用下,水分子的氫鍵斷裂,破壞了水分子與巰基之間的平衡作用,游離在蛋白表面的巰基失去依靠,進而轉換為二硫鍵或形成其他作用力[11]。
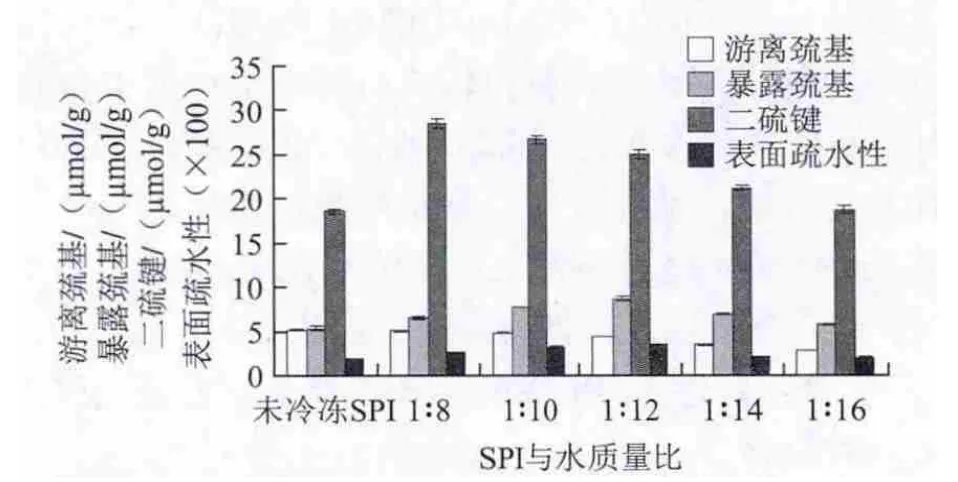
圖1 SPI添加量對SPI巰基、二硫鍵和表面疏水性的影響Fig.1 Effect of SPI/water ratio on the contents of sulfhydryl group and disulfide bond and surface hydrophobic ity of SPI
在冷凍環境下隨著大豆蛋白添加量的逐漸降低,SPI的暴露巰基呈現先增加后減小的變化趨勢,當SPI與水的質量比為1∶8~1∶12時,暴露巰基的含量由6.55 μmol/g增加到8.7 μmol/g,當SPI與水的質量比為1∶12~1∶16時,暴露巰基的含量由8.7 μmol/g減小至5.74 μmol/g。這可能是由于SPI添加量較高時,蛋白分子間的間距較小,臨近的蛋白質之間交織形成復雜的網絡,因冷凍作用暴露出的巰基隱藏在重新形成的蛋白網絡內部[12];當SPI濃度較低時,雖然蛋白肽鏈因冷凍作用而得到充分伸展,內部巰基大量暴露,但SPI添加量低,蛋白分子被水分子嚴密包裹,所以檢測到暴露巰基含量較少。
經過冷凍的大豆蛋白的二硫鍵含量均顯著高于對照組,可以得出冷凍后的SPI結構上主要以二硫鍵的形式存在[13]。隨著大豆蛋白濃度的逐漸降低,二硫鍵的含量也逐漸呈現降低,當SPI與水的質量比為1∶8時,二硫鍵含量為最大值28.54 μmol/g,當SPI與水的質量比為1∶16時,二硫鍵含量最小為18.66 μmol/g。冷凍作用下SPI的游離巰基和暴露巰基減少,是因為在冷凍過程中發生緩慢氧化,巰基形成二硫鍵,導致冷凍后檢測到的二硫鍵含量大于未冷凍的SPI。
疏水相互作用是維持蛋白質三級結構的主要作用力,它對蛋白質結構的穩定性、構象和功能性質具有重要的作用。而表面疏水性由于分子間的相互作用,比整體疏水性對蛋白質功能的影響更大[14]。蛋白質的表面疏水性是與外界極性水環境相連的蛋白質表面疏水性基團數量的一個重要標志[15-16]。隨著SPI添加量的減小,表面疏水性先增加后減小,當SPI與水的質量比為由1∶8減至1∶12時,表面疏水性由257.34增至355.47,當SPI與水的質量比為由1∶12減至1∶16時,表面疏水性又減至200.11。冷凍SPI的表面疏水性均大于對照組SPI,說明冷凍能夠增加SPI的表面疏水性,這與Noh等[17]的結論一致,認為大豆蛋白的氨基酸側鏈疏水性殘基是通過疏水鍵相互結合于蛋白質分子中心,形成疏水性區域,在冷凍變性作用下,蛋白疏水性區域內的氨基酸側鏈疏水性殘基暴露出來,通過ANS熒光檢測,冷凍后的蛋白質分子的熒光強度明顯增強。
2.3 冷凍溫度對SPI巰基、二硫鍵和表面疏水性的影響
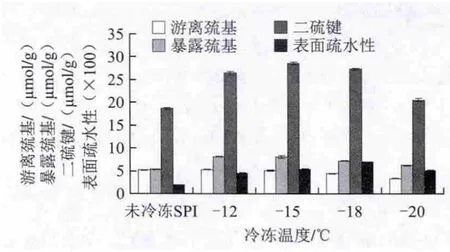
圖2 冷凍溫度對SPI巰基、二硫鍵和表面疏水性的影響Fig.2 Effect of freezing temperature on the contents of sulfhydryl group and disulfide bond and surface hydrophobicity of SPI
由圖2可知,在較高的冷凍溫度下SPI的游離巰基含量較大,與對照組接近,即未冷凍SPI和-12 ℃的游離巰基含量分別為5.17、5.29 μmol/g,隨著冷凍溫度降低,游離巰基的含量越小,與未冷凍SPI之間的差異越大。表明較低的冷凍溫度能夠顯著改變大豆蛋白游離巰基含量[18-19],并且促使游離巰基含量朝著減小的趨勢變化。
在較低冷凍溫度下,不同的冷凍溫度水平對暴露巰基含量的影響差異不顯著(P>0.05),在-12 ℃和-15 ℃時,暴露巰基含量分別為8.13、8.07 μmol/g,而未冷凍SPI的暴露巰基含量為5.35 μmol/g,不同冷凍溫度對暴露巰基含量的影響與對照組之間差異顯著(P<0.05)。
二硫鍵含量的變化趨勢與暴露巰基相同,均大于未冷凍SPI,在-12 ℃和-15 ℃兩個溫度水平上,二硫鍵含量分別為26.42 μmol/g和28.51 μmol/g,明顯大于對照組的18.63 μmol/g,表明冷凍處理能夠有效增加大豆蛋白二硫鍵的含量。
隨著冷凍溫度的降低,SPI的表面疏水性先增加后降低,在-18 ℃時,熒光強度最強,表面疏水性最大。-12 ℃時表面疏水性較小,其原因是冷凍作用下大豆蛋白分子的疏水性殘基有效地暴露出來,分子伸展開,理論上表面疏水性是明顯增強的[20],但在起初不太低的冷凍溫度下,大豆蛋白溶液冷凍濃縮時間延長,水形成冰晶的時間增加,導致冰晶顆粒較大[21],由于機械破壞作用,使得蛋白質的空間結構發生變化,原來展開的肽鏈重新聚集,部分疏水性基團埋藏于蛋白分子內部,使得表面疏水性降低[22]。隨著冷凍溫度的降低,機械破壞作用減小,當冷凍溫度達到-18 ℃時,蛋白分子暴露的疏水性基團最多,表面疏水性最大,當冷凍溫度繼續低至-20 ℃時,破壞了在-18 ℃時所保持的肽鏈伸展狀態,因更低溫度的影響,使得暴露在外部的疏水性氨基酸殘基減少,表面疏水性降低。
2.4 冷凍時間對SPI巰基、二硫鍵和表面疏水性的影響
在冷凍溫度為-18 ℃、SPI與水的質量比為1∶12的條件下,考察冷凍時間的變化對SPI的游離巰基、暴露巰基、二硫鍵和表面疏水性的影響。
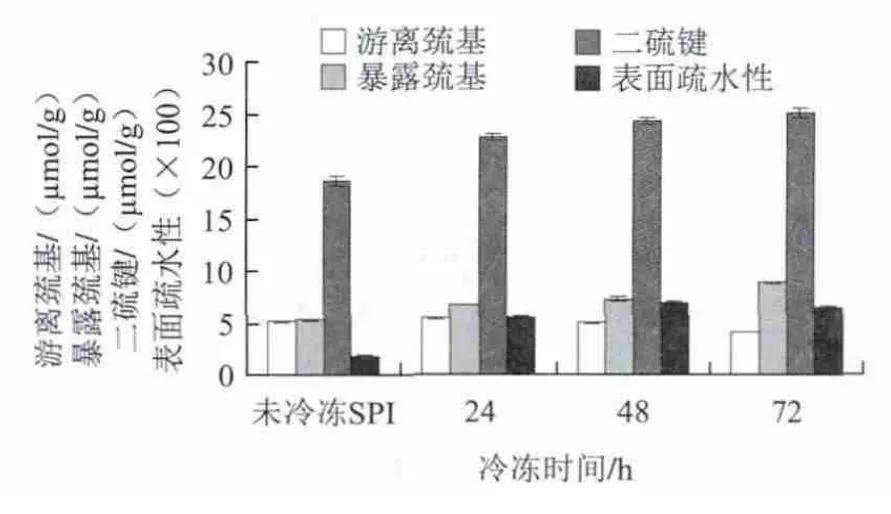
圖3 冷凍時間對SPI巰基、二硫鍵和表面疏水性的影響Fig.3 Effect of freezing time on the contents of sulfhydryl group and disulfide bond and surface hydrophobicity of SPI
由圖3可知,與未冷凍SPI相比,冷凍后的SPI,游離巰基含量整體呈下降趨勢。在其他冷凍參數恒定時,隨著冷凍時間的延長,SPI游離巰基的含量減少,在冷凍72 h時,巰基含量比對照組減少了3/4,其含量為4.15 μmol/g,但是冷凍24 h時,游離巰基含量卻出現比對照組略有增加的現象,其增幅不顯著,可能是由于SPI在初期冷凍時,蛋白質體系不穩定,各種化學鍵和分子間作用力發生不同的變化,導致在冷凍時間較短的情況下,SPI的游離巰基含量會略高于對照組。
冷凍時間對SPI暴露巰基的影響與游離巰基相反,隨著冷凍時間的延長,暴露巰基含量增加,冷凍時間延長到72 h時,暴露巰基含量達到了最大值為8.89 μmol/g,冷凍時間越短,暴露巰基含量越少,但都大于對照組的5.35 μmol/g的暴露巰基含量。
隨著冷凍時間的延長,SPI的二硫鍵逐漸增加,其增幅不顯著,冷凍24~72 h,SPI的二硫鍵含量從22.76 μmol/g增至25.08 μmol/g,其變化量只有2.32 μmol/g。而未冷凍SPI的二硫鍵含量18.63 μmol/g,經對比發現,冷凍時間對SPI二硫鍵影響不大。
在本實驗考察的冷凍時間范圍內,隨著冷凍時間的增加,SPI的表面疏水性呈現先增加后減小的變化趨勢。在冷凍時間分別為24、48、72 h時,表面疏水性分別是548.47、699.93和639.47,其中冷凍48 h時的表面疏水性最大,并且與冷凍24 h和72 h之間差異顯著(P<0.05)。因為冷凍過程實際上就是對蛋白質結構破壞的過程,在適合的冷凍條件范圍內,天然的蛋白分子折疊形成的疏水區域中的疏水性氨基酸側鏈因冷凍破壞作用暴露在分子表面,實驗結果得出,冷凍48 h時暴露疏水性基團最多,表面疏水性最大;當繼續冷凍至72 h時,由于時間的延長,蛋白質的結構遭到進一步破壞,一部分表面巰基可能在儲存時間延長的情況下發生氧化作用,形成表面二硫鍵,使得蛋白分子表面的疏水性基團減少,所以通過ANS熒光檢測時,熒光強度變小,表面疏水性減小。
2.5 冷凍后大豆分離蛋白狀態與結構的關系
大豆分離蛋白分散液經過冷凍貯存后,會出現不可逆的“絮凝”現象。這一現象的產生與SPI的巰基、二硫鍵和表面疏水性的變化密切相關。原因在于冷凍過程使得大豆分離蛋白發生不可逆變性,蛋白大分子空間三級、四級結構遭到嚴重破壞,蛋白分子展開,分子內二硫鍵斷裂,分子表面的巰基重新分布,SPI與水分子結合并發生氧化作用,分子內二硫鍵形成分子間二硫鍵,由于SPI暴露出來的巰基與水分子的結合作用,使解凍后的SPI結構變得膨脹而松散,即形成了絮凝狀態。
3 結 論
本實驗對冷凍條件下SPI的結構變化進行研究,通過單因素實驗分析了冷凍過程中SPI的巰基、二硫鍵及表面疏水性隨SPI添加量、冷凍溫度和冷凍時間的變化情況,由實驗得出隨SPI添加量減小、冷凍溫度降低和冷凍時間的延長,SPI的巰基、二硫鍵、表面疏水性與未冷凍SPI相比均減小,其結構在不同因素水平之間差異較大。SPI與水的質量比為1∶8和1∶16時,二硫鍵含量分別取得最大和最小值,其值分別為28.54、18.66 μmol/g;冷凍溫度為-12 ℃時,巰基和二硫鍵含量最大,表面疏水性較小,-18 ℃時,表面疏水性達到最大;冷凍24 h時SPI的游離巰基含量最大,冷凍72 h時,游離巰基含量最小為4.15 μmol/g。可知冷凍條件變化時,蛋白質的空間結構發生顯著變化。
[1]王洪晶, 華欲飛.脫脂豆粕中不同脂肪氧合酶活力對大豆分離蛋白凝膠性質的影響[J].中國糧油學報, 2006, 21(5): 58-62.
[2]關志強, 宋小勇, 李敏.凍藏條件對蛤的蛋白質冷凍變性的影響及其改善的實驗研究[J].食品科學, 2005, 26(9):166-169.
[3]黃鴻兵.冷凍及凍藏對豬肉冰晶形態及理化品質的影響[D].南京:南京農業大學, 2005: 16-24.
[4]石彥國, 任莉.大豆制品工藝學[M].北京: 中國輕工業出版社, 2001:98-104.
[5]PIKAL-CLELAND K A, RODRí GUEZ-HORNEDO N, AMIDON G L, et al.Protein denaturation during freezing and thawing in phosphate buffer systems: monomeric and tetramericβ-galactosidase[J].Archives of Biochemistry and Biophysics.2000, 384(2): 398-406.
[6]HOU D H, CHANG S K C.Structural characteristics of purified glycinin from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.
[7]ELLMAN G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[8]BEVERIDGE T, TOMA S J, NAKAI S.Determination of SH and SS groups in some food proteins using Ellman’s reagent[J].Journal of Food Science, 1974, 39(1): 49-51.
[9]TANG C H.Thermal denaturation and gelation of vicilinrich protein isolates from threePhaseoluslegumes: a comparative study[J].LWYFood Science and Technology, 2008, 41(8): 1380-1388.
[10]WAGNER J R, SORGENTINI D A.Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepares soy protein isolates[J].Journal of Agricultural and Food Chemistry, 2000,48: 3159-3165.
[11]莫重文, 馬宇翔, 楊國龍.蛋白質化學與工藝性[M].北京: 化學工業出版社, 2007: 143-147.
[12]HUANG Youru, HUA Yufei, QIU Aiyong.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39: 240-249.
[13]陶紅.金線魚胃蛋白酶純化鑒定及結構研究[D].廣州: 華南理工大學, 2008: 35-41.
[14]HOU H D, CHANG K C.Structural characteristics of purified glycinin from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.
[15]WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al.Effects of highpressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids, 2008, 22(4): 560-567.
[16]姜巍巍.轉谷氨酰胺酶對大豆蛋白表面疏水性及粘度的影響[D].哈爾濱: 東北農業大學, 2009: 40-46.
[17]NOH E J, PARK S Y, PAK J I, et al.Coagulation of soymilk and quality of tofu as affected by freeze treatment of soybeans[J].Food Chemistry, 2005, 91(4): 715-721.
[18]關志強, 宋小勇, 李敏.凍藏條件對蛤的蛋白質冷凍變性的影響及其改善的實驗研究[J].食品科學, 2005, 26(9): 166-169.
[19]BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research Internationa, 2003, 36(8): 787-795.
[20]王鳳翼, 錢方.大豆蛋白質生產與應用[M].北京: 中國輕工業出版,2004: 80-81.
[21]HUANG Youru, HUA Yufei, QIU Aiyong.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2): 240-249.
[22]XIANG B Y.Effects of pulsed electric fields on structural modification and rheological properties for selected food proteins[D].Macdonald:McGill University, 2008: 36-47.

