拉果錯鹽湖鹵水15℃等溫蒸發析鹽規律研究
吳敬禮,王學魁,董景崗,沙作良
(天津科技大學海洋科學與工程學院,天津 300457)
拉果錯鹽湖鹵水15℃等溫蒸發析鹽規律研究
吳敬禮,王學魁,董景崗,沙作良
(天津科技大學海洋科學與工程學院,天津 300457)
以西藏拉果錯鹽湖鹵水為研究對象,研究該湖水在15℃蒸發過程中離子的富集規律及析鹽規律,為拉果錯鹽湖資源利用提供基礎數據.實驗結果表明:在蒸發率為52%時硫酸鈉開始析出且在整個蒸發過程中都大量析出;鉀在蒸發率為87%時開始析出;鋰在蒸發率為82%時達到最高質量濃度2.30g/L,Li2CO3在鹵水中已達到該溫度下的溶解平衡,會以Li2CO3形式析出;硼在蒸發率為67%時開始大量析出,母液中硼的最高質量濃度為15.92g/L.
拉果錯;鹽湖;析鹽規律;相圖
研究蒸發過程析鹽規律是鹽湖資源開發必不可少的前期科研工作,它們能給鹽田設計和各組分分離提取工藝提供基本依據.拉果錯位于西藏阿里高原南部,其中心緯度84°05′N,經度32°02′E,湖面海拔4,470,m,屬于高原亞寒帶干旱區.湖水化學類型屬于硫酸鈉亞型,富含Li、B、K等有開采價值的元素,含鹽量為5.5%~6.5%.迄今為止,對于此鹽湖湖水體系的基礎性研究鮮有報道[1-2],未見蒸發析鹽規律的研究.我國新疆、四川、青海及其他省份也普遍存在硫酸鈉亞型鹵水[3-5],針對這些鹽湖資源,目前進行開發利用研究較少.
1 材料與方法
1.1 實驗原料
拉果錯湖水具有低Ca2+、Mg2+的特征.湖水密度1.048g/cm3、pH 9.03、黏度1.464,mPa·s,其主要化學成分見表1.
實驗所用鹵水根據拉果錯鹽湖鹵水組成進行配制,密度1.049g/cm3、pH 9.68、黏度1.253,mPa·s,其主要化學成分見表2.盡管所配制的鹵水與該鹽湖湖水組成略有差異,由于鹽湖湖水離子組成隨著季節變化會發生變化,這種差異是可以接受的.
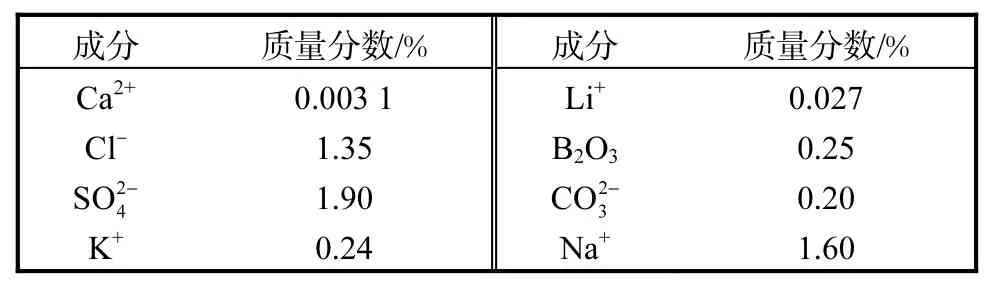
表1 拉果錯鹽湖鹵水主要化學組成Tab. 1 Main chemical composition of the Laguocuo brine

表2 配制鹵水主要化學組成Tab. 2 Main chemical composition of the artificially synthesized brine
1.2 實驗方法
鹵水蒸發析鹽實驗參考了有關海鹵水蒸發析鹽規律的研究報道[6-8].青藏高原湖區夏季的日平均氣溫一般在15℃左右,因此本實驗選擇在15℃條件下進行析鹽規律研究.考慮到若在實驗室內進行15℃等溫蒸發,不僅耗時較長,而且能源消耗也較大,因此本實驗采用高溫沸騰蒸發,15℃平衡冷卻的實驗方法進行鹽湖鹵水蒸發析鹽實驗.
將定量的實驗鹵水置于搪瓷缸,加熱至沸騰蒸發.在搪瓷缸中設有攪拌器,以避免因在蒸發過程中固相析出而固結在搪瓷缸底部,影響傳熱效果.同時控制攪拌速率防止鹵水在蒸發過程中濺出搪瓷缸.當蒸發水量接近預定的質量蒸發率(簡稱蒸發率,后同)時,將蒸發后的試樣連同搪瓷缸轉移至平衡槽內進行恒溫平衡,并準確控制平衡槽溫度為15℃,平衡時間至少為3d.平衡期間繼續攪拌試樣,特別是有大量固相生成的試樣.平衡結束后,再次進行稱量,以確定出準確的蒸發率,然后進行固液分離,并分別取固相和液相樣品進行分析.
蒸發率ω按照式(1)進行計算

式中:m原為蒸發時所配原始鹵水質量,g;m剩為蒸發后液相與固相質量,g.
1.3 樣品分析方法
液相中各種離子(或物質)含量的分析參照文獻[9]進行,具體分析方法如下:用硝酸銀容量法測定Cl-含量;用EDTA絡合滴定法測定Ca2+、Mg2+含量;用火焰原子吸收光度法測定Li+含量;用四苯硼酸鉀重量法測定K+含量;用硫酸鋇重量法測定SO含量;用甘露醇容量法測定B2O3含量;用酸堿滴定法測定CO、HCO含量;用差減法計算Na+含量.
液相樣品密度采用密度瓶法測定;pH采用pH分析儀測定;黏度采用烏式黏度計測定;水分采用失重法測定.
2 結果與討論
2.1 分析測定結果
實驗鹵水15℃等溫蒸發,各階段鹵水蒸發率、液相的密度、pH、黏度及化學組成分別見表3、表4.
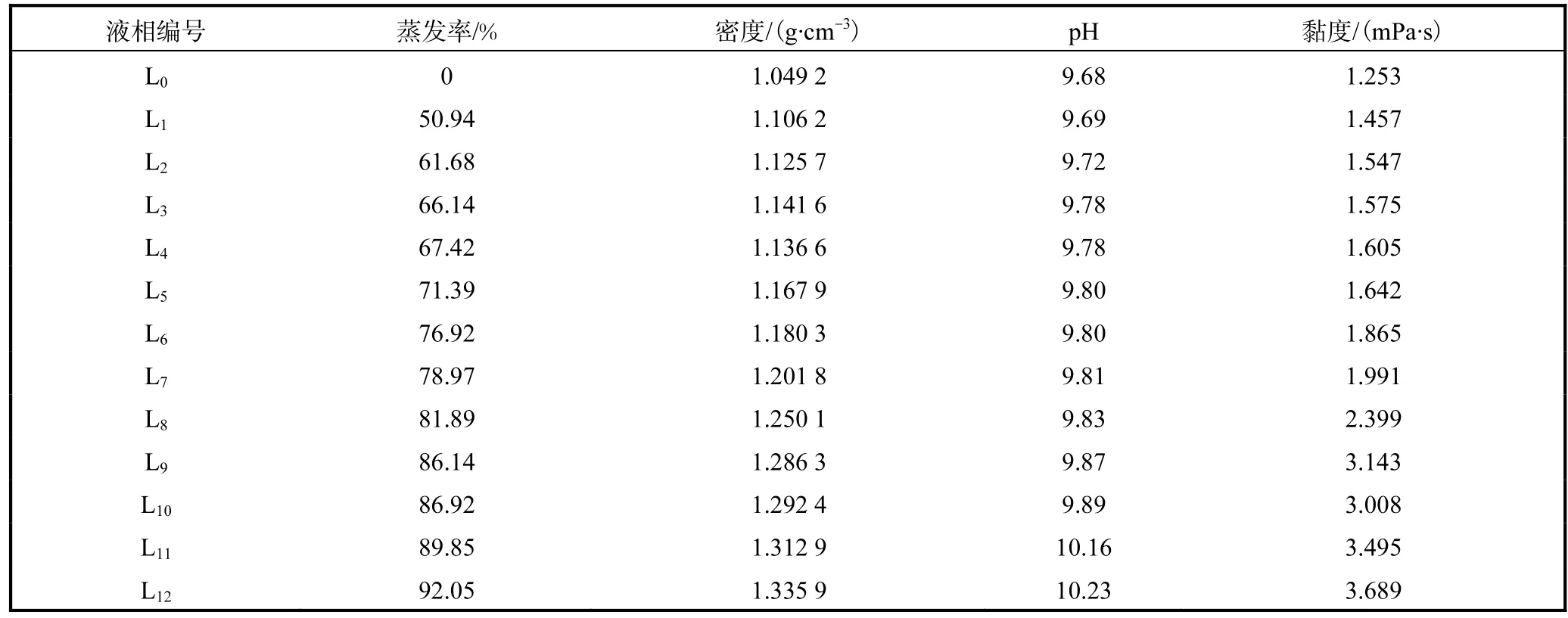
表3 鹵水蒸發過程中液相的物化性質Tab. 3 Physicochemical properties of the liquid phase of the evaporation process of brine
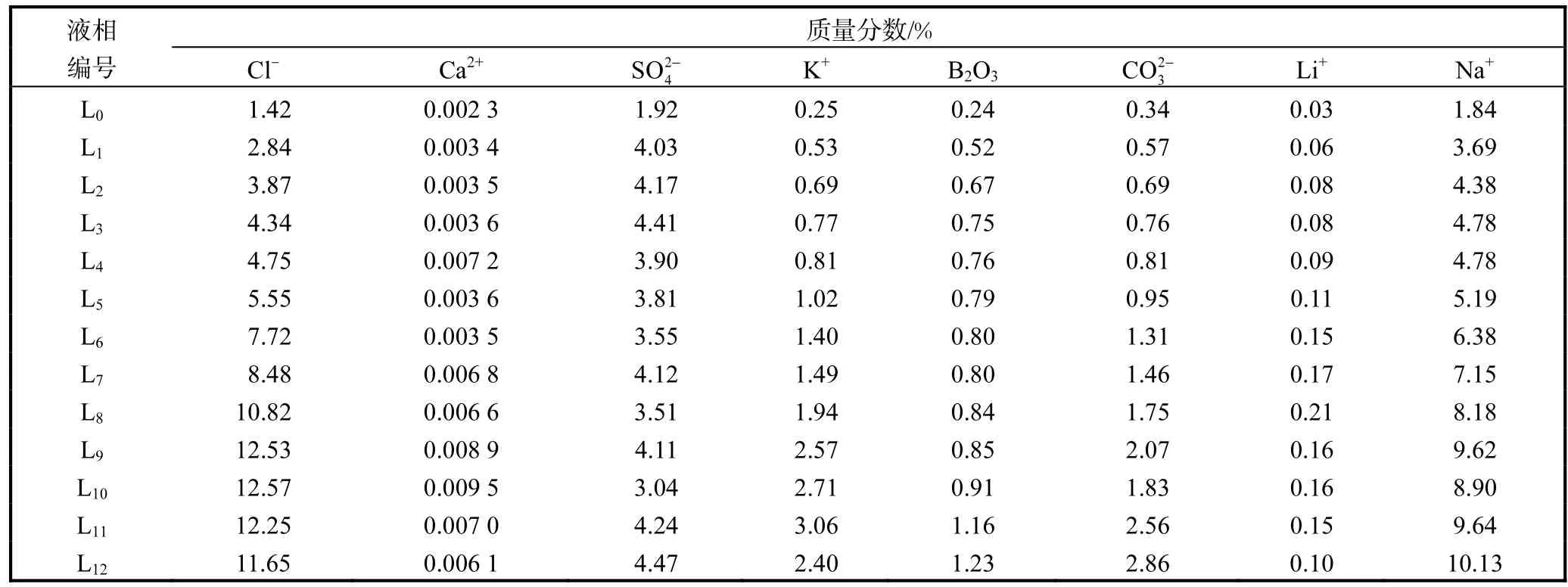
表4 拉果錯鹽湖鹵水15℃蒸發液相組成Tab. 4 Chemical composition of the liquid phase of the Laguocuo brine at 15℃
2.2 主要鹽類析出情況
母液中Na+、K+、Cl-、SO的質量分數與蒸發率關系如圖1所示.
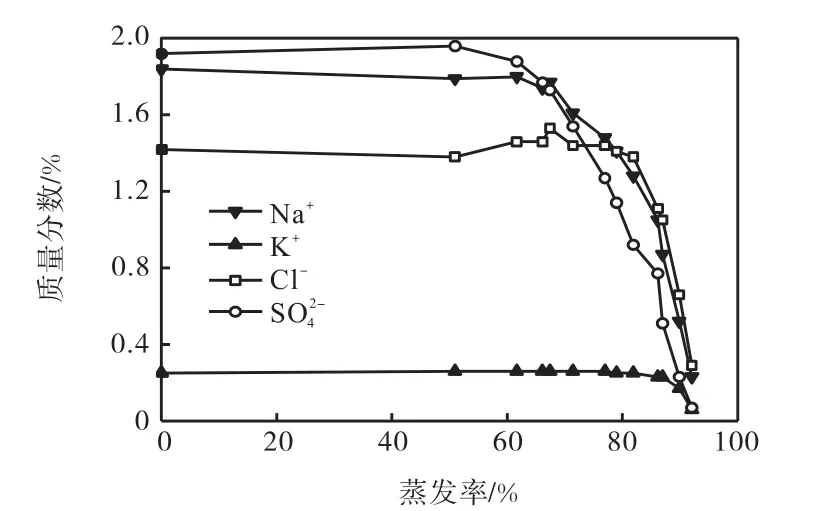
圖1 母液中Na+、K+、Cl-、SO的質量分數與蒸發率關系Fig. 1 Relationship between mass fraction of Na+,K+,ClandSOin the mother liquor and the rate of evaporation
15℃蒸發過程中,在蒸發率達到87%之前,K+質量分數基本保持不變,蒸發率達到87%后,K+質量分數迅速降低,含鉀鹽類開始析出.
2.3 鋰、硼的富集
2.3.1 鋰的富集行為
拉果錯湖水低Ca2+、Mg2+的特征易于Li2CO3提取,液相中主要元素Li+的蒸發富集行為如圖2、圖3所示.
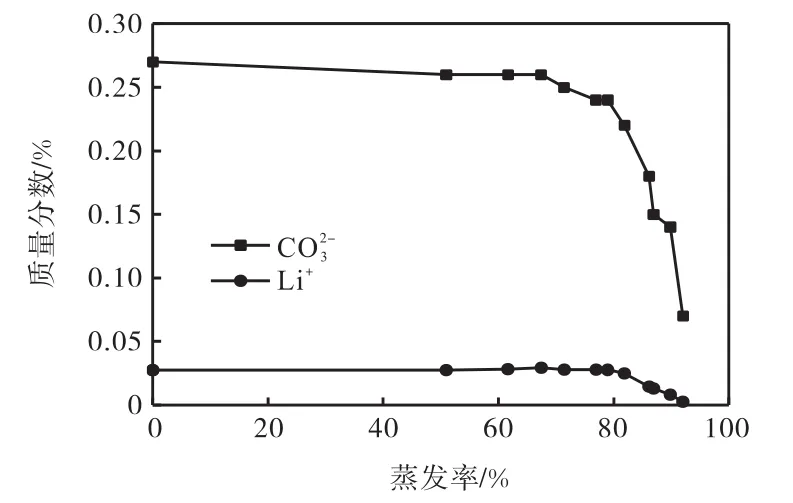
圖2 母液中Li+、CO質量分數與蒸發率關系Fig. 2The relationship between mass fraction of Li+,COin the mother liquor and the rate of evaporation
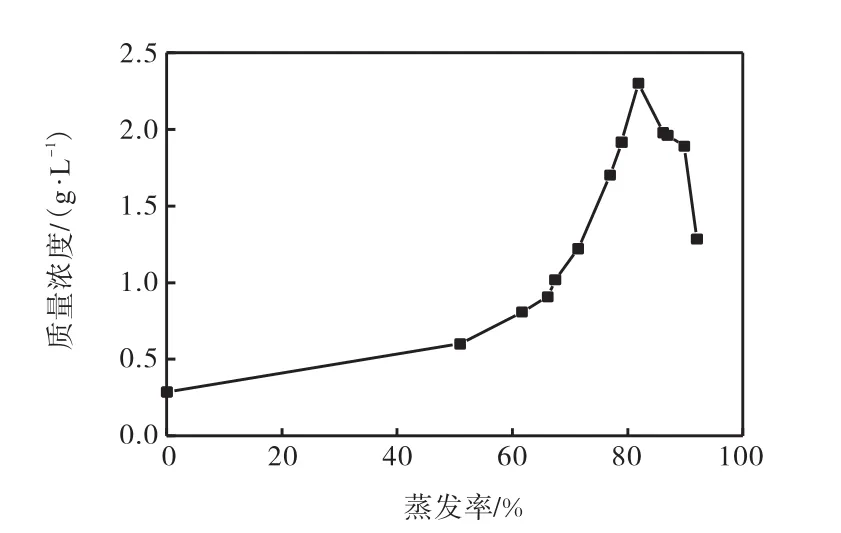
圖3 母液中Li+質量濃度與蒸發率關系Fig. 3Relationship between lithium concentration in the mother liquor and the rate of evaporation
2.3.2 硼的富集行為
在蒸發過程中,液相中硼(以B2O3計)的變化行為如圖4和圖5所示.由圖4可知:在鹵水蒸發率小于67%的過程中,硼沒有固相析出,當蒸發率達到67%左右,硼總量開始下降,說明有含硼固相析出.但由圖5可知:隨著蒸發率的增加,硼在母液中質量濃度一直在升高,說明在整個蒸發過程中,硼一直在富集,并且在實驗區間質量濃度可達約15.92g/L,這主要是由于pH對溶液的影響,使得溶液中硼氧陰離子配合物的聚結形式不同.當8≤pH≤11,隨著pH繼續增加,硼飽和溶液中幾種硼氧配陰離子的比例發生變化,硼氧配陰離子由低聚合度硼酸鹽陰離子向高聚合度硼酸鹽陰離子轉變,為溶液中硼質量濃度的繼續增加提供條件.
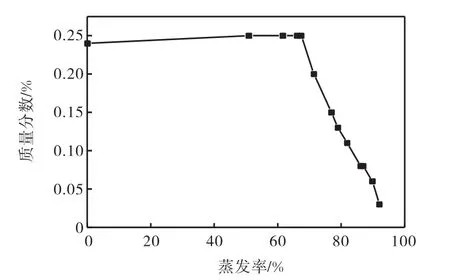
圖4 母液中B2O3質量分數與蒸發率關系Fig. 4 Relationship between mass fraction of B2O3in the mother liquor and the rate of evaporation

圖5 母液中B2O3質量濃度與蒸發率關系Fig. 5 Relationship between B2O3concentration in the mother liquor and the rate of evaporation
2.4 相圖分析
根據鹽湖鹵水和實驗鹵水的化學組成,可簡化為Na+、K+//Cl-、SO–H2O四元水鹽體系.由于文獻沒有該體系15℃相圖,本文分別采用0℃和25℃,Na+、K+//Cl-、SO–H2O四元體系相圖[10]來分析本實驗蒸發析鹽過程,結果如圖6和圖7所示.
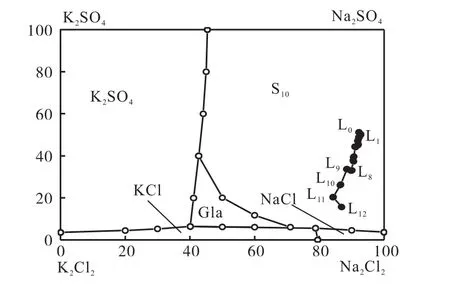
圖6 Na+、K+//Cl-、SO-H2O四元體系0℃等溫相圖及蒸發結晶路線Fig. 6Phase diagram and crystallization path of the quinary system of Na+,K+//Cl-,SO-H2O at 0℃
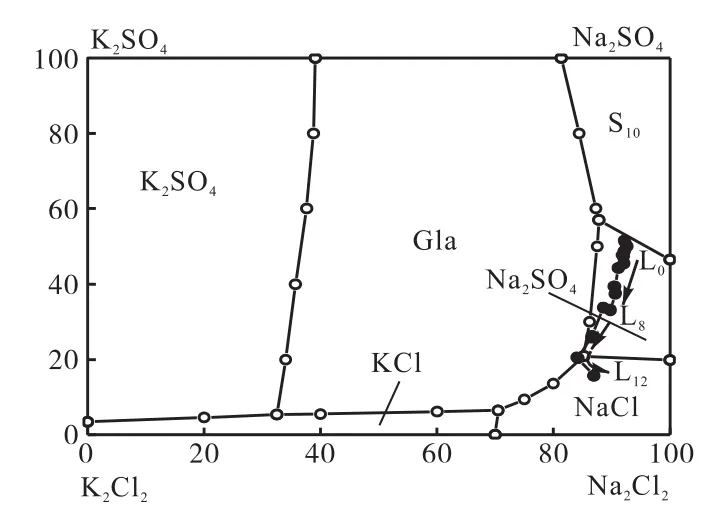
圖7 Na+、K+//Cl-、SO-H2O四元體系25℃等溫相圖及蒸發結晶路線Fig. 7Phase diagram and cry stallization path of the quinary system Na+,K+//Cl-,SO-H2O at 25℃
由圖6可見,在0℃相圖中,整個系統軌跡完全處在芒硝(S10)相區,不能反映實驗鹵水蒸發析鹽情況.通過與25℃相圖(圖7)比較和對實驗結果分析,系統軌跡在25℃相圖變化更與實驗溫度15℃接近,因此,實驗結果采用25℃相圖來分析.
從圖7可以看出,Na+、K+//Cl-、SO-H2O四元水鹽體系25℃相圖包括6個相區,即:氯化鈉、氯化鉀、硫酸鈉、芒硝、鉀芒硝(Gla)以及硫酸鉀區域.將本實驗液相點標繪于該相圖中,其變化趨勢用箭頭表示.由圖7可知:實驗鹵水系統點L0位于Na2SO4相區,蒸發過程中多數液相點集中在Na2SO4相區內,隨著蒸發率的增加,向Na2SO4、Gla和NaCl共飽點運動.而對相圖進行理論分析可知,系統軌跡會沿著系統點L0與Na2SO4固相點直線連線向Na2SO4與Gla共飽線運動,兩鹽共析,然后沿著共飽線移動,到達Na2SO4、Gla及NaCl三相共飽點,直至蒸干.鹵水實際系統軌跡與理論軌跡存在差異,主要是因為實驗是在15℃條件下進行,其溫度要比25℃低,實驗鹵水會形成自己獨特的結晶路線.
3 結 論
鈉鹽在蒸發率達到52%時以硫酸鈉形式析出,在蒸發率達到86%時氯化鈉開始析出;鉀鹽在蒸發率87%之后才有鉀鹽析出,析出鉀鹽為硫酸鉀和氯化鉀.整個蒸發過程中,硼一直是處在富集狀態,母液中硼的最高質量濃度可達15.92g/L;鋰在蒸發率為82%時達到最高質量濃度2.30g/L,此后由于鹵水中有CO存在,Li+會以Li2CO3形式析出.
[1] 昇于松. 西藏鹽湖及其水系中的痕量金屬[J]. 海洋與湖沼,1992,23(4):407–413.
[2] 劉俊英,鄭綿平,羅健. 西藏拉果錯鹵蟲:Ⅰ. 生物學特征[J]. 湖泊科學,1998,10(2):92–95.
[3] 姫連敏,李麗娟,張波,等. 我國硫酸鹽型鹽湖鉀鎂鋰資源的分析工藝以及與猶他州合作領域的探討[J]. 材料導報:納米與新材料專輯,2011,25(專輯17):198–202.
[4] 程懷德,馬海州. 我國硫酸鹽型鹽湖資源與開發現狀[J]. 礦產保護與利用,2009(6):52–55.
[5] 紀律,林浩宇,程學業,等. 青海硫酸鹽型鉀礦資源制取硫酸鉀工藝研究[J]. 化工礦物與加工,2003,32(6):5–7.
[6] 孫之南,郭紹珍. 海水蒸發濃縮析鹽規律研究[J]. 海湖鹽與化工,1985,14(4):1–8.
[7] K?l?c ?,K?l?c A M. Recovery of salt co-products during the salt production from brine[J]. Desalination,2005,186(1/2/3):11–19.
[8] 左秉堅. 制鹽工業手冊[M]. 北京:中國輕工業出版社,1994:105–106.
[9] 中國科學院青海鹽湖所分析室. 鹵水和鹽的分析方法[M]. 2版. 北京:科學出版社,1988.
[10] 牛自得,程芳琴. 水鹽體系相圖及其應用[M]. 天津:天津大學出版社,2002.
責任編輯:周建軍
Salting-out Law of the Brine from the Laguocuo Salt Lake through Isothermal Evaporation at 15℃
WU Jingli,WANG Xuekui,DONG Jinggang,SHA Zuoliang
(College of Marine Science and Engineering,Tianjin University of Science & Technology,Tianjin 300457,China)
Laguocuo Salt Lake brine in Tibet was used in the research to study its enrichment behavior and the crystallization process through isothermal evaporation at 15℃,which can provide basic data for the utilization of the brine. The experiment showed that sodium sulfate began to precipitate when the evaporation rate reached 52%,and a large quantity of precipitation took place during the whole evaporation process;potassium began to precipitate when the evaporation rate reached 87%;the maximum mass concentration of Li+in the mother liquor was 2.30g/L when the evaporation rate was 82%;Li2CO3precipitated when it reached the dissolution equilibrium in the brine;boron began to precipitate when the evaporation rate reached 67% and the maximum mass concentration of B2O3in the mother liquor was 15.92g/L.
Laguouco;saltlake;salting-out law;phase diagram
TS352
A
1672-6510(2014)03-0049-04
10.13364/j.issn.1672-6510.2014.03.010
2013–09–03;
2013–12–10
天津市自然科學基金資助項目(12JCZDJC30000,12JCZDJC28200)
吳敬禮(1988—),男,山東棗莊人,碩士研究生;通信作者:董景崗,副教授,dongjinggang@tust.edu.cn.

