TGase催化玉米醇溶蛋白糖基化改性
周利敏,劉曉蘭,劉 玥,鄭喜群
(齊齊哈爾大學食品與生物工程學院,農產品加工黑龍江省普通高校重點實驗室,黑龍江 齊齊哈爾 161006)
TGase催化玉米醇溶蛋白糖基化改性
周利敏,劉曉蘭,劉 玥,鄭喜群*
(齊齊哈爾大學食品與生物工程學院,農產品加工黑龍江省普通高校重點實驗室,黑龍江 齊齊哈爾 161006)
利用轉谷氨酰胺酶(transglutaminase,TGase)催化玉米醇溶蛋白與氨基葡萄糖鹽酸鹽(glucosamine hydrochloride,GAH)發生交聯反應。通過SDS-聚丙烯酰胺凝膠電泳確認玉米醇溶蛋白與GAH發生交聯反應。以玉米醇溶蛋白糖基化修飾產物中GAH導入量為指標,優化糖基化反應條件,并對玉米醇溶蛋白糖基化修飾樣品的溶解性進行了表征。結果表明,最適的糖基化反應條件為底物質量濃度5 g/100 mL、TGase添加量50 U/g(以玉米醇溶蛋白計)、玉米醇溶蛋白中酰基供體與GAH中的酰基受體物質的量比1∶6、初始pH 8.0、反應溫度44 ℃、反應時間7 h;此反應條件下,玉米醇溶蛋白中GAH的最大導入量為(11.34±0.21) mg/g(以玉米醇溶蛋白計)。與玉米醇溶蛋白相比,玉米醇溶蛋白交聯樣品與糖基化修飾樣品的溶解性均得到提高,玉米醇溶蛋白糖基化修飾樣品的溶解性最高。
玉米醇溶蛋白;轉谷氨酰胺酶;糖基化;蛋白質改性
玉米醇溶蛋白是玉米蛋白質的主要成分,約占玉米蛋白含量的68%~72%。玉米醇溶蛋白中主要的氨基酸為谷氨酸(含谷氨酰胺)(約為21%~26%)、亮氨酸(約為20%)、脯氨酸(約為10%)、丙氨酸(約為10%)[1]。其中,谷氨酰胺為TGase催化蛋白質與糖共價交聯的作用位點。非極性氨基酸含量高,堿性和酸性氨基酸缺乏,且賴氨酸和色氨酸含量極低,對機體來說,玉米醇溶蛋白是不完全蛋白質。特殊的氨基酸組成造成玉米醇溶蛋白不溶于水,易溶于乙醇溶液、十二烷基硫酸鈉、高濃度尿素等有機溶劑的特性,限制了其在食品工業中的實際應用。
20世紀80年代已有糖與蛋白之間共價結合作用的相關報道。基于這一結合特性,蛋白質糖基化改性方面的研究逐漸得到展開[2]。已有研究表明:蛋白質多肽鏈中糖鏈的引入,使得蛋白質的功能性,如溶解性、熱穩定性、乳化性、起泡性、凝膠性等得到顯著改善,甚至增加某些蛋白質的抗氧化性、抑菌性和降低免疫原性[3]。
目前,酶法糖基化反應主要是用糖基轉移酶[4]、糖苷酶[5]或轉谷氨酰胺酶(transglutaminase,TGase)[6-7]催化糖基連接到受體分子上。由于底物的高度專一性,糖基轉移酶很難在體外直接催化蛋白質與糖類物質發生糖基化反應。糖苷酶專一性較低,合成的糖基化產物很少。微生物TGase因來源廣泛、價格低廉、安全性高而被廣泛關注。Villalonga等[8]研究了TGase催化胰蛋白酶與β-環糊精衍生物交聯反應條件,表征了修飾產物的熱穩定性;Jiang Shujuan等[9-10]研究了TGase催化大豆分離蛋白或酪蛋白與氨基葡萄糖鹽酸鹽(glucosamine hydrochloride,GAH)交聯反應條件,表征了修飾產物的溶解性、乳化性、起泡性等功能性質,均得到不同程度的改善。
玉米醇溶蛋白的改性大多利用化學方法,包括磷酸化[11]、酰化[12]、去酰胺[13]與交聯劑共價交聯[14]、美拉德糖基化[15]、成脂和成氫鍵改性[16]等。采用TGase催化玉米醇溶蛋白糖基化反應尚無報道。與化學方法相比,TGase催化玉米醇溶蛋白糖基化反應具有特異性強、反應條件溫和、速率高、周期短、無毒副作用等優點。本實驗利用TGase催化GAH接枝到玉米醇溶蛋白分子上,優化了糖基化反應條件,以期為玉米醇溶蛋白在食品工業的研究及應用提供基礎方法。
1 材料與方法
1.1 材料與試劑
玉米蛋白粉 中糧生化能源(龍江)有限公司;TGase(固體) 泰興市一鳴生物制品有限公司;D-GAH、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate, sodium salt-polyacrylamide gelelectrophoresis,SDS-PAGE)標準蛋白 上海生工生物工程有限公司。其他試劑均為分析純。
1.2 方法
1.2.1 玉米醇溶蛋白的提取
采用60%~95%乙醇萃取法[17]。
1.2.2 原料理化指標測定
玉米醇溶蛋白中總蛋白采用微量凱氏定氮法測定,參照GB 5009.5—1985《食品中蛋白質的測定方法》;GAH中糖含量采用斐林試劑熱滴定法測定;玉米醇溶蛋白、GAH中水分含量采用恒重法測定,參照GB 5497—1985《糧食、油料檢測水分測定法》;TGase采用氧肟酸法測定,參照轉谷氨酰胺酶活測定方法[18]。
1.2.3 TGase催化玉米醇溶蛋白糖基化反應
將玉米醇溶蛋白(蛋白干基)按照一定底物質量濃度配制成懸浮液,以反應體系中酰基供體與酰基受體物質的量比1∶6添加GAH,用2 mol/L NaOH溶液調整初始pH值至7.5。TGase添加量為50 U/g(以玉米醇溶蛋白計,下同),混勻,于37 ℃恒溫水浴振蕩中反應8 h。反應結束后樣品于85 ℃沸水中滅酶5 min,冷卻。4 ℃透析48 h除去未交聯的GAH,樣品凍干備用。
1.2.4 樣品中氨基葡萄糖含量的測定
酸水解后的樣品過濾后,用6 mol/L NaOH溶液調節pH值至偏堿性,取1.5 mL,加入1.5 mL DNS試劑,沸水中反應5 min,冷卻后補加1.0 mL蒸餾水,測定540 nm波長處的吸光度。代入標準曲線(y=0.003x-0.101 3, R2=0.998)中,計算糖含量。重復3 次測定,結果表示為平均值±標準偏差。
1.2.5 SDS-PAGE確認玉米醇溶蛋白與氨基葡萄糖發生交聯反應
SDS-PAGE和考馬斯亮藍蛋白質染色參照郭堯君[19]、Laemmli[20]等的方法。糖蛋白染色和脫色參照Zacharius等[21]的方法。標準蛋白如下:磷酸酶b(97.4 kD)、牛血清白蛋白(66.2 kD)、卵白蛋白(43.0 kD)、碳酸苷酶(31.0 kD)、胰蛋白酶抑制劑(20.1 kD)、溶菌酶(14.4 kD)。辣根過氧化物酶(糖蛋白)作為陽性對照,玉米醇溶蛋白作為陰性對照。通過考馬斯亮藍蛋白染色顯示玉米醇溶蛋白與GAH發生糖基化反應后分子質量變化情況;通過PAS染色法,即過碘酸雪夫染色法檢測玉米醇溶蛋白糖基化修飾產物中糖基的存在,以辣根過氧化物酶為陽性對照品,確認糖蛋白。
1.2.5.1 電泳實驗
配制3 g/L的蛋白溶液,取100 μL于1.0 mL離心管中,與樣品緩沖溶液1∶1混合,10 000 r/min離心5 min,取上清液沸水浴中煮沸5 min后冷卻備用。進樣量每孔10 μL。分離膠和濃縮膠質量分數分別為12%和3%,并分別設定電壓為120 V和80 V時進行電泳。
1.2.5.2 蛋白質染色和脫色
用蛋白質固定液(甲醇、冰乙酸、水體積比為2∶1∶7)固定膠片1 h后,將膠片放入蛋白質染色液中(含0.25%考馬斯亮藍R-250、45%甲醇、10%冰乙酸)染色6 h左右,然后用脫色液(甲醇、冰乙酸、水體積比為1∶1∶8)進行脫色,更換脫色液直至條帶清晰、背景顏色完全褪去為止。
1.2.5.3 糖蛋白染色和脫色
用糖蛋白固定液(12.5%三氯乙酸)固定膠片15 min,雙蒸水洗2 次。1%高碘酸處理15 min,振蕩水洗5 min,3 次。膠片浸于希夫試劑(Schiff試劑),室溫避光染色30 min。染色結束倒去染色液,用0.5%偏重亞硫酸鈉洗脫液振蕩水洗5 min,5 次。利用凝膠成像系統分析蛋白質染色成像和糖染色成像。在兩塊膠中對應位置同時被染色的物質就是糖蛋白。
1.2.6 樣品溶解性的測定
1.2.6.1 樣品制備
按照1.2.3節所示方法,最適條件制備玉米醇溶蛋白修飾樣品,透析后調pH值為7.0,樣品凍干,備用。不加GAH,其他條件相同,制備對照品1:玉米醇溶蛋白交聯樣品。對照品2:玉米醇溶蛋白,復溶后,調pH 7.0,凍干備用。
1.2.6.2 溶解性測定
準確稱量0.060 0g(蛋白干基)樣品及對照品,加入10 mL pH 2~12的緩沖溶液,漩渦混勻30 s,置于4 ℃過夜使其充分水合,8 000×g、4 ℃離心10 min,轉出上清液,利用紫外分光光度計測定其上清液在280 nm波長處的吸光度(水調零)。
2 結果與分析
2.1 理化指標測定結果
經測定,玉米醇溶蛋白中總蛋白含量為90.41%;GAH中糖含量為96.28%;玉米醇溶蛋白、GAH中水分含量分別為5.13%、0.18%;TGase比活力為1.05×103U/g。
2.2 底物質量濃度對玉米醇溶蛋白糖基化反應的影響
在TGase添加量60 U/g、酰基供受體物質的量比1∶6添加GAH、初始pH 7.5、溫度37 ℃、反應時間8 h條件下,探索不同的底物質量濃度3、4、5、6 g/100 mL對玉米醇溶蛋白與GAH糖基化反應的影響,結果如圖1所示。

圖1 玉米醇溶蛋白修飾樣品接糖量隨底物質量濃度變化情況Fig.1 Relationship between the amount of GAH conjugated onto zein and substrate concentration
由圖1可見,隨底物質量濃度升高,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,5 g/100 mL時達到最大值,為5.37 mg/g。可能的原因為,相同反應體系下,一定程度內底物質量濃度越高,TGase的作用位點越多,催化速率加快,玉米醇溶蛋白中GAH導入量越大。TGase還可以催化蛋白質形成自交聯,底物質量濃度過高時,玉米醇溶蛋白分子自交聯的程度也增大,所產生的空間位阻較大,阻礙了糖基的導入。Yan[22]等報道了大分子的寡糖糖基導入蛋白分子中會影響相鄰位點上糖基的導入,這與分子的空間位阻增大有關。
2.3 TGase添加量對玉米醇溶蛋白糖基化反應的影響
底物質量濃度5 g/100 mL時,探索不同的TGase添加量(40、50、60、70 U/g)對玉米醇溶蛋白與GAH糖基化反應的影響,結果如圖2所示。
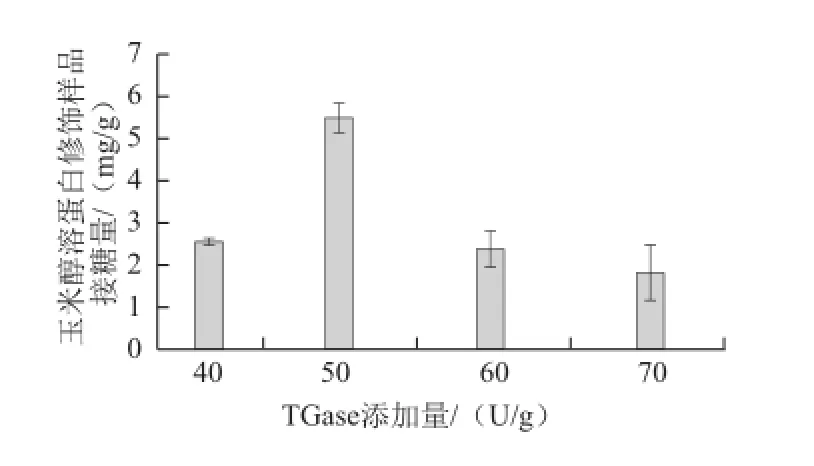
圖2 玉米醇溶蛋白修飾樣品接糖量隨TGase添加量變化情況Fig.2 Relationship between the amounts of GAH conjugated onto zein and TGase dosage
由圖2可見,隨TGase添加量升高,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,50 U/g時達到最大值,為5.48 mg/g。根據酶促反應動力學相關知識,當反應體系中底物質量濃度足夠大時,最大反應速度與酶濃度成正比。由米氏方程可知,當底物質量濃度一定時,酶促反應速度正比于最大反應速率。因此,底物質量濃度一定時,酶促反應速率與酶濃度成正比。但當TGase添加量過高時,加大了玉米醇溶蛋白分子自交聯的程度,較大的空間位阻阻礙糖基的導入。因此,TGase的濃度不宜過高。
2.4 GAH添加量對玉米醇溶蛋白糖基化反應的影響
TGase添加量50 U/g時,探索不同的GAH添加量(酰基供受體物質的量比1∶5、1∶6、1∶7)對玉米醇溶蛋白與GAH糖基化反應的影響,結果如圖3所示。
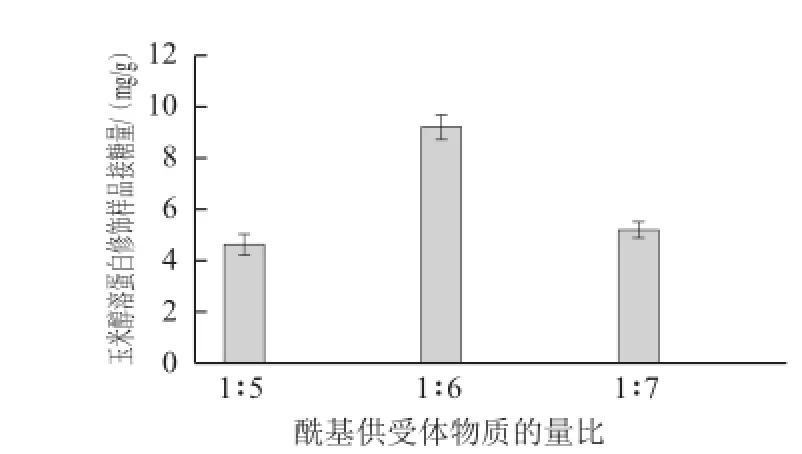
圖3 玉米醇溶蛋白修飾樣品接糖量隨酰基供受體物質的量比變化情況Fig.3 Relationship between the amount of GAH conjugated onto zein and GAH concentration
由圖3可見,隨GAH添加量升高,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,當酰基供受體物質的量比1∶6時達到最大值,為9.17 mg/g。可能的原因為,當GAH添加量較少時,玉米醇溶蛋白與GAH分子間有效碰撞幾率較小,導致糖基化反應發生的幾率較小。但GAH添加量過高易形成高黏度的糖溶液,阻礙體系中分子的擴散,不利于反應的進行。李志銳等[23]等研究了不同濃度的葡萄糖溶液對玉米醇溶蛋白黏度的影響,發現葡萄糖濃度越高,玉米醇溶蛋白的黏度越大。
2.5 初始pH值對玉米醇溶蛋白糖基化反應的影響
酰基供受體物質的量比1∶6時,探索不同的初始pH值(6.5、7.0、7.5、8.0、8.5)對玉米醇溶蛋白與GAH糖基化反應的影響,結果如圖4所示。
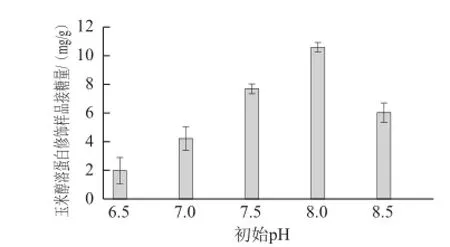
圖4 玉米醇溶蛋白修飾樣品接糖量隨初始pH值變化情況Fig.4 Relationship between the amount of GAH conjugated onto zein and initial reaction pH
由圖4可見,隨初始pH值升高,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,當初始pH值為8.0時達到最大值,為10.58 mg/g。可能的原因為,玉米醇溶蛋白的等電點為pH 6.0左右,在pH6.5~8.5范圍內,玉米醇溶蛋白的溶解性隨pH值增大而增大,體系中可溶性玉米醇溶蛋白的濃度升高,GAH可接觸的谷氨酰胺位點增多,使得玉米醇溶蛋白中糖基的導入量增加。反應pH值是影響酶活力的一個重要因素,TGase最適pH值為6.0,在pH 5.0~8.0之間也有較高的活性。但pH 6.0為玉米醇溶蛋白的等電點,不利于反應進行。pH 6.5~8.0時,TGase的比活力相對較穩定,pH 8.0時為1006 U/g,稍低于pH 6.0。當反應初始pH值為8.5時,TGase的活性降低為988 U/g。從而,相同的反應時間內,TGase催化玉米醇溶蛋白中GAH的導入量減少。
2.6 反應溫度對玉米醇溶蛋白糖基化反應的影響
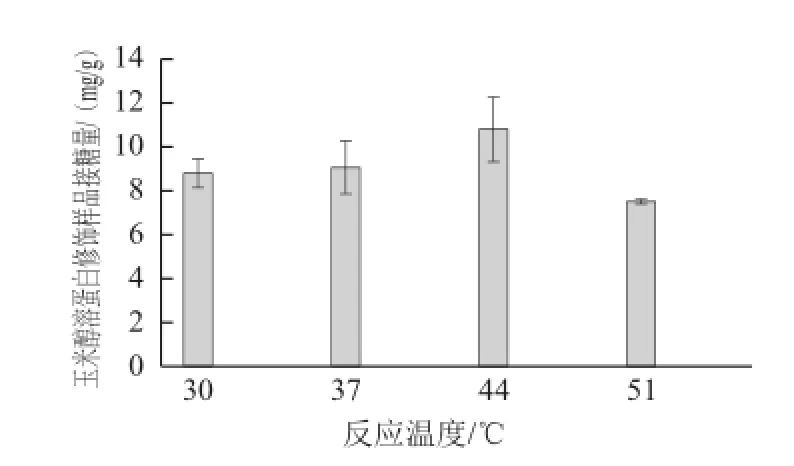
圖5 玉米醇溶蛋白修飾樣品接糖量隨反應溫度變化情況Fig.5 Relationship between the amount of GAH conjugated onto zein and reaction temperature
當初始pH值8.0時,探索不同的反應溫度(30、37、44、51 ℃)對玉米醇溶蛋白與GAH糖基化反應的影響,結果如圖5所示。由圖5可見,隨著反應溫度升高,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,當反應溫度為44 ℃時達到最大值,為10.79 mg/g。TGase的最適反應溫度為50 ℃左右,在40~55 ℃范圍內都有較高活性。一定范圍內,隨著反應溫度的升高,TGase活性增強,有利于糖基化反應進行,同時,TGase催化的糖基化反應的競爭性反應脫酰胺作用也加劇。所以,反應溫度不宜過高。
2.7 反應時間對玉米醇溶蛋白糖基化反應的影響
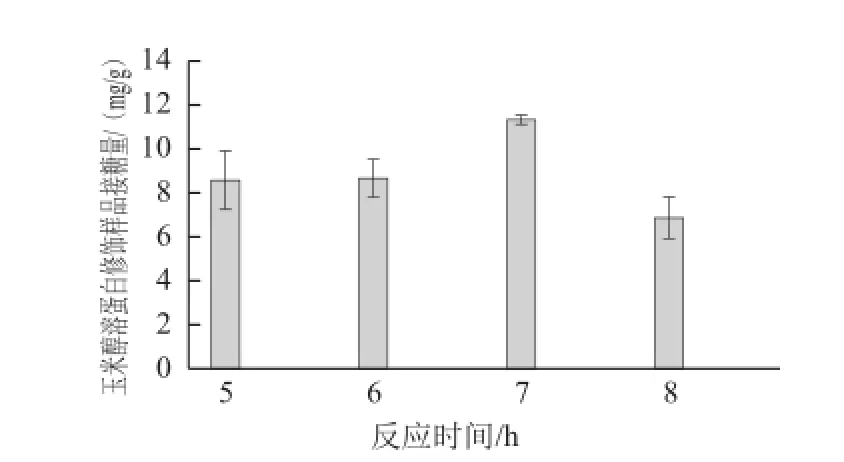
圖6 玉米醇溶蛋白修飾樣品接糖量隨反應時間變化關系Fig.6 Relationship between the amount of GAH conjugated onto zein and reaction time
當反應溫度44 ℃時,探索不同的反應時間(5、6、7、8 h)對玉米醇溶蛋白與氨基葡萄糖糖基化反應的影響,結果如圖6所示。
由圖6可見,隨著反應時間延長,玉米醇溶蛋白中糖基導入量呈現先增加后減少的趨勢,當反應時間為7 h時達到最大值,為11.34 mg/g。5~7 h期間,反應時間延長,玉米醇溶蛋白中GAH的導入量逐漸增多;反應時間繼續延長到8 h,GAH的導入量下降。可能的原因為,在當前弱堿性反應條件下,生成的玉米醇溶蛋白糖基化修飾產物可能不穩定降解。同時,延長反應時間,TGase催化的玉米醇溶蛋白分子中谷氨酰胺殘基的γ-酰胺基和自身或相鄰玉米醇溶蛋白分子中的賴氨酸的ε-氨基發生酰基轉移反應,形成ε-(γ-谷酰胺)-賴氨酸的異肽鍵,生成蛋白-蛋白交聯的大分子,此蛋白大分子空間位阻增大,不利于糖基的導入。
2.8 玉米醇溶蛋白與GAH糖基化反應產物的SDS-PAGE
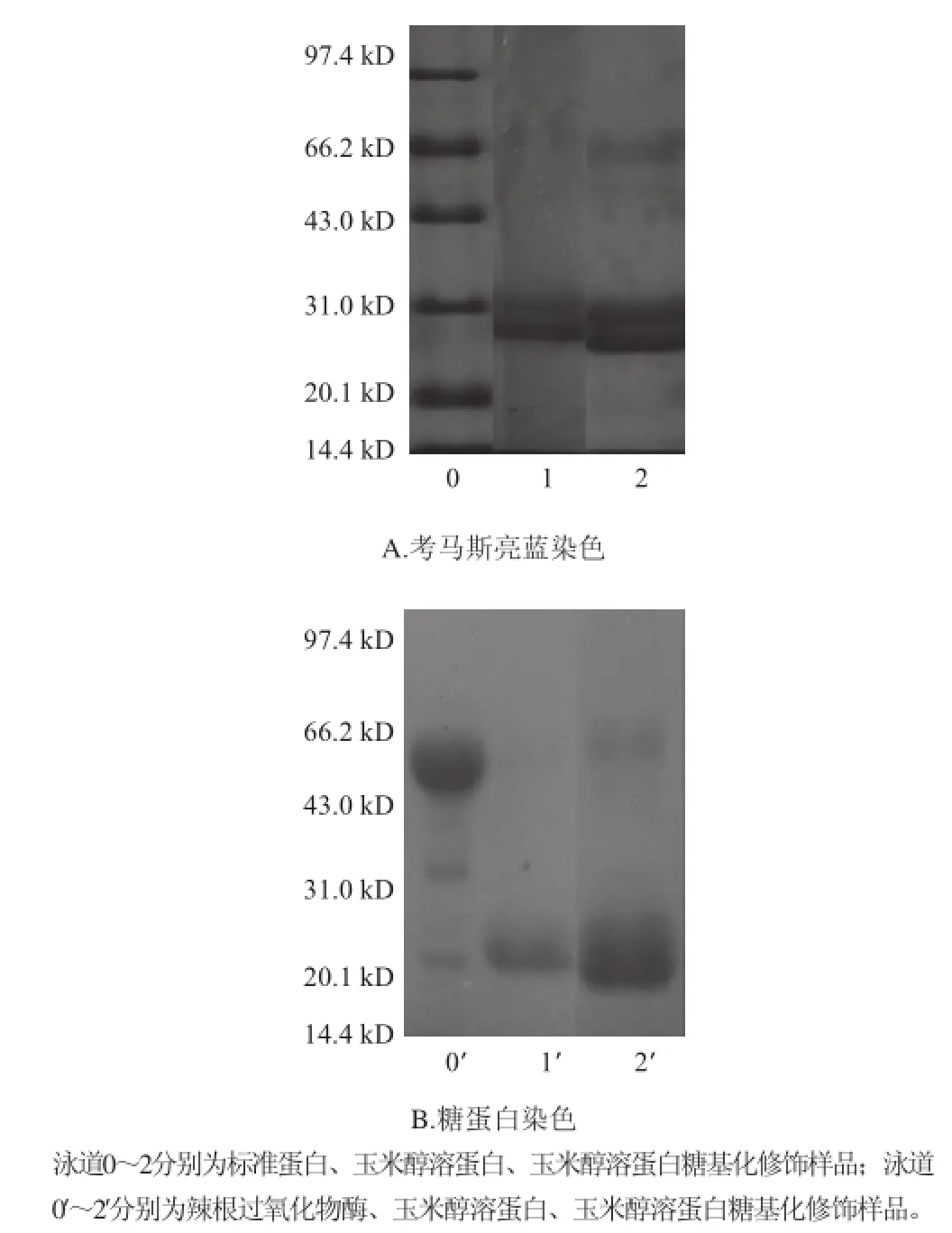
圖7 玉米醇溶蛋白糖基化修飾樣品的SDS-PAGE電泳圖譜Fig.7 Electrophoretic profiles of modified zein
如圖7所示,蛋白染色與玉米醇溶蛋白(泳道1)相比,糖基化的玉米醇溶蛋白(泳道2)中分子質量60 kD左右多了條帶,這可能是由于GAH接枝到玉米醇溶蛋白分子中而形成的大分子。經糖蛋白染色(PAS法)后確定此條帶處含有糖基。與玉米醇溶蛋白相比,糖基化修飾后的玉米醇溶蛋白的兩個亞基發生明顯的變化:蛋白染色中亞基顏色加深(A圖中泳道2),這可能是由于糖基的導入,使得玉米醇溶蛋白的溶解性增加;糖蛋白染色中亞基顏色加深(B圖中泳道2’),證明玉米醇溶蛋白的兩個亞基中也含有糖基,再一次證實了GAH導入了玉米醇溶蛋白分子中。
2.9 糖基化玉米醇溶蛋白的溶解性
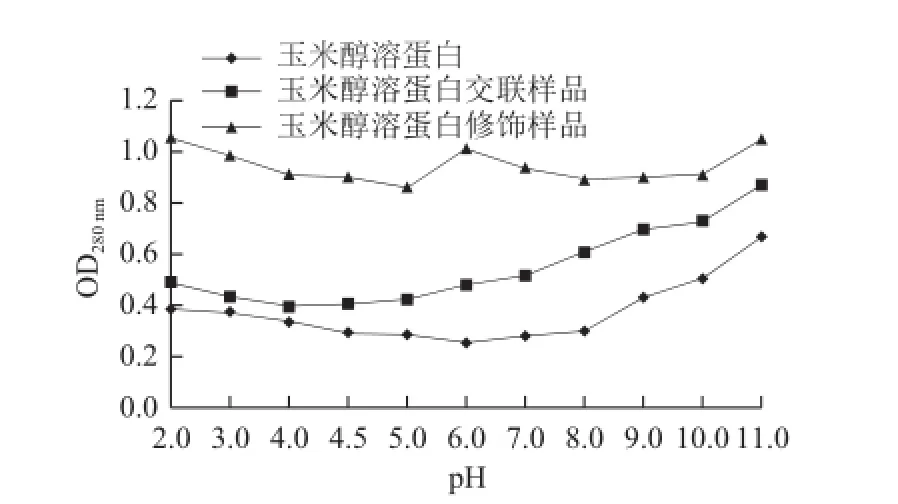
圖8 玉米醇溶蛋白樣品的溶解性Fig.8 Solubility of zein samples
由圖8可以看出,與玉米醇溶蛋白相比,玉米醇溶蛋白交聯樣品和糖基化修飾樣品的溶解性均升高。在測定的所有pH值范圍內,玉米醇溶蛋白修飾樣品的溶解性均最高,等電點處改善的最明顯。可能是因為親水性極強的糖基的導入,玉米醇溶蛋白的分子結構發生改變,增強了玉米醇溶蛋白與水分子之間的相互作用。這與姜淑娟等[24]的研究結果相一致。
TGase催化玉米醇溶蛋白交聯后,等電點向酸性pH值偏移。可能的原因為,相比于玉米醇溶蛋白自身交聯,TGase催化的另一種作用機制更為突出——脫氨作用、脫胺作用使得玉米醇溶蛋白中的谷氨酰胺殘基與水分子結合,生成谷氨酸,暴露出羧基,放出NH3,使等電點改變,溶解度升高,這與Babiker[25]的研究結果一致。此外,玉米醇溶蛋白中賴氨酸含量極低,在TGase催化作用下,玉米醇溶蛋白分子內或間發生交聯作用較弱。
3 結 論
SDS-PAGE法證實了GAH接枝到了玉米醇溶蛋白分子中。確定的玉米醇溶蛋白與GAH最適糖基化反應條件為:底物質量濃度5 g/100 mL、TGase添加量50 U/g、玉米醇溶蛋白中酰基供體與GAH中酰基受體物質的量比1∶6、初始pH 8.0、反應溫度44 ℃、反應時間7 h。該條件下,玉米醇溶蛋白中GAH最大接入量為(11.34±0.21)mg/g。
與玉米醇溶蛋白相比,TGase催化玉米醇溶蛋白交聯樣品及玉米醇溶蛋白糖基化修飾樣品的溶解性均得到較大提高;且在所有pH值范圍內,玉米醇溶蛋白糖基化修飾樣品的溶解性最高。
[1] POMES A F. Zein[J]. Encyclopedia of Polymer Science and Technology, 1971, 15: 125-132.
[2] 周菲菲, 肖更生, 唐道邦, 等. 食品加工中蛋白質的糖基化改性[J].食品工業科技, 2013, 34(21): 390-393.
[3] 盧家成, 孫澤威, 李婷琳. 糖基化反應改善大豆抗原蛋白功能特性的研究進展[J]. 大豆科學, 2012(3): 483-486.
[4] 王軍, 侯丙凱. 植物小分子化合物的糖基化與糖基轉移酶[J]. 植物生理學通訊, 2008, 44(5): 997-1003.
[5] 馮世江, 李春, 曹竹安. 糖苷酶及其在糖基化合物改性中的研究[J].生物加工過程, 2006, 4(3): 16-21.
[6] GOTTARDI D, HONG P K, NDAGIJIMANA M, et al. Conjugation of gluten hydrolysates with glucosamine at mild temperatures enhances antioxidant and antimicrobial properties[J]. LWT-Food Science and Technology, 2014, 57(1): 181-187.
[7] HRYNETS Y, NDAGIJIMANA M, BETTI M. Transglutaminasecatalyzed glycosylation of natural actomyosin (NAM) using glucosamine as amine donor: functionality and gel microstructure[J]. Food Hydrocolloids, 2014, 36: 26-36.
[8] VILLALONGA R, FERNáNDEZ M, FRAGOSO A, et al. Transglutaminase-catalyzed synthesis of trypsin-cyclodextrin conjugates: kinetics and stability properties[J]. Biotechnology and Bioengineering, 2003, 81(6): 732-737.
[9] JIANG Shujuan, ZHAO Xinhuai. Transglutaminase-induced crosslinking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J]. European Food Research and Technology, 2010, 231(5): 679-689.
[10] JIANG Shujuan, ZHAO Xinhuai. Transglutaminase-induced crosslinking and glucosamine conjugation of casein and some functional properties of the modified product[J]. International Dairy Journal, 2011, 21(4): 198-205.
[11] 袁懷波, 劉國慶, 陳宗道. 磷酸化改性玉米蛋白的性質[J]. 食品科學, 2007, 28(10): 50-52.
[12] 趙國華, 王光慈, 陳宗道, 等. 改性對玉米蛋白功能性質及結構的影響(Ⅱ)酰化[J]. 中國糧油學報, 2000, 15(4): 14-17.
[13] ZHANG B, LUO Y C, WANG Q. Effect of acid base treatments on structural rheological, and antioxidant properties of α-zein[J]. Food Chemistry, 2011, 124: 210-220.
[14] ISKENDER A, AHMET Y. Incorporating phenolic compounds opens a new perspective to zein films as flexible bioactive packaging materials[J]. Food Research International, 2011, 44: 550-556.
[15] GHANBARZADEH B, OROMIEHIE A R, MUSAVI M. Effect of plasticizing sugars on rheologocal and thermal properties of zein resins and mechanical properties of zein films[J]. Food Research International, 2006, 39(8): 882-890.
[16] 尹天罡, 何余堂, 解玉梅, 等. 玉米醇溶蛋白改性及食品中應用研究進展[J]. 食品工業科技, 2014, 35(9): 377-380.
[17] 鄭喜群. 玉米黃粉的酶解工藝與抗氧化活性肽的制備[D]. 北京: 中國農業大學, 2006.
[18] FOLK J E, COLE P W. Structural requirements of specific substrates for guinea pig liver transglutaminase[J]. The Journal of Biological Chemistry, 1965, 240: 2951-2960.
[19] 郭堯君. 蛋白質電泳實驗技術[M]. 北京: 科學出版社, 1999.
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophageT4[J]. Nature, 1970, 227: 680-685.
[21] ZACHARIUS R M, ZELL T E, MORRISON J H, et al. Glycoprotein staining following electrophoresis on acrylamide gels[J]. Analytical Biochemistry, 1969, 30(1): 148-152.
[22] YAN S C B, WOLD F. Neoglycoproteins: in vitro introduction of glycosyl units at glutamines in β-casein using transglutaminase[J]. Biochemistry, 1984, 23(16): 3759-3765.
[23] 李志銳, 劉波, 張蘭, 等. 玉米醇溶蛋白功能性質的研究[J]. 中國釀造, 2009, 27(5): 28-31.
[24] 姜淑娟, 趙新淮. 酪蛋白的轉谷氨酰胺酶氨基葡萄糖修飾與功能性變化[J]. 中國乳品工業, 2010, 38(9): 8-11.
[25] BABIKER E E. Effect of transglutaminase treatment on the functional properties of native and chymotrypsin-digested soy protein[J]. Food Chemistry, 2000, 70(2): 139-145.
TGase-Catalyzed Glycosylation of Zein
ZHOU Li-min, LIU Xiao-lan, LIU Yue, ZHENG Xi-qun*
(Key Constructive Laboratory of Processing Agricultural Products of Heilongjiang Province Normal University, College of Food and Biological Engineering, Qiqihar University, Qiqihar 161006, China)
In the present work, transglutaminase (TGase) was used to catalyze covalent cross-linking reaction between zein and glucosamine hydrochloride (GAH). The cross-linking reaction was identified by SDS-PAGE. The reaction conditions were optimized based on the amount of GAH conjugated onto zein. Meanwhile, the solubility of zein modified by glycosylation was characterized. The results showed that the optimized reaction conditions for TGase/zein concentration, zein ratio molar ratio of acyl donor to acceptor, initial reaction pH, temperature and reaction time were 5 g/100 mL, 50 U/g, 1:6, 8.0, 44 ℃ and 7 h respectively. Under these conditions, the amount of GAH conjugated onto zein was (11.34 ± 0.21) mg/g zein. Compared with intact zein, the solubility of both cross-linked zein and glycosylated zein was improved, and glycosylation resulted in the highest solubility.
zein; transglutaminase (TGase); glycosylation; protein modification
Q814.9
A
1002-6630(2014)24-0015-05
10.7506/spkx1002-6630-201424003
2014-08-18
國家自然科學基金面上項目(31371726)
周利敏(1989—),女,碩士研究生,研究方向為玉米綜合加工技術與轉化。E-mail:zhoulimin19890111@163.com*
鄭喜群(1963—),男,教授,博士,研究方向為玉米綜合加工技術與轉化。E-mail:zhengxiqun@126.com

